免疫组化结果判断及常见问题的分析
- 格式:ppt
- 大小:12.85 MB
- 文档页数:10


免疫组化结果分析4则以下是网友分享的关于免疫组化结果分析的资料4篇,希望对您有所帮助,就爱阅读感谢您的支持。
《免疫组化实验结果的判定和分析范文一》免疫组化实验结果的判定和分析免疫组化实验结果的判定和分析就实验结果而言,免疫组化技术服务主要涉及抗体实验结果的描述与分析、图片的确定与选取、相关数据的提供,上述工作是免疫组化工作的重点内容。
只有严格的实验设计、标准的实验操作、专业化的结果分析才能满足客户的要求,更好地为客户提供最优质的服务。
免疫组化结果的判定原则:⒈必须同时设对照染色。
没有对照染色的免疫组化染色结果是不可信的。
⒉抗原表达必须在特定部位。
如LCA应定位在细胞膜上;CK应定位在细胞浆内;PCNA及p53蛋白应定位在细胞核内;EMA应定位在细胞膜上等等。
不在抗原所在部位的阳性着色,一概不能视为阳性。
⒊阴性结果不能视为抗原不表达。
由于检测方法灵敏度有高低之分,有时可因染色方法灵敏度不够,而导致阴性反应,判断时应注意。
⒋尽量避开出血、坏死及切片刀痕和界面边缘细胞的阳性表达,特别是酶免疫标记。
因为这类阳性着色多系内源干扰,或系人为因素所致。
⒌对免疫组化标记结果的意义不能绝对化,应结合临床资料、X线等影像学及实验结果综合分析。
对照染色设计:(一)对照染色的目的设对照的目的是为了排除假阴性和假阳性。
假阴性的原因主要有三种:①组织处理不当,抗原丢失过多或被遮蔽;②抗体失活、效价过低或稀释度不合适(主要指一抗,即特异性抗体);③染色步骤遗漏及差错,或显色剂的选择、缓冲液pH和离子强度不当等。
假阳性均系由多种因素造成的非特异着色所致,原因主要有:①自发荧光或内源酶等干扰;②抗体试剂不纯(特别是一抗);③操作失误,如污染、切片干枯或显色剂操作不当等;④Fc受体的干扰,等等。
(二)对照的种类及其选用目的对照染色大致可分为四类:即阳性组织对照、阴性组织和阴性试剂对照及自身对照。
⒈阳性组织对照指用已证实含有靶抗原的同源及不同源组织切片或细胞涂片与待检实验切片同时作同样处理和免疫染色的组织对照。



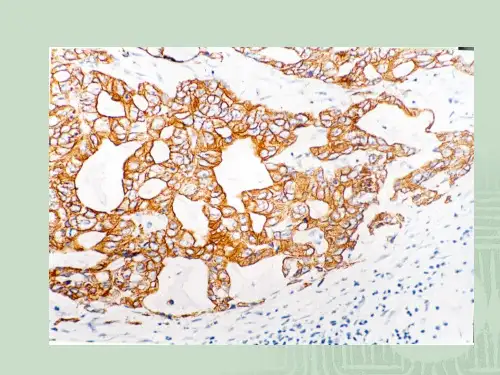
免疫组化实验结果分析免疫组化实验作为一种常用的分子生物学实验技术,广泛应用于医学研究和临床诊断中。
免疫组化实验通过使用特异性抗体与目标分子结合,并通过染色反应来检测分子的存在和定位位置,从而提供关于生物体内蛋白质表达的重要信息。
本文将对免疫组化实验结果进行深入分析,探讨其应用和解读。
免疫组化实验结果分析的第一步是对免疫组织化学染色图像的观察和评估。
通常,免疫组化实验后的标本会显现出不同程度的染色反应,而反应的强度则取决于目标分子在样本中的表达水平。
通过观察染色的颜色强度和分布范围,我们可以初步判断目标分子的表达情况。
一般来说,染色越强,表示目标分子的表达水平越高。
然而,仅凭免疫组化实验的染色结果进行定性判断是远远不够的,我们还需要进一步进行定量分析和解读。
为了准确评估目标分子的表达水平,在免疫组化实验中常会使用数字图像分析技术。
这种技术可以通过对数字图像进行计算和统计分析,获得更加客观的结果。
数字图像分析的方法有很多种,其中最常用的是计算染色物的光密度。
通过光密度值的计算和比较,我们可以比较不同样本之间目标分子表达的差异。
通常情况下,光密度越高表示目标分子的表达水平越高,反之则较低。
除了光密度,我们还可以利用数字图像分析来计算目标分子在特定区域的表达强度。
通过在数字图像上划定感兴趣的区域,计算其中目标分子的表达强度,可以帮助我们更加准确地评估目标分子的表达水平。
同时,这种方法也可以用来检测目标分子在不同区域之间的表达变化。
另外,在免疫组化实验的结果分析中,我们还需要考虑到一些可能的干扰因素。
例如,免疫组化实验中的染色剂和抗体可能会出现非特异性反应,导致某些背景噪声。
此外,不同的样本处理和实验条件可能会对结果产生一定的影响。
因此,在结果的解读过程中,我们需要仔细分析和对比不同样本之间的差异,并确保所得的结论是可靠和可重复的。
免疫组化实验结果的分析不仅可以用于科学研究,还可以在临床诊断中发挥重要作用。

(1)首先要确定免疫组化技术是否合格,合格的染色结果应该是背景颜色浅淡或无着色,而阳性标志物清晰和定位明确。
切片中的正常组织可以作为最简便的对照来判断染色结果的可靠与否,例如用Vimentin抗体,间质成纤维细胞利血管壁平滑肌细胞胞浆应呈阳性。
肯定为阳性的对照组织却呈阴性,待测组织的染色结果也就不可靠;这现象常是由于抗体失效或过度稀释、组织中抗原严重丢失等。
另一种现象是全片呈非特异性染色,实质细胞、间质细胞和细胞外基质无区别地都呈黄色(以HRP酶标法DAB为底物显色而言),抗原无明确定位。
造成这种现象的原因很多,如抗体质量问题、组织固定不佳、洗涤不充分、组织中有能作用于底物的内源性酶(如过氧化物酶)、底物变质或显色时间过长等。
上述两种情况都表明染色失败,不能作为判断的依据。
(2)不仅要判断所检组织中有或无阳性标记物,还要注意阳性信号的分布部位和形态特征。
一般说来,阳性信号应与被测抗原所在的部位一致。
此处所说的部位包括组织和细胞的不同区域。
如免疫复合物的Ig和补体可在肾小球毛细血管壁、系膜区或间质血管壁上;细胞表达的抗原可在胞浆内、核内、胞膜上或细胞外基质。
病理医生应对于拟测抗原分布于何处有所了解。
例如Ki—67、PCNA、雌激素受体、孕激素受体、P53蛋白等定位于胞核;EMA、Ki—1、LCA等为胞膜型抗原,但有时也在胞质中。
大部分细胞抗原位于胞质内,其中亦有区别,有的阳性颗粒弥散于整个细胞的胞质,有的则呈斑块状局限于胞浆某处。
还有些抗原同时分布于胞质和胞膜(如胃肠腺癌细胞的EMA),或核与胞质(如S—100、HMB—45)。
同一种抗原在不同类型的细胞可定位不同,因而分布的特点也有一定的鉴别意义,在此不一一列举。
免疫组化染色结果与预期的不一致时应作具体分析,不要轻易地否定或采用。
病理医生应了解以下几个与判断结果有关的因素。
①细胞内的阳性标志物不一定是该细胞自身表达的抗原,而可能是吞噬或吞饮的抗原物质;如间质中的巨噬细胞可摄入其他细胞释放的抗原物质,因而常呈非特异性的阳性表现;恶性肿瘤细胞侵袭破坏相邻的组织后也可摄入正常细胞的抗原,如恶性纤维组织细胞瘤、恶性黑色素瘤可与邻近的正常上皮呈现相同的上皮细胞抗原;甲状腺内的转移癌细胞可以呈甲状腺球蛋白阳性反应,固而可能被误认为甲状腺原发癌;但肿瘤细胞的吞噬只是近距离的,阳性细胞位于残存的正常组织附近;②肿瘤细胞和其相应的正常细胞在抗原表达的质和量方面都可有所不同;抗原的定位也可偏离一般规律,如正常细胞的膜型抗原在癌细胞却可定位于胞质内。


免疫组化实验结果分析免疫组化实验是一种用特异性抗体与目标蛋白质相互作用的技术,通过对细胞内或组织切片中目标分子的免疫染色来观察、分析目标分子在细胞或组织中的表达与定位情况。
本文将对免疫组化实验结果进行分析,以揭示其在研究领域中的应用与意义。
1. 实验设计与控制免疫组化实验前,首先需要进行实验设计。
在实验设计过程中,应明确需要检测的目标分子以及合适的抗体选择。
同时,合理设定实验组与对照组,用以对比分析不同处理条件下目标分子的表达变化。
控制变量的同时,还需确保实验操作的准确性和可重复性。
2. 结果解读与定量分析在免疫组化实验中,常见的结果表达形式是显微镜下对目标分子免疫染色的图像。
通过观察图像,可以初步判断目标分子在不同组织、细胞种是否存在表达,并探讨其表达差异。
同时,需着重对结果进行定量分析,使用专业软件对图像进行数字化处理,计算光密度或荧光强度等指标,以实现对不同样品之间的比较与分析。
3. 结果分析与比较在进行免疫组化实验结果分析时,需要将不同样品之间的实验结果进行对比与分析,以探究目标分子的表达变化与信号定位。
常见的分析方法包括:(1) 目标分子的表达量分析:通过计算光密度或荧光强度等指标,对不同样品中目标分子的表达量进行定量比较。
可以使用统计学方法对数据进行处理,比如均值、标准差等分析,以评估目标分子的表达水平是否存在显著差异。
(2) 信号定位与定量:通过观察光学显微镜下的染色结果图像,可以初步判断目标分子在细胞或组织中的定位情况。
同时,也可以使用数字化图像分析软件,对染色信号进行定位与定量,以精确描述目标分子在特定位置的表达情况。
(3) 目标分子与疾病发生的关联性:通过对不同疾病样本中目标分子的表达和定位进行研究,可以分析目标分子与疾病的关联性。
比如,某一分子在肿瘤组织中的高表达与某种癌症的发生相关性等。
4. 结果讨论与展望在对免疫组化实验结果进行分析后,可以从结果出发进行讨论与展望,以揭示目标分子的功能与潜在作用。

免疫组化实验结果的判定和分析免疫组化实验结果的判定和分析就实验结果而言,免疫组化技术服务主要涉及抗体实验结果的描述与分析、图片的确定与选取、相关数据的提供,上述工作是免疫组化工作的重点内容。
只有严格的实验设计、标准的实验操作、专业化的结果分析才能满足客户的要求,更好地为客户提供最优质的服务。
免疫组化结果的判定原则:1•必须同时设对照染色。
没有对照染色的免疫组化染色结果是不可信的。
2•抗原表达必须在特定部位。
如LCA应定位在细胞膜上;CK应定位在细胞浆内;PCNA及p53 蛋白应定位在细胞核内;EMA 应定位在细胞膜上等等。
不在抗原所在部位的阳性着色,一概不能视为阳性。
3•阴性结果不能视为抗原不表达。
由于检测方法灵敏度有高低之分,有时可因染色方法灵敏度不够,而导致阴性反应,判断时应注意。
4•尽量避开出血、坏死及切片刀痕和界面边缘细胞的阳性表达,特别是酶免疫标记。
因为这类阳性着色多系内源干扰,或系人为因素所致。
5•对免疫组化标记结果的意义不能绝对化,应结合临床资料、X线等影像学及实验结果综合分析。
对照染色设计:(一)对照染色的目的设对照的目的是为了排除假阴性和假阳性。
假阴性的原因主要有三种:①组织处理不当,抗原丢失过多或被遮蔽;②抗体失活、效价过低或稀释度不合适(主要指一抗,即特异性抗体);③染色步骤遗漏及差错,或显色剂的选择、缓冲液pH 和离子强度不当等。
假阳性均系由多种因素造成的非特异着色所致,原因主要有:①自发荧光或内源酶等干扰;②抗体试剂不纯(特别是一抗);③操作失误,如污染、切片干枯或显色剂操作不当等;④Fc 受体的干扰,等等。
(二)对照的种类及其选用目的对照染色大致可分为四类:即阳性组织对照、阴性组织和阴性试剂对照及自身对照。
•阳性组织对照指用已证实含有靶抗原的同源及不同源组织切片或细胞涂片与待检实验切片同时作同样处理和免疫染色的组织对照。
正确的结果应呈现阳性,目的是为了证实所用免疫组化染色流程的有效性,排除假阴性的可能。
免疫组化实验结果的判定和分析免疫组化实验结果的判定和分析就实验结果而言,免疫组化技术服务主要涉及抗体实验结果的描述与分析、图片的确定与选取、相关数据的提供,上述工作是免疫组化工作的重点内容。
只有严格的实验设计、标准的实验操作、专业化的结果分析才能满足客户的要求,更好地为客户提供最优质的服务。
免疫组化结果的判定原则:⒈必须同时设对照染色。
没有对照染色的免疫组化染色结果是不可信的。
⒉抗原表达必须在特定部位。
如LCA应定位在细胞膜上;CK应定位在细胞浆内;PCNA 及p53蛋白应定位在细胞核内;EMA应定位在细胞膜上等等。
不在抗原所在部位的阳性着色,一概不能视为阳性。
⒊阴性结果不能视为抗原不表达。
由于检测方法灵敏度有高低之分,有时可因染色方法灵敏度不够,而导致阴性反应,判断时应注意。
⒋尽量避开出血、坏死及切片刀痕和界面边缘细胞的阳性表达,特别是酶免疫标记。
因为这类阳性着色多系内源干扰,或系人为因素所致。
⒌对免疫组化标记结果的意义不能绝对化,应结合临床资料、X线等影像学及实验结果综合分析。
对照染色设计:(一)对照染色的目的设对照的目的是为了排除假阴性和假阳性。
假阴性的原因主要有三种:①组织处理不当,抗原丢失过多或被遮蔽;②抗体失活、效价过低或稀释度不合适(主要指一抗,即特异性抗体);③染色步骤遗漏及差错,或显色剂的选择、缓冲液pH和离子强度不当等。
假阳性均系由多种因素造成的非特异着色所致,原因主要有:①自发荧光或内源酶等干扰;②抗体试剂不纯(特别是一抗);③操作失误,如污染、切片干枯或显色剂操作不当等;④Fc受体的干扰,等等。
(二)对照的种类及其选用目的对照染色大致可分为四类:即阳性组织对照、阴性组织和阴性试剂对照及自身对照。
⒈阳性组织对照指用已证实含有靶抗原的同源及不同源组织切片或细胞涂片与待检实验切片同时作同样处理和免疫染色的组织对照。
正确的结果应呈现阳性,目的是为了证实所用免疫组化染色流程的有效性,排除假阴性的可能。