第九章 细胞骨架
- 格式:doc
- 大小:1.11 MB
- 文档页数:40


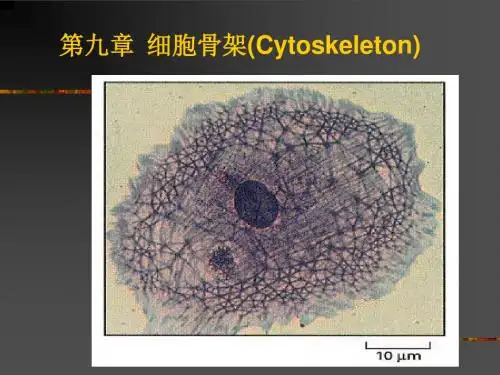


第九章细胞骨架(Cytoskeleton)细胞骨架的概念细胞骨架是指存在于真核细胞中的蛋白纤维网架体系•有狭义和广义两种概念(1)在细胞质基质中包括微丝、微管和中间纤维。
(2 )在细胞核中存在核骨架-核纤层体系。
核骨架、核纤层与中间纤维在结构上相互连接,形成贯穿于细胞核和细胞质的网架体系。
第一节微丝(microfilament, MF)又称肌动蛋白纤维(actin filament),是指真核细胞中由肌动蛋白(actin)组成、直径为6-7nm的骨架纤维。
是由两条线性排列的肌动蛋白链形成的螺旋,形状如双线捻成的绳子。
一、微丝的组成与装配肌动蛋白(actin)是微丝的结构成分,大小为43KDa,外观呈哑铃状,这种actin又叫G-actin,由G-actin形成的微丝又称为F-actin。
(一)肌动蛋白的种类在哺乳动物和鸟类中,已至少发现6种肌动蛋白,其中4种称为-肌动蛋白,分布于横纹肌、心肌、血管平滑肌和肠道平滑肌。
另两种为-actin和-actin ,普遍存在于所有真核细胞中。
(二)肌动蛋白的存在形式与装配1、在缺乏离子时(Na+、K+),肌动蛋白成球形单体存在,球形肌动蛋白单体称为G-肌动蛋白。
2、在含有Mg2+和高浓度的Na+、K+的中性盐溶液中,G-actin装配成纤维状肌动蛋白,纤维状肌动蛋白也称为F-actin。
3、微丝的装配(1 )肌动蛋白单体具有极性,装配时单体呈头尾相接,成为具极性的微丝,既正极与负极之别。
(2)体外实验表明,具有极性的微丝在装配时,新的肌动蛋白单体加到微丝两端的速度不同,速度快的一端为正极,慢的一端为负极;去装配时,负极比正极快。
由于G-actin 在正极端装配,负极去装配,从而表现为踏车行为。
(3)体内装配时,MF呈现出动态不稳定性,主要取决于F-actin结合的ATP水解速度与游离的G-actin单体浓度之间的关系。
在一定条件下,微丝表现为一端因加上肌动蛋白单体而延长,另一端因肌动蛋白单体脱落而缩短,形成一种踏车现象。

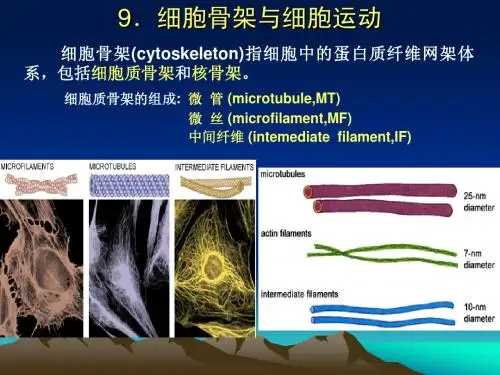
第九章细胞骨架真核细胞中由多种蛋白质纤维组成的复杂网架系统,称为细胞骨架cytoskeleton。
广义的细胞骨架包括细胞核骨架(核内骨架、核纤层及染色体骨架)、细胞质骨架(微丝、微管、中间纤维)、细胞膜骨架及细胞外基质,但通常狭义的仅指细胞质骨架。
目前认为细胞骨架主要功能:①维持细胞整体形态和内部结构有序的空间分布;②与细胞运动、胞内物质运输、能量转换、信息传递、细胞分裂、基因表达及细胞分化等生命活动密切相关。
一、微丝microfilament(一)组分与性质微丝的主要成分是肌动蛋白actin,是在真核细胞中的直径为7nm的骨架纤维,肌动蛋白的单体是球型(G-肌动蛋白),两股由G-肌动蛋白联结成的单链相互螺旋缠绕形成纤维型肌动蛋白(F—肌动蛋白)。
从球型→纤维型的变化是自组装的,除肌肉细胞的细肌丝中的微丝以及肠上皮细胞微绒毛中的微丝是稳定的结构外,通常细胞中的微丝都是处在组装和解聚的动态之中,微丝装配具有极性(即有正负极),并常表现出一端装配而另一端脱落的踏车行为treadmilling ,脱落下来的单体进入细胞质中的肌动蛋白单体库。
关于微丝组装的适宜条件是:ATP、Mg2+和高浓度的Na+、K+离子;而解聚的条件是:Ca2+和低浓度的Na+、K+离子。
微丝的形态是细而长,经常成束平行排列,也有的组成疏散的网络。
在不同类型细胞中,微丝还含有不同种类的微丝结合蛋白,形成各自独特的结构或特定功能。
例如肌细胞中的就有肌球蛋白myosin、原肌球蛋白和肌钙蛋白等。
肌球蛋白约占肌肉中蛋白总量的一半,由双股多肽链盘绕成像“豆芽”状的纤维。
再由多条肌球蛋白成束构成肌原纤维中的粗肌丝,其上外露的“豆芽”头部具ATP酶活性,是粗肌丝与细肌丝(肌动蛋白纤维)能暂时性结合的部位(“横桥”),也是导致细肌丝与粗肌丝之间相对滑动的支点。
而原肌球蛋白和肌钙蛋白则是特异性附着在细肌丝(即F—肌动蛋白纤维)上的两种微丝结合蛋白,它们是以构象变化方式来调节细肌丝与粗肌丝(肌球蛋白头部)的联系。

一、细胞骨架的概念细胞骨架:指存在于真核细胞中的蛋白纤维网架体系。
⑴狭义:细胞骨架发现较晚,主要是因为一般电镜制样采用低温(0-4℃)固定,而细胞骨架会在低温下解聚。
直到20世纪60年代后,采用戊二醛常温固定,才逐渐认识到细胞骨架的客观存在。
微丝、微管和中间纤维位于细胞质中,又称胞质骨架,它们均由单体蛋白以较弱的非共价键结合在一起,构成纤维型多聚体,很容易进行组装和去组装,这正是实现其功能所必需的特点。
一、细胞骨架的概念(2)广义:细胞骨架为真核细胞所特有,其功能主要表现为决定细胞的形状,赋予其强度、支撑作用,并在细胞运动、膜泡运输、细胞分裂、信号转导中起重要作用。
决定细胞的形状,赋予其强度、支撑作用如细胞皮质、微绒毛、应力纤维等。
在细胞分裂中细胞骨架牵引染色体分离,在细胞物质运输中,各类小泡和细胞器可沿着细胞骨架定向转运;在肌肉细胞中,细胞骨架和它的结合蛋白组成动力系统;在白细胞(白血球)的迁移、精子的游动、神经细胞轴突和树突的伸展等方面都与细胞骨架有关。
另外,在植物细胞中细胞骨架指导细胞壁的合成。
大分子物质及颗粒性物质不能穿过细胞膜,是以另外一种特殊方式来进行跨细胞膜转运的,即物质在进出细胞的转运过程中都是由膜包裹、形成囊泡、与膜融合或断裂来完成的,故又称囊泡转运参与细胞分裂●收缩环(c o n t r a c t i l e r i n g):由微丝构成。
●有丝分裂器(纺锤体):由微管是构成。
第一节微丝(microfilament,MF)●微丝(肌动蛋白纤维):指真核细胞中由肌动蛋白(a c t i n)组成的实心纤维细丝。
直径6-7n m,长短不一。
●分布:以束状、网状或散在等多种形式存在于细胞质,特别在有运动功能的细胞中。
一般细胞中含量约占细胞内总蛋白质的1%-2%,但在活动较强的细胞中可占20%-30%。
在一般细胞主要分布于细胞的表面,直接影响细胞的形状。
微丝具有多种功能,在不同细胞的表现不同,在肌细胞组成粗肌丝、细肌丝,可以收缩(收缩蛋白),在非肌细胞中主要起支撑作用、非肌性运动和信息传导作用。
第九章细胞骨架细胞骨架:真核细胞中的蛋白质纤维网架体系。
具有弥散性、整体性、变动性。
广义:细胞核骨架、细胞质骨架、细胞膜骨架和细胞外基质。
狭义:细胞质骨架由微丝、微管、中间丝组成,它们由相应的蛋白亚基组装而成。
功能:结构与支持、胞内运输、收缩与运动、空间组织。
第一节微丝与细胞运动微丝:肌动蛋白丝或纤维状肌动蛋白,直径7nm存在所有真核细胞中。
一、微丝的组成及其组装(一)结构与成分1.微丝的主要结构成分是肌动蛋白。
2.肌动蛋白的2种存在形式:①肌动蛋白单体(球状肌动蛋白,G-actin):单个肽链折叠而成,蝶状,中央一个裂口,裂口内部有ATP结合位点和镁离子结合位点;②纤维状肌动蛋白。
3.肌动蛋白高度保守。
6种:4种为α-肌动蛋白,分别为横纹肌、心肌、血管平滑肌、肠道平滑肌,均组成细胞的收缩性结构;2种为ß-肌动蛋白(位于细胞边缘)和γ-肌动蛋白(与张力纤维有关)。
4.微丝直径7nm的扭链,双股螺旋。
每条丝由肌动蛋白单体头尾相连呈螺旋状排列,螺距36nm。
纤维内部,每个肌动蛋白单体都有4个单体,上下各一个,另外2个位于一侧。
肌动蛋白分子上的裂口使得该蛋白本身在结构上不对称,在整根微丝上每一个单体上的裂口都朝向同一端,使微丝具有极性。
裂口一端为负极,另一端是正极。
(二)组装及动力学特性1.只有结合ATP的肌动蛋白单体才能参与微丝的组装。
解聚:溶液中含有适当浓度的钙离子,钠离子、钾离子浓度很低时,微丝趋向于解聚成G-actin;组装:溶液中含有ATP、镁离子以及较高浓度的钠钾离子时,溶液中的G-actin组装成F-actin,即新的G-actin加到微丝末端,微丝延伸,通常是正极的组装速度较负极快。
溶液中携带ATP的G-actin处于临界浓度时,组装与去组装达到平衡。
2.过程:①成核反应:Arp2和Arp3等蛋白质相互作用,形成起始复合物,至少有2-3个肌动蛋白单体与起始复合物结合,形成一段可供肌动蛋白单体继续组装的寡聚体。
第九章细胞骨架第九章细胞骨架用电子显微镜观察经非离子去垢网架结构通常称为细胞骨架(cytoskeleton)。
细胞骨架包括微丝(microfilament,MF)、微管(microtube,MT)和中间丝(intermediate filament,IF)3种结构组分,他们都是由相应的蛋白亚基组装而成。
第一节微丝与细胞运动微丝又称肌动蛋白丝(actin filament)或纤维状肌动蛋白(fibrous actin,F-actin),这种直径为7nm的细胞骨架存在于所有真核细胞中。
微丝网格的空间结构与功能取决于所结合的微丝结合蛋白(miceofilament-associated proteins)的种类。
细胞内微丝的组装和去组装的动力学过程与细胞突起(微绒毛、伪足)的形成、细胞质分裂、细胞内物质运输、肌肉收缩、吞噬作用、细胞迁移等多种细胞运动过程相关。
一、微丝的组成及其组装(一)结构与成分微丝的主要结构成分是肌动蛋白(actin)。
肌动蛋白在细胞内有两种存在形式,即肌动蛋白单体(又称球状肌动蛋白,G-actin)和由单体组装而成的纤维状肌动蛋白。
肌动蛋白在生物进化过程中是高度保守的。
(二)微丝的组装及动力学特征肌动蛋白单体组装称微丝的过程大体上可以分为几个阶段:第一个阶段是成核反应,即形成至少有2~3个肌动蛋白单体组成的寡聚体,然后开始多聚体的组装。
第二个阶段是纤维的延长。
在体外组装过程中有时可见到微丝的正极由于肌动蛋白亚基的不断添加二延长,而负极则由于肌动蛋白亚基去组装而缩短,这一现象称为踏车行为(treadmilling)。
(三)影响微丝组装的特异性药物一些药物可以影响肌动蛋白的组装和去组装,从而影响细胞内微丝网格的结构。
细胞松弛素(cytochalasin),与微丝结合后可以将微丝切断,并结合在微丝末端阻抑肌动蛋白在该部位的聚合,但对微丝的解聚没有明显的影响。
鬼笔环肽(philloidin),与微丝表面有强亲和力,但不与肌动蛋白单体结合,对微丝的解聚有抑制作用。
§9.1 细胞骨架概述一、细胞骨架的概念细胞骨架是指细胞中由纤维蛋白构成的空间网络结构。
广义的细胞骨架包括:细胞核骨架、细胞质骨架、质膜骨架以及胞外基质。
狭义的细胞骨架包括:细胞质骨架(微管、微丝、中间丝)细胞中同时存在多种类型的细胞骨架并非物质能量的浪费,每种细胞骨架及其组成成分均行使不同的功能,多种组分间分工协作,功能互补,对细胞完成正常的生理功能至关重要。
二、细胞骨架的特点1.细胞骨架由相应的蛋白亚基构成,在组装与解聚间二者达到平衡。
2.细胞骨架具有动态不稳定性,即一定条件下存在组装与去组装现象,在细胞生命活动中起到重要作用。
(1)细胞周期中,细胞骨架经历动态的组装与去组装,周期性的重塑,在分裂期与分裂间期,其分布与组织形式不同。
(2)踏车行为能够改变微管或微丝在细胞中的分布,可能与细胞运动有关。
(3)细胞分裂伴随着纺锤体的形成于分解。
(4)细胞胞质环流伴随着细胞骨架的形成于解聚。
3.细胞骨架是三维的空间网状结构。
三、细胞骨架的功能特点1.细胞骨架构成多种细胞结构。
(1)微管:鞭毛、纤毛、中心体、纺锤体(2)微丝:微绒毛、收缩环、应力纤维、黏合斑、黏合带(3)中间丝:桥粒、半桥粒2.细胞骨架为细胞提供结构支撑,维持细胞形态。
3.细胞骨架介导细胞内物质运输、细胞器运输。
4.细胞骨架介导细胞运动。
5.细胞骨架对细胞分裂起到重要作用。
6.细胞骨架是细胞内结构与功能的空间组织者。
细胞内生物大分子或细胞器的分布具有不对称性,这与细胞骨架的不同组织方式有关,其结构与功能相适应。
四、细胞骨架的研究方法1.荧光显微镜细胞骨架的蛋白亚基可与相应的荧光染料或荧光抗体特异性结合,从而通过荧光显微镜观察其在活细胞中的组织、分布、功能与行为模式。
2.电子显微镜细胞经非离子型去污剂处理后,可溶性物质与膜被抽离,留下不溶的细胞骨架结构,经金属复型后可在电镜下观察细胞骨架的结构。
3.特异性药物处理微管:秋水仙素、长春花碱、紫杉醇微丝:细胞松弛素、鬼笔环肽微管微丝中间丝单体α/β-微管蛋白肌动蛋白杆状蛋白分子量50×10343×10340~200×103结合核苷酸GTP ATP无直径内径 15nm7nm10nm外径 24nm结构13 根原纤维构成的肌动蛋白单体首尾相8 个四聚体或 4 个八空间空心管状结构连构成的双股螺旋聚体构成的螺旋结构极性有有无组织特异性无无有单体库有有无踏车行为有有无结合蛋白动力蛋白肌球蛋白无驱动蛋白特异性药物秋水仙素细胞松弛素未发现长春花碱鬼笔环肽紫杉醇§9.2 微管一、微管的组成与结构1.微管蛋白微管是中空管状的细胞骨架,外径约 24nm,内径约 15nm,由α、β两种球状蛋白形成的异二聚体,即微管蛋白亚基构成,微管蛋白亚基是微管组装的结构单位。
细胞骨架(cytoskeleton)是指真核细胞中的蛋白纤维网络结构。
发现较晚,主要是因为一般电镜制样采用低温(0-4℃)固定,而细胞骨架会在低温下解聚。
直到20世纪60年代后,采用戊二醛常温固定,才逐渐认识到细胞骨架的客观存在。
细胞骨架不仅在维持细胞形态,承受外力、保持细胞内部结构的有序性方面起重要作用,而且还参与许多重要的生命活动(图9-1),如:在细胞分裂中细胞骨架牵引染色体分离,在细胞物质运输中,各类小泡和细胞器可沿着细胞骨架定向转运;在肌肉细胞中,细胞骨架和它的结合蛋白组成动力系统;在白细胞的迁移、精子的游动、神经细胞轴突和树突的伸展等方面都与细胞骨架有关。
另外,在植物细胞中细胞骨架指导细胞壁的合成。
细胞骨架由微丝(microfilament)、微管(microtubule)和中间纤维(intemediate filament)构成。
微丝确定细胞表面特征,使细胞能够运动和收缩。
微管确定膜性细胞器(membrane-enclosed organelle)的位置和作为膜泡运输的导轨。
中间纤维使细胞具有张力和抗剪切力。
微丝、微管和中间纤维位于细胞质中,又称胞质骨架,它们均由单体蛋白以较弱的非共价键结合在一起,构成纤维型多聚体,很容易进行组装和去组装,这正是实现其功能所必需的特点。
广义的细胞骨架还包括核骨架(nucleoskeleton)、核纤层(nuclear lamina)和细胞外基质(extracellular matrix),形成贯穿于细胞核、细胞质、细胞外的一体化网络结构。
图9-1 细胞骨架的主要功能(图片来自G. Karp 2002)第一节微丝微丝(microfilament,MF)是由肌动蛋白(actin)组成的直径约7nm的骨架纤维,又称肌动蛋白纤维actin filament。
微丝和它的结合蛋白(association protion)以及肌球蛋白(myosin)三者构成化学机械系统,利用化学能产生机械运动。
一、分子结构根据等电点的不同可将高等动物细胞内的肌动蛋白分为3类,α分布于各种肌肉细胞中,β和γ分布于肌细胞和非肌细胞中。
肌动蛋白纤维是由两条线性排列的肌动蛋白链形成的螺旋,状如双线捻成的绳子(图9-2、3),肌动蛋白的单体为球形分子,称为球形肌动蛋白G-actin(globular actin),它的多聚体称为纤维形肌动蛋白F-actin (fibrous actin)。
图9-2 微丝纤维的负染电镜照片图9-3 微丝纤维结构模型肌动蛋白在进化上高度保守,酵母和兔子肌肉的肌动蛋白有88%的同源性。
不同类型肌肉细胞的α-肌动蛋白分子一级结构(约400个氨基酸残基)仅相差4~6个氨基酸残基,β-肌动蛋白或γ-肌动蛋白与α-横纹肌肌动蛋白相差约25个氨基酸残基。
多数简单的真核生物,如酵母或粘菌,含单个肌动蛋白基因,仅合成一种肌动蛋白。
真核生物含有多个肌动蛋白基因,如海胆有11个,网柄菌属(Dictyostelium)有17个,在某些植物中有60个。
肌动蛋白要经过翻译后修饰,如N-端乙酰化或组氨酸残基的甲基化。
在适宜的温度,存在ATP、K+、Mg2+离子的条件下,肌动蛋白单体可自组装为纤维。
ATP-actin(结合ATP的肌动蛋白)对微丝纤维末端的亲和力高,ADP-actin对纤维末端的亲和力低,容易脱落。
当溶液中ATP-actin浓度高时,微丝快速生长,在微丝纤维的两端形成ATP-actin“帽子”,这样的微丝有较高的稳定性。
伴随着ATP水解,微丝结合的ATP 就变成了ADP,当ADP-actin暴露出来后,微丝就开始去组装而变短。
图9-4 肌动蛋白的踏车行为微丝具有极性,肌动蛋白单体加到(+)极的速度要比加到(-)极的速度快5-10倍。
溶液中ATP-肌动蛋白的浓度也影响组装的速度。
当处于临界浓度时,ATP-actin可能继续在(+)端添加、而在(-)端开始分离,表现出一种“踏车”现象(图9-4)。
细胞中微丝参与形成的结构除肌原纤维、微绒毛等属于稳定结构外,其他大都处于动态的组装和去组装过程中,并通过这种方式实现其功能。
细胞松弛素(cytochalasin)可切断微丝纤维,并结合在微丝末端抑制肌动蛋白加合到微丝纤维上,特异性的抑制微丝功能。
鬼笔环肽(phalloidin)与微丝能够特异性的结合,使微丝纤维稳定而抑制其功能。
荧光标记的鬼笔环肽可特异性的显示微丝。
二、微丝结合蛋白已经分离出来的微丝结合蛋白有100多种,可分为以下不同类型(图9-5):1.核化蛋白(nucleating protein)核化(nucleation)是纤维组装的第一步,即几个蛋白单体先组装成多聚体,然后其它单体继续添加形成长纤维分子。
Arp(actin-related protein)复合体在体内和体外都可以促进肌动蛋白的核化,其作用就像一个模板,类似于微管组织中心的γ球蛋白复合体,Arp复合体由Arp2、Arp3和5种其它蛋白构成。
Arp与actin在结构上具有同源性。
2.单体隐蔽蛋白(monomer sequestering protein)细胞中约有50%的肌动蛋白为可溶性肌动蛋白,大大高于肌动蛋白组装所需的临界浓度。
但是这些蛋白与其它蛋白结合,构成一个隐蔽的蛋白库。
只有当细胞需要组装纤维的时候这些可溶性肌动蛋白才被释放出来。
如:thymosin与actin结合可阻止其向纤维添加,抑制其水解或交换结合的核苷酸。
3.封端蛋白(end-blocking protein)作用是调节肌动蛋白纤维的长度,结合在(+)或(-)极形成“帽子”,阻止其它单体添加。
如骨骼肌细肌丝的(-)端被tropomodulin封闭,(+)端被CapZ封闭。
4.单体聚合蛋白(monomer polymerizing protein)如profilin结合在actin的ATP结合位点相对的一侧,能与thymosin竞争结合actin,profilin可将结合的单体安装到纤维的(+)极。
5.微丝解聚蛋白(actin-filament depolymerizing protein)如cofilin可结合在纤维的(-)极,使微丝去组装。
这种蛋白在微管快速组装和去组装的结构中具有重要的作用,涉及细胞的移动、内吞和胞质分裂。
6.交联蛋白(cross-linking protein)每一种蛋白含有2至多个微丝结合部位,因此可以将2至多条纤维联系在一起形成纤维束或网络。
分为成束蛋白和成胶蛋白两类,成束蛋白如:丝束蛋白(fimbrin)、绒毛蛋白(villin)和α-辅肌动蛋白(α-actinin),可以将肌动蛋白纤丝交联成平行排列成束的结构。
成胶蛋白,如细丝蛋白(filamin)促使形成肌动蛋白微丝网。
7.纤维切断蛋白(filament severing protein)此类蛋白能结合在微丝中部,将微丝切断。
如溶胶蛋白(gelsolin)。
8.膜结合蛋白(membrane-binding protein)如粘着斑蛋白(vinculin)可将肌动蛋白纤维量接在膜上,参与构成粘合带。
图9-5 各类微管结合蛋白(图片来自G. Karp 2002)三、肌肉的组成肌肉由肌原纤维组成,肌原纤维由粗肌丝和细肌丝组成,粗肌丝的主要成分是肌球蛋白,而细肌丝的主要成分是肌动蛋白、原肌球蛋白和肌钙蛋白。
关于肌小节的构造(图9-6、7)请参阅生理学或组织学书籍。
图9-6 肌纤维TEM照片图9-7 肌小节模式图(一)肌球蛋白(myosin)属于马达蛋白,可利用ATP产生机械能,趋向微丝的(+)极运动(图9-8),最早发现于肌肉组织(myosin II),1970s后逐渐发现许多非肌细胞的myosin,目前已知的有15种类型(myosin I-XV)。
Myosin II是构成肌纤维的主要成分之一。
由两个重链和4个轻链组成,重链形成一个双股α螺旋,一半呈杆状,另一半与轻链一起折叠成两个球形区域,位于分子一端,球形的头部具有ATP酶活性(图9-9)。
Myosin V结构类是于myosin II,但重链有球形尾部。
Myosin I 由一个重链和两个轻链组成。
Myosin I、II、V都存在于非肌细胞中,II型参与形成应力纤维和胞质收缩环,I、V型结合在膜上与膜泡运输有关,神经细胞富含myosin V 。
图9-8 myosin II 的功能图9-9 myosin II结构模型(二)原肌球蛋白原肌球蛋白(tropomyosin.Tm)分子量64KD,是由两条平行的多肽链扭成螺旋,每个Tm的长度相当于7个肌动蛋白,呈长杆状。
原肌球蛋白与肌动蛋白结合,位于肌动蛋白双螺旋的沟中,主要作用是加强和稳定肌动蛋白丝,抑制肌动蛋白与肌球蛋白结合(图9-10)。
图9-10细肌丝的组成(三)肌钙蛋白肌钙蛋白(troponin,Tn),分子量80KD,含三个亚基,肌钙蛋白C特异地与钙结合,肌钙蛋白T与原肌球蛋白有高度亲和力,肌钙蛋白I抑制肌球蛋白的ATP酶活性,细肌丝中每隔40nm就有一个肌钙蛋白复合体(图9-8)。
(四)肌肉的收缩肌细胞上的动作电位引起肌质网Ca2+电位门通道开启,肌浆中Ca2+浓度升高,肌钙蛋白与Ca2+结合,引发原肌球蛋白构象改变,暴露出肌动蛋白与肌球蛋白的结合位点(图9-8)。
肌动蛋白通过结合与水解ATP、不断发生周期性的构象改变、引起粗肌丝和细肌丝的相对滑动。
肌动蛋白的工作原理可概括如下:①肌球蛋白结合ATP,引起头部与肌动蛋白纤维分离;②ATP水解,引起头部与肌动蛋白弱结合;③Pi释放,头部与肌动蛋白强结合,头部向M线方向弯曲(微丝的负极),引起细肌丝向M线移动;④ADP释放ATP结合上去,头部与肌动蛋白纤维分离。
如此循环(图9-11)。
图9-11 肌肉收缩图解四、微丝的功能微丝除参与形成肌原纤维外还具有以下功能:1.形成应力纤维(stress fiber):非肌细胞中的应力纤维与肌原纤维有很多类似之处:都包含myosin II、原肌球蛋白、filamin和α-actinin。
培养的成纤维细胞中具有丰富的应力纤维,并通过粘着斑固定在基质上。
在体内应力纤维使细胞具有抗剪切力(图9-12、13)。
图9-12培养的上皮细胞中的应力纤维(微丝红色、微管绿色)(图片来自/)图9-13 应力纤维结构模型(图片来自G. Karp 2002)2.形成微绒毛:参见第四章。
3.细胞的变形运动:分为四步:①:微丝纤维生长,使细胞表面突出,形成片足(lamellipodium);②在片足与基质接触的位置形成粘着斑;③在myosin的作用下微丝纤维滑动,使细胞主体前移;④解除细胞后方的粘和点。
如此不断循环,细胞向前移动(图9-14)。
阿米巴原虫、白细胞、成纤维细胞都能以这种方式运动。