实验室常用缓冲液 常用引物序列汇总
- 格式:doc
- 大小:75.97 KB
- 文档页数:18

分子生物学实验常用试剂缓冲液的配制方法1.常见试剂配制方法:(1)磷酸盐缓冲液(PBS)的配制方法:-配制PBS需要使用NaCl、KCl、Na2HPO4和KH2PO4等化学品。
-以10倍浓度配制PBS的浓缩溶液,然后稀释为需要的浓度。
-例如,1倍浓度的PBS可以通过将1升的10倍浓度PBS溶液加入9升蒸馏水来制备。
(2) 神经元无血清培养基(Neurobasal Medium)的配制方法:- 配制Neurobasal Medium需要使用神经元培养基基本成分及其他补充物质。
-根据制造商提供的配方,按照相应比例将各种化学品溶解在无菌蒸馏水中。
-配制好的培养基可以用于维持和培养神经元体外培养。
(3) 洗涤缓冲液(Washing Buffer)的配制方法:-配制洗涤缓冲液需要使用磷酸盐缓冲液(PBS)及其他添加剂。
- 将PBS溶液中加入适当浓度的Tween-20或者Tris-HCl来制备洗涤缓冲液。
-根据实验需求,可以调整洗涤缓冲液的成分和浓度。
(4) 乙醇(Ethanol)溶液的配制方法:-配制乙醇溶液常用的浓度有70%和100%。
- 70%的乙醇溶液可以通过将70ml无菌蒸馏水加入30ml无水乙醇中配制得到。
-100%的乙醇溶液可以直接使用无水乙醇。
2.常见缓冲液配制方法:(1) Tris/Tricine缓冲液的配制方法:- 配制Tris/Tricine缓冲液需要使用Tris(三羟甲基氨基甲烷)和Tricine(三甘胺酸)等化学品。
- 根据实验要求,在一定PH范围内,按照不同比例混合Tris和Tricine,溶解于适量的蒸馏水中。
(2) 氯化钾缓冲液(KCl Buffer)的配制方法:- 配制KCl Buffer需要使用KCl和其他添加剂。
-将适量的KCl和其他缓冲液成分溶解在蒸馏水中。
-根据实验要求,调整KCl的浓度和缓冲液的PH值。
(3) Tris/Acetate缓冲液的配制方法:- 配制Tris/Acetate缓冲液需要使用Tris和乙酸等化学品。

常⽤载体测序引物列表常⽤载体测序引物列表载体名称正向引物反向引物pACT T7 T3pACT2 GAL4 AD(5’AD) 3'AD/pACT2-R PACYCDUET-1(MCSII) DuetUP2 T7TERpAD/pl-DEST CMV-FpAD-Track pAD-Track-F ⽆pAS2-1 5’BD M13-26/48 PB42AD PB42ADF PB42ADR PBAD PBAD-F PBAD-R pBABE pBABE5’ pBABE3’ PBACPAK8 BAC1BAC2 pBK-CMV T7/M13-20 T3/M13-26 PBS(SK/KS)/M13- M13F/T7T3/M13R pBV220 PBV220F PBV220R pBI121需根据酶切位点确认需根据酶切位点确认 pCAMBIA 1301(1300)需根据酶切位点确认需根据酶切位点确认 pCAMBIA 2300 需根据酶切位点确认需根据酶切位点确认PCANTB5E S1/M13R S6pCAT3-enhancer pGL3+pcDNA3.0 pEGFP-N5/T7 SP6/BGHpcDNA3.1 pEGFP-N5/T7 BGHpcDNA4 T7/pEGFP-N5 BGHpcDNA6 T7/pEGFP-N5 BGHpcDNAII T7SP6 pCE2.1 M13FM13R pCEP4 pCMV5R/PCEP-F pEGFP-N5/EBV-R pCF-T M13FM13R pCIT7(17Base ) pCMV5R pCI-neo T7(17Base ) T3pCMS-EGFP T7T3 pCMV-3Tag-4A T3 /pFlag-CMV-F T7pCMV5 pCMV5F pCMV5R pCMV5-Flag pCMV5FpCMV5R pCMV-MYC/NUC pCMV5FpCMV5R PCMV-HA pCMV5FpCMV5R pCMV-SportSP6/M13RpCMV-Tag T3T7 pCMV-TNT T7/SP6pCMV5R pCR2.1-TOPO M13F/T7M13R pCR3.1 T7BGH pCS2 SP6T7PDNR-LIB M13F M13RpDonar M13F M13R pDONR201 pDONR-F pDONR-R pDONR221 M13F M13RpDrive T7 SP6 pDRIveR T7 SP6pDsRED1-C1 pDsRED-C1-F pECFP-C-3 pDsRed1-N1 pEGFP-N-5 RFP-NrevpDsRed-Monomer-N1 pEGFP-N-5 pDsRed1-NpDsRED2-C1 pDsRED-ex-C1-F pEGFP-N-3’pEGFP-N-5 pDsRed1-N pDSRED2-N1pDSRED-N1 pEGFP-N-5’ PDSRED-N-R pEASY-BLUNT M13F/T7 M13RTerpEASY-E1 T7 T7pEASY-T1 M13F/T7 M13RpEASY-T3 M13F/T7 M13R/SP6 pECFP-C pEGFP-C-5’ pECFP-C-3' pECFP-N1 pEGFP-N-5’ pEGFP-N-3’pEF/myc/ER pEF-F pCDNA3.1R pEGFP-C pEGFP-C-5’ pEGFP-C-3' pEGFP-N pEGFP-N-5’ pEGFP-N-3’ pENTR/D-TOPO M13F M13RTerpET-*(His) T7 T7pET22(a,b,c) T7 T7TerTerpET28,30,24,49 T7 T7TerpET32(a,b,c) T7/S.tag T7pET-42a (-b, -c)(+) Stag T7 TerpET50 T7/s.tag T7TERpET44 T7/s.tag T7Ter pEYFP-N1 pEGFP-N-5’ pEGFP-N-3’ PETBlue M13-20 PETBlueDOWN PETDUET-1(MCSI) PBRrevBam DuetDOMN1 PETDUET-1(MCSII) DuetUP2 T7TERpEYFP-C1 pEGFP-C-5’ pEGFP-C-3' pEYFP-N1 pEGFP-N-5’ pEGFP-N-3’ pFastBac pFastBac-F pFastBac-R pFastBac HT_A,B,C pFastBac-PH pECFP-C-3 pFastBac1 pFastBac-PH pECFP-C-3 pFastBac Dual (MCSI) pFastBac-PH pECFP-C-3 pFLAG-CMV CMV30/pFLAG-CMV-F CMV-24/pFLAG-CMV-Rp3xFlag-CMV-7.1 CMV-F/CMV24 CMV30pGAD424 5’AD 3'ADpGADGH 5’AD 3'ADpGADT7-Rec 5’AD/T7 3'ADpGAPZa-A/B/C a-FACTOR 3'AOXforward 3'AOXpGAPZ-A/B/C pGAPpGBKT7 T7 3'BDpGEM-T(-Easy) M13F/T7 SP6/M13RpGEX-(*)T pGEX-5’ pGEX-3’pGL2 pCMV5R PGL3-Pgl3-BASIC pGL3+ PGL3-pGL3-Enhancer pGL3+ PGL3-PinPoint TM PinPoint Primer SP6pIRES PIRES-F/T7 T3/PIRES-RpIRES2-EGFP pIRES2-EGFP.P5’ pIRES2-EGFP.P3’ pLenti6/v5-Dest pEGFP-N-5’PLEXA PLEXA-F PLEXA-R PLNCX PLNCX-F PLNCX-R pLXSN pLXSN-F pLXSN-RPjc1-tac T7pJet.1.21.Blunt T7primer M13F(-47) pMAL-c2E MalEP3/PMAL-C2X-R pMAL-C2x P5/PMAL-C2X-Fprimer M13F(-47) pMAL-p2X MalEPMD18-T M13R(-48) M13F(-47) PMD19-T M13F(-47) M13R(-48) pMIR-report M13FPPC86 PPC86-F PPC86-R3’AOXpPIC9K 5’AOX/a-factor3'AOX pPICZa 5'AOX/PPICZa-FpPROEXHTA M13R(-48)pQE30or40 pQE30+ pQE30- pRECEIVER CMV-FpRSET T7 T7TER PRSFDUET-1(MCSI) DuetUP1 DuetDOWN1 PRSFDUET-1(MCSII) DuetUP2 T7TER pShuttle-CMV pShuttle-CMV-F pShuttle-CMV-R PSILENCE-1.0-U6 T7 T3pSilencer3.1-H1 hygro M13F(-47) 3.0revpSILENCEV2.0-U6 T7 2.0revpSK01-T M13F M13RpSK-CMV T7 T3Psos H1PSP64/65 SP6pSP72 T7 SP6T7/M13RpSport1 SP6/M13F(-47)pSTBlue-1 T7 SP6pSUPER T7 T3pT7Blue(R) T7 M13F(-47)pTA2 M13F/T7 T3/M13R/T7 M13RpT-Adv M13FpTARGET TM pTarget-F/T7 arget-RPTHIOHISA,B,C TRX-FORWARD TRX-REVERSE pTO-T7 T7 T7TERPBV220-/PTRC99C-R pTRC99a-c PQE30+/PTRC99C-F pTriPLEx2 PT5/5'TriplEx2 T7pTz57r/t M13+ M13-pTWIN-1 T7 T7TERpUC18(19)/118(119) M13F(-47) M13R(-48)M13F(-47)/M13F pUC57 M13R(-48)/M13RpUCm-T M13F/T7 M13RpVAX1 T7 BGHT3/M13R/M13R(-48) pWSK29 T7/M13F/M13F(-47)pXT7 T7 SP6pYES2 T7 pYes2.R。

常用缓冲液配方及缓冲范围缓冲液是一种水溶液,其中含有在酸性或碱性条件下能够保持pH稳定的化学物质。
缓冲液广泛应用于生物化学、分子生物学、生物技术和医学等领域的实验和研究中。
下面是一些常用的缓冲液配方及其应用范围。
1. Tris缓冲液Tris缓冲液是一种中性缓冲液,常用于生物化学和分子生物学实验。
它的配方通常为:- 10 mM Tris base-1mMEDTA-向溶剂中调整pH至7.4Tris缓冲液可用于DNA和RNA的电泳、酶反应、细胞培养等实验中。
2.PBS缓冲液PBS(磷酸盐缓冲液)是一种常用的生物学缓冲液,具有缓冲能力强和与生物体液成分相似的特点。
它的配方通常为:-137mMNaCl-2.7mMKCl-10mMNa2HPO4-2mMKH2PO4-向溶剂中调整pH至7.4PBS缓冲液可用于细胞培养、免疫荧光染色、蛋白质凝胶电泳等实验中。
3.TAE缓冲液TAE(三乙酸缓冲液)是一种常用的核酸电泳缓冲液,其配方为:- 40 mM Tris base-20mM醋酸-1mMEDTA-向溶剂中调整pH至8.0TAE缓冲液可用于DNA和RNA的琼脂糖凝胶电泳,如聚丙烯酰胺凝胶电泳()和琼脂糖凝胶电泳(agarose gel electrophoresis)。
4. Tris-HCl缓冲液Tris-HCl缓冲液是一种常用的酸性或碱性缓冲液。
它的配方基于Tris缓冲液,在Tris缓冲液基础上调整pH的方法是在配方中加入稀盐酸或稀氢氧化钠。
例如,对于Tris-HCl缓冲液的配方为:- 50 mM Tris base-向溶剂中加入HCl调整pH至所需的值(通常为7.2至9.0)Tris-HCl缓冲液可用于酶反应、蛋白质组学研究、PCR等实验中。
这只是一些常用的缓冲液配方,根据不同实验需求和物质稀释要求,还有其他许多缓冲液的配方。
对于缓冲液的选择,关键在于根据实验要求选取适当的缓冲体系,并对缓冲液中所需的化学物质浓度、pH值等进行精确调整。

常用引物序列引言引物序列是指在分子生物学实验中用来特异性引导DNA或RNA复制和扩增的短链核酸序列。
常用的引物序列在科研和实验室工作中起着重要作用。
本文将介绍几种常用引物序列及其在实验中的应用。
1. 通用引物序列通用引物序列是指适用于多种物种的引物序列。
常见的通用引物序列包括16S rRNA引物序列用于细菌和古细菌的分析,18S rRNA引物序列用于真核生物的分析,以及ITS引物序列用于真菌的分析。
这些通用引物序列具有高度保守性,可以用于不同物种的物种鉴定和进化分析。
2. 物种特异引物序列物种特异引物序列是指只在特定物种中存在的引物序列。
这些引物序列通常用于物种鉴定和种群遗传分析。
例如,人类特异引物序列可以用于人类DNA的特异扩增,从而进行人类个体的鉴定。
物种特异引物序列的选择和设计需要根据目标物种的基因组序列进行。
3. 定量引物序列定量引物序列是指用于定量PCR实验的引物序列。
这些引物序列通常与目标基因的外显子区域相结合,可以通过PCR扩增目标基因的特定片段,并通过实时荧光定量PCR技术进行定量分析。
定量引物序列的设计需要考虑引物的特异性和扩增效率,以确保准确的定量结果。
4. 荧光标记引物序列荧光标记引物序列是指在引物序列上加入荧光标记分子,用于检测和定量特定基因的表达水平。
常用的荧光标记引物序列包括荧光探针和荧光引物。
荧光标记引物序列可以通过荧光定量PCR或原位杂交等技术进行检测。
5. 反向引物序列反向引物序列是指用于反转录PCR实验的引物序列。
反转录PCR是一种将RNA转录成cDNA的技术,常用于研究基因的表达调控和mRNA的定量分析。
反向引物序列通常与反向转录酶结合,将RNA逆转录成cDNA,并通过PCR扩增特定基因的cDNA片段。
6. 基因特异引物序列基因特异引物序列是指用于特定基因扩增的引物序列。
这些引物序列通常与目标基因的外显子区域相结合,可以选择性地扩增目标基因,从而进行基因型鉴定和基因表达分析。

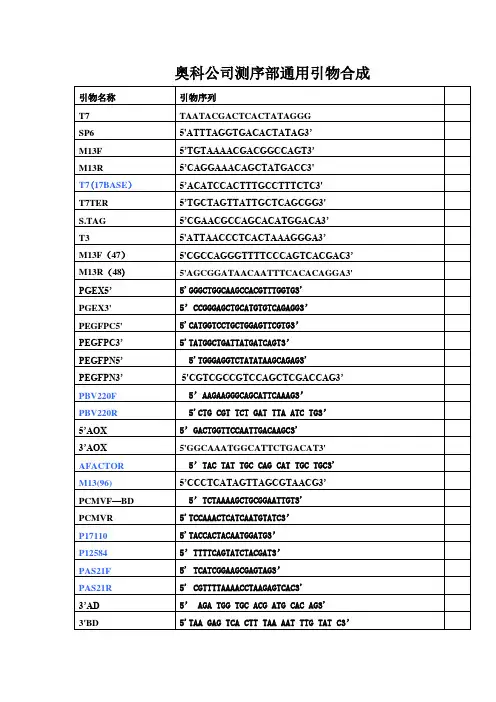
表1 引物序列信息
引物序列信息是指在分子生物学领域中,用于PCR扩增等实验中所使用的引物的序列信息。
PCR技术是一种基于DNA聚合酶的体外DNA 扩增技术,它可以在短时间内扩增出大量的DNA片段,具有高效、快速、灵敏、特异性等优点。
而引物作为PCR扩增的关键因素之一,其序列信息的选择和设计对PCR扩增的成功与否有着至关重要的影响。
表1中列出了一组引物序列信息,包括引物名称、引物序列、引物长度、引物Tm值等。
其中,引物名称是指引物的命名,通常以字母和
数字的组合形式命名;引物序列是指引物的核苷酸序列,通常由5'端
向3'端书写;引物长度是指引物的碱基数目,通常在18-25个碱基之间;引物Tm值是指引物的熔解温度,即引物与模板DNA结合的温度,通常在50-65℃之间。
在PCR实验中,引物序列的选择和设计需要考虑多个因素,如目标DNA序列的长度、GC含量、特异性、避免引物间的二聚体和自聚物等。
同时,引物序列的合成也需要考虑到纯度、长度、杂质等因素,
以保证PCR扩增的成功和准确性。
总之,引物序列信息是PCR实验中不可或缺的重要因素之一,其选择和设计需要综合考虑多个因素,以保证PCR扩增的成功和准确性。

分子生物学实验常用试剂缓冲液的配制方法1.离心管清洗液配制方法:将500mL蒸馏水加入500mL乙醇中配制而成。
2.TE缓冲液配制方法:将1 M Tris-HCl (pH 8.0) 溶液和0.5 M EDTA (pH 8.0) 溶液以1:200的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
3.LB培养基配制方法:将10g/L氯化钠、5g/L酵母浸粉、10g/L蛋白胨加入1L蒸馏水中,调整pH至7.0-7.5、将溶液加热,搅拌溶解,然后使用纸滤器滤过,装入含有取10g搅拌均匀的琼脂糖的培养皿中。
灭菌后冷却到45°C左右,然后再倒入培养皿中。
4. 蒸馏水(Milli-Q水)配制方法:使用商用蒸馏水设备如 Milli-Q等,生成去离子水,再通过0.22 μm的滤器进行过滤,获得蒸馏水。
5. LB/Agar培养基配制方法:将10g/L氯化钠、5g/L酵母浸粉、10g/L蛋白胨、15g/L 琼脂加入1L蒸馏水中,调整pH至7.0-7.5、将溶液加热,搅拌溶解,然后使用纸滤器滤过。
将过滤后的溶液倒入培养皿中,灭菌后冷却到45°C 左右。
1.TBE缓冲液配制方法:将1 M Tris-Borate 溶液、0.1 M EDTA 溶液、10% (w/v) Boric acid 溶液按5:19:75的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
2.TAE缓冲液配制方法:将40 mM Tris、20 mM 醋酸和1 mM EDTA 按1:0.5:0.1的比例混合,加入蒸馏水配制而成。
最终pH值约为8.0。
3. Tris-HCl缓冲液配制方法:将1 M Tris-HCl 溶液加入蒸馏水,调整pH值至所需范围。
4.PBS缓冲液配制方法:将0.2g/LKH2PO4、0.2g/LNa2HPO4、8.5g/LNaCl和0.2g/LKCl加入1L蒸馏水中,调整pH值至7.45. Tris-EDTA缓冲液(TE缓冲液)配制方法:将1 M Tris-HCl (pH 8.0) 溶液和0.5 M EDTA (pH 8.0) 溶液以1:200的比例混合,加入蒸馏水配制而成。

表4 主要使用的引物及序列序列技术在现代生物学研究中发挥着越来越重要的作用。
在进行序列分析之前,需要先选择合适的引物,以确保检测到所需的目标序列,并避免检测到不必要的杂交或引物间的相互杂交。
本文将介绍主要使用的引物及其序列。
1. 基因测序引物基因测序引物是用于测序DNA或RNA的引物。
这些引物通常包括一个DNA或RNA序列和一个与之匹配的引物序列。
常用的基因测序引物包括以下几种:- M13引物M13引物是一种通用的测序引物,用于测序单链DNA。
其序列为:5'-GTAAAACGACGGCCAGT-3'。
- T7和SP6引物T7和SP6引物用于测序DNA文库中的克隆DNA。
其中T7引物的序列为:5'-TAATACGACTCACTATAGGG-3',SP6引物的序列为:5'-ATTTAGGTGACACTATAG-3'。
- M13F和M13R引物M13F和M13R引物也用于测序单链DNA。
M13F引物的序列为:5'-GTAAAACGACGGCCAGT-3',M13R引物的序列为:5'-CAGGAAACAGCTATGAC-3'。
- T3和T7引物T3和T7引物与RNA兼容,并用于测序RNA和RNA-DNA杂交分子。
T3引物的序列为:5'-AATTAACCCTCACTAAAGGGA-3',T7引物的序列为:5'-TAATACGACTCACTATAG-3'。
2. PCR引物PCR引物是用于荧光定量PCR、数字PCR、标准PCR等技术的引物。
以下是几种常用的PCR引物:- GAPDH引物GAPDH引物用于检测人体组织中的GAPDH基因表达水平。
其序列为:5'-GAAGGTGAAGGTCGGAGT-3'(前引物)、5'-GAAGATGGTGATGGGATTTC-3'(后引物)。

实验常用试剂、缓冲液的配制方法1、1M Tris-HCl□组份浓度1 M Tris-HCl(pH7.4,7.6,8.0)□配制量1L□配置方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH 值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5 M Tris-HCl□组份浓度1.5 M Tris-HCl(pH8.8)□配制量1L□配置方法1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer□组份浓度100 mM Tris-HCl,10 mM EDTA (pH 7.4,7.6,8.0)□配制量1L□配置方法1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M 醋酸钠□组份浓度3 M 醋酸钠(pH5.2)□配制量100mL□配置方法1. 称取40.8gNaOAc•3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2. 加入冰乙酸调节pH值至5.2。
3. 加入去离子水将溶液定容至100mL。

测序通用引物序列常见载体的测序引物:Primer of Vector:Vector:Primer(F);Primer(R)pACT T7 T3pACT2 GAL4 AD pACT2-RpAS2-1 GAL4 BD pAS2-1.RpB42AD pB42ADF pB42ADRpBACPAK8 BAC1 BAC2pBK-CMV T7 T3PBS(SK/KS)/M13- M13F/T7 T3/M13RpBV220 PBV220F PBV220RpCAMBIA 1301(1300) P1 P2pCAMBIA 2300 M13R(-48) M13F(-47)PCANTB5E S1/M13R S6pCAT3-enhancer RVP3 此载体无反向引物pcDNA3.0 CMV-F/T7 SP6/BGHpcDNA3.1 T7 BGHpcDNA4 T7/CMV-F BGHpcDNA6 T7/CMV-F(J21025在T7前面)BGHpcDNAII T7 SP6pCE2.1 M13F M13RpCEP4 pCEP-F EBV-RpCF-T M13F M13RpCI T7(17Base)此载体无反向引物pCI-neo T7(17Base)T3pCMS-EGFP T7 T3pCMV-3Tag-4A T3 /PFLAG-CMV-F T7pCMV5 pCMV5F pCMV5RpCMV5-Flag pCMV5F pCMV5RpCMV-MYC/HA pCMV-F pCMV-RpCMV-Sport M13F/T7 SP6/M13RpCMV-Tag(KAN+) T3 T7pCR2.1-TOPO M13F/T7 M13RpCR3.1 T7 BGHpCS2 SP6 T7pDonar M13F M13RpDONR221 M13F M13RpDrive T7 SP6pDRIveR(KAN+) T7 SP6pDsRED1-C1 pDsRED-ex-C1-F pEGFP-N-3’(距离很近,一般不用) pDsRED2-C1(KAN+) pDsRED-ex-C1-F pEGFP-N-3’pDSRED-N1(KAN+) pEGFP-N-5’ PDSRED-N-RpECFP-C pEGFP-C-5’ pECFP-C-3′pECFP-N1 pEGFP-N-5’ pEGFP-N-3’pEF/myc/ER pEF-F pCDNA3.1RpEGFP-C(KAN+) pEGFP-C-5’ pEGFP-C-3′pEGFP-N(KAN+) pEGFP-N-5’ pEGFP-N-3’pENTR/D-TOPO(KAN+) M13F M13RpET-*(His)(KAN+) T7 T7 TerpET22(a,b,c)(AMP+) T7 T7 TerpET28,30,24,49(KAN+) T7 T7 TerpET32(a,b,c)(AMP+) T7/S.tag T7 TerpET50(amp+) T7/s.tag T7TERpET44(AMP+) T7/s.tag T7 TerpEYFP-N1 pEGFP-N-5’ pEGFP-N-3’pEYFP-C1 pEGFP-C-5’ pEGFP-C-3′pFLAG-CMV pFLAG-CMV -F pFLAG-CMV -R pGAD424 GAL4 AD 3′ADpGADGH GAL4 AD 3′ADpGADT7-Rec GAL4 AD/T7 3′ADpGAPZa-A a-FACTOR 3′AOXpGBKT7(Kana+) T7 3′BDpGEM-T(-Easy) M13F/T7 SP6/M13RpGEX-(*)T pGEX-4T-5’ pGEX-4T-3’pGL2 GLP1 GLP2pGL3 RVP3 GLP2(RVP4)(没有特别说明用GLP2) PinpointTM Vector Pinpoint Primer SP6pIRES PIRES-F/T7 T3/PIRES-R (J40720)pIRES2-EGFP pIRES2-EGFP.P5’ pIRES2-EGFP.P3’pLXSN pLXSN-F pLXSN-RpMAL-c2E MalE primer M13F(-47)pMAL-C2x P5’ P3’pMAL-p2X MalE primer M13F(-47)PMD18-T M13R(-48) M13F(-47)PMD19-T M13F(-47) M13R(-48)pPIC9K(AMP+、ZEO+)5’AOX/a-factor 3’AOX pPICZa 5′AOX/PPICZa-F 3′AOXpPROEXHTA M13R(-48) 无反向引物pQE30or40 pQE30-F pQE-R:pRSET T7 T7TERpSilencer3.1-H1 hygro M13F(-47) 3.0REV pSILENCEV2.0-U6 T7 2.0REVpSK01-T M13F M13RpSK-CMV(KAN+) T7 T3pSP72 T7 SP6pSport1 SP6/M13F(-47) T7/M13RpSUPER T7 T3pTA2 M13F/T7(优先使用M13F)T3/M13RpT-Adv M13F /T7 M13RpTARGET TM pTarget.F(在T7前面)/T7 pTarget.R pTO-T7 T7 T7TERpTRC99a-c pTRC99C-F pTRC99C-RpTriPLEx2 5′pTriPLEx2 T7pTWIN-1 T7 T7TER(客户确认再用)pUC18(19)/118(119) M13F(-47) M13R(-48)pUCm-T M13F/T7 M13RpVAX1 T7 BGHpWSK29 T7/M13F/M13F(-47) T3/M13R/M13R(-48)pXT7 T7 SP6pYES2 T7 pYes2.RpLEXA pLEXA-F pLEXA-RpLNCX pLNCX-F pLNCX-RpRECEIVER CMV-F 此载体无反向引物pSHUTTLE-CMV PSHUTTLE-CMV-F PSHUTTLE-CMV-R pSP64/65 SP6 此载体无反向引物pSTBlue-1 T7 SP6pT7Blue(R) T7 M13F(-47)引物名称序列(5′-3′):M13R:CAG GAA ACA GCT ATG ACCM13F:TGT AAA ACG ACG GCC AGTM13F(-47):CGC CAG GGT TTT CCC AGT CAC GACM13R(-48):AGC GGA TAA CAA TTT CAC ACA GGA M13(-96):CCC TCA TAG TTA GCG TAA CGSP6:ATT TAG GTG ACA CTA TAGT7:TAA TAC GAC TCA CTA TAG GGT7 terminator:TGC TAG TTA TTG CTC AGC GGT3:ATT AAC CCT CAC TAA AGG GApGEX-4T-5′:GGG CTG GCA AGC CAC GTT TGG TG pGEX-4T-3′:CCG GGA GCT GCA TGT GTC AGA GG GLp1:TGT ATC TTA TGG TAC TGT AAC TGGLp2:CTT TAT GTT TTT GGC GTC TTC CARVp3:CTA GCA AAA TAG GCT GTC CCRVp4:GAC GAT AGT CAT GCC CCG CGpcDNA3.1R:TAG AAG GCA CAG TCG AGGPinPoint primer:CGT GAC GCG GTG CAG GGC G pCMV-F:TCT AAA AGC TGC GGA ATT GTpCMV-R:TCCAAACTCATCAATGTATCpTRC99C-F: TTG CGC CGA CAT CAT AACpTRC99C-R: CTGCGTTCTGATTTAATCTGpCEP-F: AGA GCT CGT TTA GTG AAC CGEBV-R : GTG GTT TGT CCA AAC TCA TCpIRES2-EGFP.P5’: GTA GGC GTG TAC GGT GGG AG pIRES2-EGFP.P3’: AAC GCA CAC CGG CCT TAT TC3′AD: AGA TGG TGC ACG ATG CAC AGCMV -F:CGC AAA TGG GCG GTA GGC GTGS1:CAA CGT GAA AAA ATT ATT ATT CGCS6:GTA AAT GAA TTT TCT GTA GTA GG5`AOX1:GAC TGG TTC CAA TTG ACA AGC3`AOX1:GCA AAT GGC ATT CTG ACA TCCα-Factor:TAC TAT TGC CAG CAT TGC TGCGAL4 AD:TAC CAC TAC AAT GGA TGpACT2-R:GTGCACGATGCACAGTTGAApB42ADF:CCA GCC TCT TGC TGA GTG GAG ATGpB42ADR:AAG CCG ACA ACC TTG ATT GGA GpEGFP-N-5’:TGG GAG GTC TAT ATA AGC AGA G pEGFP-N-3’:CGT CGC CGT CCA GCT CGA CCA G pEGFP-C-5’:CAT GGT CCT GCT GGA GTT CGT G pEGFP-C-3′ :TAT GGC TGA TTA TGA TCA GTPBV220F:AAG AAG GGC AGC ATT CAA AGPBV220R:CTG CGT TCT GAT TTA ATC TGU6:ATG GAC TAT CAT ATG CTT ACC GTA2.0rev primer:AGG CGA TTA AGT TGG GTA3.0rev:GAG TTA GCT CAC TCA TTA GGCS.tag:GAA CGC CAG CAC ATG GAC5′TriplEx2:CTC CGA GAT CTG GAC GAG CRVP4:GAC GAT AGT CAT GCC CCG CGRVP3:CTA GCA AAA TAG GCT GTC CCpQE30-R:GTT CTG AGG TCA TTA CTG GpQE30-F:TGA GCG GAT AAC AAT TTC ACpEF-F:TCA AGC CTC AGA CAG TGG TTCpDSRED-N1-R:TGA AGC GCA TGA ACT CCT TG pDsRED-express-C1-F:TCC CAC AAC GAG GAC TAC AC pCMV5R:ATT ATA GAG GAC ACC TAG TCpCMV5F:TTC CAA AAT GTC GTA ATA ACP5′:TGC GTA CTG CGG TGA TCA ACP3′:CTG CAA GGC GAT TAA GTT GGBAC2:ACG CAC AGA ATC TAG CGC TTBAC1:AAC CAT CTC GCA AAT AAA TA3′BD:TAA GAG TCA CTT TAA AAT TTG TAT AC pTarget.F:CCA GGA TTT TCC CAG TCA CpTarget.R:GGC TTT ACA CTT TAT GCT TCT7(17base):ACA TCC ACT TTG CCT TTC TCpYes2.R:TCG GTT AGA GCG GAT GTGGAL4 BD:TCA TCG GAA GAG AGT AGpAS2-1.R:AAG AGT TAC TCA AGA ACA AGA ApFlag-CMV-F: GGT AGG CGT GTA CGG TGGpFlag-CMV-R: GCA CTG GAG TGG CAA CTTpIRES-F: CTT ACT GAC ATC CAC TTT GCpIRES.R: CAC TGC ATT CTA GTT GTG GTP1:CCA GGC TTT ACA CTT TAT GCP2:GCG ATT AAG TTG GGT AAC GCpLEXA-F:CGT CAG CAG AGC TTC ACC ATpLEXA-R:TAA AAC CTA AGA GTC ACT TTpLNCX-F:AGC TCG TTT AGT GAA CCG TCA GAT CG pLNCX-R:ACC TAC AGG TGG GGT CTT TCA TTC CC pLXSN-F:CTT GAA CCT CCT CGT TCG ACpLXSN-R:GTT GCT GAC TAA TTG AGA TGpSHUTTLE-CMV-F:GGT CTA TAT AAG CAG AGG TG pSHUTTLE-CMV-R:GTG GTA TGG CTG ATT ATG ATC AG MalE Primer:GGT CGT CAG ACT GTC GAT GAA GCC。

常用引物序列引言:引言是文章的开端,用来引起读者的兴趣和注意力,概括文章的主题和内容。
在这篇文章中,我们将探讨一些常用的引物序列,以及它们在不同领域的应用。
一、"据说"引物序列"据说"是一种常见的引言方式,用来引述别人的话或传闻。
在新闻报道中,我们经常可以看到这样的句子,比如"据说明天会下雨"或"据说他们要离婚了"。
这种引言方式可以用来引出一些未经证实的消息或观点。
二、"有人说"引物序列"有人说"是另一种常见的引言方式,用来引用别人的意见或看法。
这种引言方式常用于讨论社会热点或争议性话题,比如"有人说女性更擅长情感表达"或"有人说男性更适合从事科学研究"。
这种引言方式可以用来引出不同人群的不同观点,展示多样性和包容性。
三、"据统计"引物序列"据统计"是一种用来引用数据或统计结果的引言方式。
在科学研究或市场调查中,我们经常使用这种引言方式来支持自己的观点或结论。
比如"据统计,80%的人认为健康饮食对身体有益"或"据统计,今年公司的销售额增长了20%"。
这种引言方式可以增加文章的权威性和可信度。
四、"有研究表明"引物序列"有研究表明"是一种常见的引言方式,用来引用科学研究的结果。
在科技领域的文章中,我们经常可以看到这种引言方式,比如"有研究表明,人类的记忆力可以通过锻炼来提升"或"有研究表明,某种药物可以治疗癌症"。
这种引言方式可以用来表达科学研究的进展和发现。
五、"根据调查显示"引物序列"根据调查显示"是一种用来引用调查结果的引言方式。
在社会科学研究或市场调查中,我们经常使用这种引言方式来描述人们的行为或态度。
RT-PCR常用引物序列RT-PCR引物序列基因来源引物序列产物大小(kb)β-actin 人有意义链CCTCG CCTTT GCCGA TCC 反义链GGATC TTCAT GAGGT AGTCA GTC 0.62 kbβ-actin* 大鼠有意义链TACAA CCTCC TTGCA GCTCC 反义链GGATC TTCAT GAGGT AGTCA GTC 0.62kbβ-actin 小鼠有意义链GTCGT ACCAC AGGCA TTGTG ATGG反义链GCAAT GCCTG GGTAC ATGGT GG 0.49 kbGAPDH 人有意义链 GGTGA AGGTC GGAGT CAACG反义链CAAAG TTGTC ATGGA TGHACC 0.50kbGAPDH 大鼠有意义链GATGC TGGTG CTGAG TATGR CG反义链GTGGT GCAGG ATGCA TTGCT CTGA 0.20 kbDynein 小鼠有意义链 GCGGG CGCTG GAGGA GAA反义链GGATC TTCAT GAGGT AGTCA GTC 12.3 kbPolymerase ε人有意义链CGCCA AATTT CTCCC CTGAAA反义链CCGTA GTGCT GGGCA ATGTT C 6.8 kbPolymerase ε人有意义链 AAGGC TGGCG GATTA CTGCC反义链GATGC TGCTG GTGAT GTACT C 3.5 kbTuberous Sclerosis 人有意义链GGAGT TTATC ATCAC CGCGG AAATA CTGAG AG反义链TATTT CACTG ACAGG CAATA CCGTC CAAGG 5.3 kb18S rRNA 大豆有意义链CTTTC GATGG TAGGA TAGTG GCCT反义链CAATG ATCCT TCCGC AGGTT CACCT AC 1.5 kb*引物不会扩增假基因PCR引物序列基因来源引物序列产物大小(kb)HIV gag region 病毒 SK 38ATTAAT CACTA TCCAG TAGGA GAAATSK 39TTTGG TCCTG TCTTA TGTCC AGAAT GC 0.11kbβ-globin 人 (29923)GGTGT TCCCT TGATG TAGCA CA(34016)CCAGG ATTTT TGATG GGACA CG 4.1kbβ-globin 人 (31194)GCTGC TCTGT GCATC CGAGT GG(34016)CCAGG ATTTT TGATG GGACA CG 2.8kb序列来源:nvitrogen 公司大家用什么稀释引物?引物应该用TE稀释。
通用引物
通用引物是一种在分子生物学中广泛应用的引物,用于扩增特定目标序列。
通用引物可以被设计成能够结合到多个不同物种的目标序列上,因此被称为“通用”。
以下是一些常见的通用引物:
1. 通用PCR引物:
- Forward引物:5' - GTGCCAGCMGCCGCGGTAA - 3'
- Reverse引物:5' - GGACTACHVGGGTWTCTAAT - 3'
2. 通用寡核苷酸引物(oligo-dT):
- 5' - AAGCAGTGGTATCAACGCAGAGTAC(T)18 - 3'
3. 通用测序引物:
- Forward引物:5' - GTGCCAGCMGCCGCGGTAA - 3'
- Reverse引物:5' - GGACTACHVGGGTWTCTAAT - 3'
这些通用引物设计得具有较高的特异性和亲和力,可以在各种不同的生物种类中扩增目标序列,例如基因组DNA、cDNA或特定的基因片段。
但是,由于不同物种的基因序列差异和变异,通用引物在不同物种中的扩增效率和特异性可能会有所差异,因此在实验设计和优化过程中需要注意选择合适的引物。
测序通⽤引物列表测序通⽤引物列表载体名称上游引物(5'primer)下游引物(3'primer)P3*FLAG-CMV CMV-30(825-854) CMV-24(1129-1152) pAc5.1/V5-His(_A,_B,_C) pAc5-5 BGH rev pAcG2T pGEX-5 not availablepACT T7EEV T3/EBVrevpACT2 GAL4 ADfor pGAL4-ADrvpACT2 p17110 p12584pACYC184(BamHI-site) PBRforBam PBRrevBampACYCDuet-1(MCSI) ACYCDuetUP1 Primer DuetDOWN1pACYCDuet-1(MCSII) DuetUp2 T7-Terminator pAdEasy-1 not available not availablepAdTrack-CMV not available not available pAS2-1 GAL4 Bdfor/P24990 pGAL4-BDrv/P31430pB42AD pB42ADF PB42ADRpBABE pBMN_5'pBacPAK8 BAC1 BAC2pBAD pBAD-F pBAD-R pBAD/HisABC pBAD-5'pBBR1MCS T3/M13rev T7/M13forpBD-GAL4 pBD-GAL4-F PBD-GAL4-RpBI121 35S NOSpBIND GAL4-Bdfor T3,EBVrevpBK-CMV M13F/T7 M13R/T3 pBluescriptIIKS(+/-) T3/M13rev T7/M13for(优先⽤M13F)pBluescriptIISK(+/-) T3/M13rev T7/M13forpBluescriptKS(+/-) T3/M13rev T7/M13forpBluescriptSK(+/-) T3/M13rev T7/M13forpBR322(BamHI-site) PBRforBam PBRrevBampBR322(EcoRI/HindIII-sites) pBRforEco pBRrevHind pBR325(BamHI-site) PBRforBam PBRrevBampBR329(BamHI-site) PBRforBam PBRrevBam pBridge(MCSI) GAL4-Bdfor 3'BDpBridge(MCSII) not available not available pBS-T II T3/M13rev T7/M13for pBS(AMP)T7 T3 pBSR T3 T7ter pBudCE4.1(MCSI) CMV-Profor,T7 c-mycrev,EBVrevpBudCE4.1(MCSII) EF-1α Fwd BGHpBudCE4.1/lacZ/CAT CMV-Profor,T7 c-mycrev,EBVrev pBV220 pBV220F PBV220RpCAL-c T7/Tac-Profor T7-TerminatorpCAL-n T7/Tac-Profor T7-Terminator pCAMBIA1301(1300) pCAMBIA1301-5'(ECORI)/M13R pCAMBIA1301-3'(HindIII) pCAMBIA1304 pCAMBIA1301-5'(ECORI) pCAMBIA1301-3'(HindIII) pCAMBIA2300 M13R(-48) M13F(-47)/M13F(-49) pCANTB5E S1 S6pCAT3-enhancer RVP3 此载体⽆反向引物pCDFDuet-1(MCSI) ACYCDuetUP1 Primer DuetDOWN1pCDFDuet-1(MCSII) DuetUP2 T7TER pcDNA1.1 CMV-Profor,T7 pCDM8-3pcDNA2.1 M13for/T7 M13rev/Tac-ProforpcDNA3 T7/CMV-Profor BGH rev/SP6 pcDNA3.1(+/-) pcDNA3.1F/T7/CMV-Profor BGH rev pcDNA3.1/His(_A,_B,_C)T7/CMV-Profor BGH rev pcDNA3.1/myc-His(_A,_B,_C) T7/CMV-Profor BGH rev/c-mycrev pcDNA3.1/V5-His(_A,_B,_C) T7/CMV-Profor BGH rev/V5rev pcDNA3.1/Hygro(+,-) T7/CMV-Profor BGH rev/V5revpcDNA3.1/Zeo(+.-) T7 BGHrevpcDNA3.3TOPOTA CMV-Profor TKPAreverse pcDNA4/HisMax(_A,_B,_C) Xpressfor BGH revpcDNA4/HisMax-TOPO Xpressfor BGH rev pcDNA4/HisMax-TOPO/lacZ Xpressfor BGH rev pcDNA4/myc-His(_A,_B,_C) T7,CMV-Profor BGH rev,c-mycrev pcDNA4/TO TREfor/CMV-Profor BGH rev pcDNA4/V5-His(_A,_B,_C) CMV-Profor,T7 BGH rev,V5rev pcDNA4-TET/ON/AMP+ CMV-ProforpcDNA5/FRT T7/CMV-Profor BGH rev pcDNA6/myc-His(_A,_B,_C) CMV-Profor,T7 BGH rev,c-mycrev pcDNA6/V5-His(_A,_B,_C) CMV-Profor,T7 BGH rev,V5rev pCEP4 pCEP-F/CMV-Profor EBVrevpCI T7(17BASE)EBVrevpCI-neo T7(17BASE)EBVrev,T3pCMS-EGFP T7 T3pCMS-EGFP T7 EBVrev,T3pCMV-3Tag-4A T3 /PFLAG-CMV-F T7 pCMV5 pCMV5F PCMV5RpCMV6 CMV-Profor pCMV6-3、HGHrevpCMV6-XL4 CMV-Profor/T7 pCMV6-3、HGHrevpCMV-HA PCMV-F,CMV-Profor,TREfor PCMV-R,EBVrev pCMV-MYC(AMP+) PCMV-F PCMV-R, EBVrev pCMVmyc/nuc CMV-Profor BGH rev,c-mycrev pcmv-scriptEXVector T3 T7 pCMV-Sport6 T7/M13for SP6/M13rev pCOLADuet-1(MCSI) ACYCDuetUP1 Primer DuetDOWN1pCOLADuet-1(MCSII) DuetUP2 T7TER pCR2.1 T7,M13for M13rev pCR2.1-TOPO M13for,T7 M13rev pCR3.1 T7 BGH rev pCR3.1-Uni T7 BGH rev pCR4 T3/M13rev T7/M13for pCR4-Blunt T3/M13rev T7/M13forpCR4-TOPO M13rev,T3 M13for,T7pCR-Blunt M13rev T7,M13forpCR-BluntII M13rev/SP6 T7/M13for pCR-BluntII-TOPO M13rev/SP6 M13for/T7 pCRII M13rev/SP6 T7/M13for pCRII-TOPO M13rev/SP6 M13for/T7pCR-ScriptSK(+) T7/M13for T3/M13revpCR-XL-TOPO M13rev T7,M13forpCS2+(MCSI) SP6 EBVrev,T7?pCS2+(MCSII) T3 pSG5-3pDB_GAL4cam T7PpDB_leu PDBLeu-5 PDBLeu-3pDEST22 DEST22F DEST22RpDEST15 pGEX-5 T7-TerminatorpDEST20 pGEX-5 pFastBac-3pDEST26 TREfor/CMV-Profor T7/M13forpDisplay T7/CMV-Profor c-mycrev pDNR-LIB(MCS_A) M13for,T7 pSG5-3,M13R pDonar M13F M13RpDONR201 PDONR-F PDONR-RpDONR207 PDONR-F PDONR-RpDONR223 M13F M13RpDrive T7/M13rev SP6/M13for pDsRED1-C1 (DsRed1-N-f) DsRed1-C-rpDsRed1-N1 CMV-Profor RFP-Nrev,CMV-R?pDsRed2-N1 (DsRed1-N-f) DsRed1-C-rpDsRed2-C1 (DsRed1-N-f) DsRed1-C-r pDsRED2-C1(KAN+) pDsRED-ex-C1-F pEGFP-N-3’ pDsRed-ExpressdsRed1_N_primer/CMV-F dsRed1_C_primer/CMV-R pDSRED-monomer-N1(KAN+) dsRed1_N_primerpDSRED-N1(KAN+) pEGFP-N-5’ pDSRED-N-RpEASY-Blunt M13F T7/ M13RpEASY-BluntSimple M13F T7/ M13R(距离插⼊位点合适,优先安排)pEASY-T1 Simple M13F M13R(距离插⼊位点合适,优先安排)pEASY-T1 M13F/T7 M13RpEASY-T3 M13F/T7 M13R/SP6pECFP-N(C) PECFP-N-5. PECFP-N-3,pEF/myc/cyto/ER/mito/nuc pEF-5 Pcdna3.1R/BGH rev pEF1(4,6/myc-His) T7/pEF-5 Pcdna3.1R/BGH rev pEF1(4,6/V5-His) T7/pEF-5 Pcdna3.1R/BGH rev pEF1(4;6/His_A;_B;_C) T7/Xpressfor Pcdna3.1R/BGH rev pEF5/FRT/V5-D(-TOPO) T7/pEF-5 Pcdna3.1R/BGH rev pEGFP M13rev EGFP-NrevpEGFP-1 not available EGFP-Nrev/ PEGFP-N-3′pEGFP-C PEGFP-C-5′ PEGFP-C-3′pEGFP-C1 EGFP-Cfor SV40-pArevpEGFP-C2 EGFP-Cfor SV40-pArevpEGFP-C3 EGFP-Cfor SV40-pArevpEGFP-F EGFP-Cfor SV40-pArevpEGFP-N PEGFP-N-5′ PEGFP-N-3′pEGFP-N1 CMV-Profor EGFP-NrevpEGFP-N2 CMV-Profor EGFP-NrevpEGFP-N3 CMV-Profor EGFP-NrevpENTR M13F M13R pET-11(-a,-b,-c,-d) T7 T7-TerminatorpET-12(-a,-b,-c) T7 T7-Terminator pET-14b T7 T7-TerminatorpET-15b T7 T7-TerminatorpET-16b T7 T7-TerminatorpET-17b T7 T7-TerminatorpET-17xb T7 T7-TerminatorpET-19b T7 T7-TerminatorpET-20b(+) T7 T7-TerminatorpET-21(-a,-b,-c,-d)(+) T7 T7-Terminator pET-22b(+) T7 T7-TerminatorpET-23(-a,-b,-c,-d)(+) T7 T7-TerminatorpET-24(-a,-b,-c,-d)(+) T7 T7-Terminator pET-25b(+) T7 T7-TerminatorpET-26b(+) T7 T7-TerminatorpET-27b(+) T7 T7-Terminator pET-28a(-b,-c)(+) T7 T7-TerminatorpET-29a(-b,-c)(+) S.tag/T7 T7-TerminatorpET-3(-a,-b,-c,-d) T7 T7-Terminator pET-30_Ek/LIC T7 T7-Terminator pET-30_Xa/LIC T7 T7-Terminator pET-30a(-b,-c)(+) S.tag/T7 T7-Terminator pET-31b(+) not available T7-Terminator pET-32_Ek/LIC TRXfor T7-Terminator pET-32_XA/LIC TRXfor T7-Terminator pET-32a(-b,-c)(+) S.tag/TRXfor T7-Terminator pET-33b(+) T7 T7-Terminator pET-34b(+) S.tag T7-Terminator pET-35b(+) S.tag T7-Terminator pET-36b(+) S.tag T7-Terminator pET-37b(+) S.tag T7-Terminator pET-38b(+) not available T7-Terminator pET-39b(+) S.tag T7-Terminator pET-40b(+) S.tag T7-Terminator pET-41_Ek/LIC GST-Cfor T7-Terminator pET-41a(-b,-c)(+) S.tag/pGEX-5 T7-Terminator pET-42a(-b,-c)(+) S.tag/pGEX-5 T7-Terminator pET-43.1a(-b,-c) (+) S.tag coliDOWN pET-43.1a_EK/LIC S.tag not available pET-44a(-b,-c)(+) S.tag T7-Terminator pET-44a_EK/LIC S.tag not available pET-45b(+) T7 T7-Terminator pET-46_Ek/LIC T7 T7-Terminator pET-5(-a,-b,-c) T7 T7-Terminator pET-52b(+) T7 T7-Terminator pET-7 T7 T7-Terminator pET-9(-a,-b,-c,-d) T7 T7-Terminator pETcoco-1 T7 T7-Terminator pETDuet-1(MCSI) pETUP1 DuetDOWN1 pETDuet-1(MCSII) DuetUp2 T7-Terminator pET-T4 T7 T7-Terminator pEYFP-C1 pEGFP-C-5’pEGFP-C-3' pEYFP-N1 pEGFP-N-5’,CMV-Profor pEGFP-N-3’ pFLAG-ATS N26for pTrcHis-rv;C24rev pFLAG-CTC N26for pTrcHis-rv;C24rev pFLAG1 N26for pTrcHis-rv;C24rev pFLAG-CMV(-2) CMV-30;CMV-Profor CMV-24 pFLAG-CMV1 CMV-30 CMV-24pGAD424 GAL4_ADfor 3'ADpGADGH GAL4_ADfor 3'ADpGADT7 T7/GAL4_ADfor 3'AD pGADT7-Rec T7/GAL4_ADfor 3'AD pGADT-T T7 3,BD pGAD10 GAL4_ADfor 3'AD pGAPZa-A a-FACTOR 3'AOX pGBKT7 T7 3,BDpGBT9 MATCHMAKER5'DNA-BD/GAL4BD MATCHMAKER3'DNA-BDpGEM-1 T7 SP6pGEM-3 T7 SP6 pGEM-3Zf(+)(-) SP6/M13rev T7/M13for pGEM-4 T7 SP6pGEM-4Z T7/M13for SP6/M13rev pGEM-5Zf(+)(-) SP6/M13rev T7/M13for pGEM-7Zf(+)(-) SP6/M13rev T7/M13for pGEM-9Zf(+)(-) T7/M13for SP6/M13rev pGEM-T T7/M13for SP6/M13rev pGEM-T_Easy T7/M13for SP6/M13rev pGene/V5-His_A(_B,_C) pGENE-5 BGH rev,V5rev pGEX-2T pGEX-5 pGEX-3pGEX-2TK pGEX-5 pGEX-3pGEX-3X pGEX-5 pGEX-3 pGEX-4T-1(-2,-3) pGEX-5 pGEX-3 pGEX-5X-1(-2,-3) pGEX-5 pGEX-3 pGEX-6P-1(-2,-3) pGEX-5 pGEX-3 pGL2 GLP1 GLP2pGL3 RVP3 GLP2(RVP4)(没有特别说明⽤GLP2)pGL3-Basic(MCSI) RVP3(PGL3+)? GLP2(PGL3-)?pGL3-Basic(MCSII) RVP4, PLXSN-3'?pGL4pGlow(-TOPO) T7 pGlow-3 pGM-T T7 SP6pGWC SP6 T7pHook-2 T7/CMV-Profor not availablepIND/V5-His_A(_B,_C) not available BGH rev,V5rev PinpointTMVector PinpointPrimer SP6pIRES(MCSI) T7 pIRES-3pIRES(MCSII) not available T3,EBVrevpIRES2-EGFP CMV-Profor,pIRES2-EGFP.P5’ IRESrev,pIRES2-EGFP.P3’ pIRES-hrGFP-2a CMV-Profor,T3 pIRES-hrGFP-3 pIRESneo2 T7/CMV-Profor pIRES-3pIVEX(all) T7/pBRrevBam T7-TerminatorpLEXA pLEXA-F pLEXA-RpLNCX pLNCX-F pLNCX-RpLNCX2 CMV-Profor pRevTRE-3 pLVTHM(H1启动⼦下游)H1primer SP6 pLXSN pLXSN-F pLXSN-RpMALc MalE primer M13F(-47)pMAL-c2E MalE primer M13F(-47)pMAL-C2x Pmal-c2x-F(P5’) Pmal-C2X-R(P3’ )pMALd MalE primer M13F(-47)pMALe MalE primer M13F(-47)pMAL-P4X MalE primer M13F(-47)pMAL-p2X MalE primer M13F(-47)pMET A/B/C AUG1F AUG1RpMD18-T M13R(-48)ECORI M13F(-47)(HINDⅢ)pMD19-T M13F47 M13R48pMD20-T M13F47 M13R48pMOSBlue T7/M13rev M13forpMSCV-puro pLXSNfw pMSCVrev pMT/V5-His_A(_B,_C) Mtfor BGH rev,V5rev pNTAP T3 T7pCTAP pCTAP5'primer T7pOTB7 M13rev/T7 M13for/SP6 pOptiVEC-TOPO TA CMV-F/CMV-Profor EMCVIRES reverse pPC86 PPC86-F PPC86-R pPC97 PBD-GAL4-F PBD-GAL4-RpPIC3.5K 5'AOX 3'AOXpPic9k(A+,Z+) 5’AOX(Ppic9k-f)/a-factor 3’AOX(Ppic9k-R) pPICZa 5'AOX/PPICZa-F 3'AOX pPROEXHTA M13R(-48) ⽆反向引物pProEX-HTa(b,c) M13R48/ Tac-Profor pBADrv/pTrcHis-3 pPD129.36 M13F20/M13F pQE30or40or60(AMP+) PQE30-F PQE-30R pRC/CMV2/CAT CMV/T7pRECEIVER CMV-F 此载体⽆反向引物pRECEIVER-M03 pRECEIVER-M03F pRECEIVER-M03R pREP4 pREP4 forward primer EBV reverse primerpRK5 SP6 pSG5-3pRSET T7/Xpressfor T7ter pRSFDuet-1(MCSI) DuetUP1 DuetDOWN1 pRSFDuet-1(MCSII) DuetUP2 T7TER pSecTac2T7/CMV-Profor BGH rev/c-mycrevpSG5 pSG5-5,/T7 PSG5-R(SV40)pSHlox1 T7 SP6 pSHUTTLE-CMV PSHUTTLE-CMV-F PSHUTTLE-CMV-R pSI T7 EBVrev pSilencer1.0-U6 T7 T3pSilencer2.0-U6 T7 M13for pSilencer2.1-U6neo T7 M13for pSilencer3.1-H1hygro M13F(-47) 3.0REV pSilencer4_1-CMVneo pSilener4.1-5' CMV-Profor pSILENCEV2.0-U6 T7 2.0REV pSIneo T7 EBVrev,T3Psit T7 T7T pSK01-T M13F M13RpSK-CMV(KAN+) T7 T3 pSOS Psos5' Psos3'pSP64 SP6 M13revpSP64/65 SP6 此载体⽆反向引物pSP65 SP6 M13revpSP70 SP6 T7pSP71 SP6 T7pSP72 SP6 T7pSP73 SP6 T7pSport1 SP6/M13F(-47) T7/M13RpSPORT1 SP6/M13for T7/M13revpSPT18 SP6 T7pSTBlue T7/M13rev SP6/M13for pSUPER.Basic T7/M13F M13R pSUPER T7 T3pSURE-T M13F M13R pSURE-Tsimple M13F-47 M13R-48 pSuperCos pBRforEco T7pT3T7 M13rev/T3 M13for/T7pT7-7 T7 not availablepT7Blue? T7 M13F(-47)pT7T3_18U M13rev/T7 M13for/T3 pT7T3D-PAC M13rev/T7 M13for/T3 pTA2 M13F/T7(优先使⽤M13F)T3/M13RpT-Adv M13rev T7,M13forpTAg T7/M13rev M13for pTARGETTM pTarget.F(在T7前⾯)/T7 pTarget.R pTG19-T M13F(-47) M13R(-48) pTARGETTM T7/M13F PTARGET-SEQ pThioHisA,B,andC Trx Forward Trx Reverse / M13forpTO-T7 T7 T7TERpTRC99A PTRC99A-F pTrcHis-rvpTrc99a-c PTRC99C-F PTRC99C-RpTRC99a-c PTRC99C-F PTRC99C-RpTrcHisB PTrcHisA-F/Xpressfor PTrcHisA-RpTrcHisA PTrcHisA-F PTrcHisA-RpT-REX-DEST30 TREfor T7 pTriEx1 T7/TriExup TriExdownpTriEx1.1 T7/TriExup TriExdownpTriEx1.1_Hygro T7/TriExup not availablepTriEx1.1_Neo T7/TriExup IRESrevpTriplEX1 TriplEx-LD-5 T7,TriplEx-LD-3pTriplEX2 TriplEx-LD-5;pTR5‘ T7,TriplEx-LD-3pTWIN-1 T7 T7TERpTXB1 T7 MxeInteinrevpTXB2 T7 MxeInteinrevpTXB3 T7 MxeInteinrevpTYB1 T7 InteinrevpTYB2 T7 InteinrevpTYB3 T7 InteinrevpTYB4 T7 InteinrevpTZ_18U T7/M13rev M13forpUB6/V5-His UB-F BGH rev,V5rev pUC13 M13rev/M13rev(-48) M13for/M13for(-49)pUC18 M13rev/M13rev(-48) M13for/M13for(-49) pUC18(19)/118(119) M13F(-47) M13R(-48)/PUC19(HINDⅢ) pUC19M13rev/M13rev(-48) M13for/M13for(-49)pUC57 M13rev/M13rev(-48) M13for/M13for(-49)pUC8 M13rev/M13rev(-48) M13for/M13for(-49)pUC9 M13rev/M13rev(-48) M13for/M13for(-49)pUM-T M13F(-20) M13R(-20)pUCm-T(AMP+) M13F/T7 M13RpUNI/V5-His not available BGH rev,V5revpVAX1T7 T7/CMV-Profor PCDNA3.1R/BGHR pVP22/mycHis VP22-Cfor BGH rev,c-mycrev pVP22/mycHis2 T7/CMV-Profor VP22-Nrev pWE15 pBRrevHind T7pYES2 T7 pYes2.R pYES-DEST52 T7/GAL1-Profor V5rev/CYC1-Terminator pYEX_4T_1 Clontech pYEX_4T-3pYEX_4T_2 pGEX-5 pYEX_4T-4pYEX_4T_3 pGEX-5 pYEX_4T-4pYEX_4T_4 pGEX-5 pYEX_4T-4 pZeoSV2+/hu-Tyr T7 not available pZERO-1 M13rev/SP6 T7/M13forpZERO-2 M13rev/SP6 M13for/T7pZome-1-C Zome-F Zome-RpZome-1-N Zome-F Zome-R YCp50(BamHI-site) PBRforBam PBRrevBam YEp13(BamHI-site) PBRforBam PBRrevBam YEp24(BamHI-site) PBRforBam PBRrevBam YIp5(BamHI-site) PBRforBam PBRrevBam RNAi-ReadypSIREN-RetroQ-U6ZsGreen U6菌PCDB T7 BGH 天为时代TA载体T7 T3 m13(+)T7?T3?pMSCV-neo pMSCV-5' pMSCV-3'。
常用载体及相关通用引物默认分类2008-10-06 13:16:31 阅读512 评论0 字号:大中小载体一端另一端pBlueScriptSK(+) M13F(-77)/M13F(-47)/M13F/T7 M13R(-88)/M13R(-48)/M13R/T3 pcDNA3 H1.3F/pCMV-F /pEGFP-N-5/T7 BGHpcDNA3.1(+) H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.0(+)/myc-His C/A/B H1.3F/pCMV-F /pEGFP-N-5/T7 BGHpcDNA3.1(+)/myc-His C/A/B H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1(+)/myc-His/LacZ H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/His C/A/B H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/His/LacZ H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/Hygro(-) H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/Hygro(+) H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/Hygro/LacZ H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/V5-His C/A/B H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/V5-His/LacZ H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/V5-His-TOPO H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/V5-His-TOPO/LacZ H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/Zeo(-) H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/Zeo(+) H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpcDNA3.1/Zeo/CAT H1.3F/pCMV-F /pEGFP-N-5/T7 pCDNA3.1R/BGHpColdI DNA p-GEX3’pColdII DNA p-GEX3’pColdIII DNA p-GEX3’pColdIV DNA p-GEX3’pDream2.1 H1.3F/pCMV-F /pEGFP-N-5/T7 SP6pEGFP-N1,2,3 H1.3F/pCMV-F /pEGFP-N-5 pEGFP-N-3’/pEGFP-C-5’/pEGFP-C-3' pET15b T7 T7terpET20b T7 T7terpET22b T7 T7terpET28a T7 T7terpET28b T7 T7terpET30b T7 T7terpFastBac Dual pEGFP-C-3'pFastBac HT A,B,C pEGFP-C-3'pFastBac1 pEGFP-C-3'pGEM-T Easy M13F(-77)/M13F(-47)/M13F/T7 M13R(-88)/M13R(-48)/M13RpGEX-4T-1/3 p-GEX5’ p-GEX3’pGS-21a p-GEX5’ T7terpLenti6/V5-D-TOPO M13F(-47)/M13F/T7 M13R(-48)/M13R/T3pLenti6/V5-GW/lacZ M13F(-47)/M13F/T7 M13R(-48)/M13R/T3pMAL-p2x M13F(-47)/M13F/PBV220R M13R(-48)pMD18-T M13F(-77)/M13F(-47)/M13F M13R(-88)/M13R(-48)/M13RpMD19-T M13F(-77)/M13F(-47)/M13F M13R(-88)/M13R(-48)/M13RpMTBiPV5-His GFP p-GEX3’/ M13F(-47)/M13F M13R(-88)/M13R(-48)/M13R /pEGFP-C-3'/BGH pPCR script M13F(-77)/M13F(-47)/M13F/T7 M13R(-88)/M13R(-48)/M13R/T3pPIC3.5 5’AOX 3’AOXpPIC9 5’AOX 3’AOXpPICZ C/A/B 5’AOX 3’AOXpPICZalpha C/A/B 5’AOX/α-Factor 3’AOXpSecTag2 A,B,C H1.3F/pCMV-F /pEGFP-N-5/T7 BGHpTWIN T7 T7terpUC57 M13F(-77)/M13F(-47)/M13F M13R(-88)/M13R(-48)/M13RpUC18 M13F(-47)/M13F M13R(-48)/M13RpUC19 M13F(-47)/M13F M13R(-48)/M13R其他…… ……注:1)排列顺序为:有左到右==(离插入为点)由远到近;2)若有多个引物,红色的为首选引物:3)选择测序通用引物时,以距离插入位点约50碱基为佳;4)同时有T7,T7ter的载体,单反应首选T7ter;5)同时有T7,pCDNA3.1R的载体,单反应首选pCDNA3.1R ;6)同时有T7,BGH的载体,单反应首选BGH;7)同时有pCMV-F,BGH的载体,单反应首选BGH;。
实验室常用技术参数资料一、核酸及蛋白质常用数据1.核苷三磷酸的物理常数2.常用核酸的长度与分子量3.常用核酸蛋白换算数据(1)重量换算1μg=10-6g1pg=10-12g1ng=10-9g 1fg=10-15g(2)分光光度换算:1A260双链DNA=50μg/ml1A260单链DNA=30μg/ml1A260单链RNA=40μg/ml(3)DNA摩尔换算:1μg 100bp DNA=1.52pmol=3.03pmol末端1μg pBR322 DNA=0.36pmol1pmol 1000bp DNA=0.66μg1pmol pBR322=2.8μg1kb双链DNA(钠盐)=6.6×105道尔顿1kb单链DNA(钠盐)=3.3×105道尔顿1kb单链RNA(钠盐)=3.4×105道尔顿(4)蛋白摩尔换算:100pmol分子量100,000蛋白质=10μg100pmol分子量50,000蛋白质=5μg100pmol分子量10,000蛋白质=1μg氨基酸的平均分子量=126.7道尔顿(5)蛋白质/DNA换算:1kb DNA=333 个氨基酸编码容量=3.7×104MW蛋白质10,000MW蛋白质=270bp DNA30,000MW蛋白质=810bp DNA50,000MW蛋白质=1.35kb100,000MW蛋白质=2.7kb DNA4.常用蛋白质分子量标准参照物5.常用DNA分子量标准参照物续上表二、常用缓冲液1.分子克隆常用缓冲液2.磷酸缓冲液(1)25℃下0.1mol/L磷酸钾缓冲液的配制※(2)25℃下0.1mol/L磷酸钠缓冲液的配制※※:用蒸馏水将混合的两种1mol/L贮存液稀释至1000ml,根据Henderson-Hasselbalch方程计算其pH 值:pH=pK’+1g([质子受体]/[质子供体])在此,pK’=6.86(25℃)。
3.电泳缓冲液测序凝胶加样缓冲液98%去离子甲酰胺10mol/L EDTA(pH8.0)0.025%二甲苯青FF0.025%溴酚蓝甲酰胺:许多批号的试剂级甲酰胺,其纯度符合使用要求,无须再进行处理。
实验常用试剂、缓冲液的配制方法Na2HPO4,2 mM KH2PO4 1 M Tris-HCl 、11M Tris-HCl □组份浓度□配制量□配制量1L 1L (pH7.4,7.6,8.0)□配置方法1. 称量下列试剂,置于1L烧杯中。
烧杯中。
□配置方法1. 称量121.1gTris置于1LNaCl 加入约800mL的去离子水,充分搅拌溶解。
8 g 2.KCl 0.2g3. 按下表量加入浓盐酸调节所需要的pH值。
Na2HPO4 1.42 g 浓值HCl pHKH2PO4 0.27g 7.4约70mL2. 向烧杯中加入约800 mL的去离子水,充分搅拌溶解。
7.6 约60mL3. 滴加HCl将pH42mL 8.0约值调节至7.4,然后加入去离子水将溶液定容至1L。
4. 将溶解定容至1L。
4. 高温高压灭菌后,室温保存。
5. 高温高压灭菌后,室温保存。
注意:上述PBS Buffer中无二价阳离子,如需要,可在配方中pH注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的补充1mM CaCl2和0.5 mM MgCl2。
pH值随温度的变化差很大,温度每升高1℃,溶液的值大约降低6、10 M醋酸铵0.03个单位。
□组份浓度10 M醋酸铵□配制量100mL 1.5 M Tris-HCl 2、1.5 M Tris-HCl □组份浓度□配置方法1. 称量77.1g醋酸铵置于100~配制量pH8.8 ()□1L 200 mL烧杯中,加入约30 mL的去离子水搅拌溶解。
1L1. □配置方法称取181.7gTris置于烧杯中。
2. 加入约800mL2.加去离子水将溶液定容至100mL。
的去离子水,充分搅拌溶解。
3.使用8.8pH3. 用浓盐酸调值至。
0.22μm滤膜过滤除菌。
4.密封瓶口于室温保存。
1L 4. 将溶液定容至5. 高温高压灭菌后,室温保存。
注意:醋酸铵受热易分解,所以不能高温高压灭菌。
7、Tris- HCl平衡苯酚□溶液的注意:应使溶液冷却至室温后再调定pH值,因为Tris配置方法1. 使用原料:大多数市售液化苯酚是清亮无色的,pH值大约无需重蒸馏℃,溶液的值随温度的变化差异很大,温度每升高pH1便可用于分子生物学实验。
0.03降低个单位。
但有些液化苯酚呈粉红色或黄色,应避免使用。
同时也应避免使用结晶苯酚,结晶苯酚必须在160℃对其,□TE Buffer、310×组份浓度100 mM Tris-HCl10 mM EDTA这些氧化产物可引起磷酸二酯进行重蒸馏除去诸如醌等氧化产物,1L 配制量),,(pH 7.47.68.0 □、苯酚的质量对DNADNA的交联等。
因此,键的断裂或导致1L1. 配置方法□量取下列溶液,置于烧杯中。
RNA 和的提取极为重要,我们推荐使用高质量的苯酚进行分子生物8.07.6pH7.4 1 MTris-HCl Buffer(,,)100mL RNA )20mL 学实验。
pH8.0500 mM EDTA (操作注意:苯酚腐蚀性极强,并可引起严重灼伤,操作时向烧杯中加入约 2. 800mL2. 的去离子水,均匀混合。
与苯酚接触1L将溶液定至3. 后,高温高压灭菌。
所有操作均应在通风橱中进行,应戴手套及防护镜等。
4. 室温保存。
过的皮肤部位应用大量水清洗,并用肥皂和水洗涤,忌用乙醇。
分配于有机相,因4条件下醋酸钠组份浓度□醋酸钠、3 M 3 M pHDNA 3. 苯酚平衡:因为在酸性以上,苯酚)pH5.2(值达到100mL 7.8此使用苯酚前必须对苯酚进行平衡使其pH □配制量~100置于称取1. □配置方法40.8gNaOAc?3H2O200mL烧杯平衡操作方法如下:℃,此时的苯酚呈现结晶状态。
从40mL中,加入约的去离子水搅拌溶解。
-20①液化苯酚应贮存于℃加入冰乙酸调节 2. 冰柜中取出的苯酚首先在室温下放置使其达到室温,然后在68 5.2值至pH。
100mL加入去离子水将溶液定容至3. 。
水浴中使苯酚充分溶解。
%。
该化合物0.1 高温高压灭菌后,室温保存。
4. )至终浓度加入羟基喹啉(②8-Quinolinol 酶的不完全抑制剂及金属离子的弱螯合剂,RNA是一种还原剂、10 mM,2.7mM KCl,137 mM NaCl 组份浓度□PBS Buffer、5.同时因其呈黄色。
有助于方便识别有机相。
EDTA,50mM Glucose(质粒提取用)),使用磁力搅拌器搅□配制量1L ③加入等体积的1M Tris-HCl(pH8.0 分钟,静置使其充分分层后,除去上层水相。
□配置方法1. 量取下列溶液,置于1L烧杯中。
拌15 ④重复操作步骤③。
1M Tris-HCl(pH8.0)25mL0.5 M EDTA(pH8.0⑤加入等体积的0.1M Tris-HCl(pH8.0),使用磁力搅拌器)20mL20%Glucose(1.11M)15搅拌分钟,静置使其充分分层后,除去上层水相。
45mLdH2O 910mL ⑥重复操作步骤⑤,稍微残留部分上层水相。
2. 高温高压灭菌后,4℃保存。
⑦使用pH试纸确认有机相的pH值大于7.8。
3. 使用前每50 mL的Soliution I中加入2mL的℃避光保存。
⑧将苯酚置于棕色玻璃瓶中4RNase A(20mg/mL)。
15、Solution II/8、苯酚/氯仿异戊醇□配置方法□组份浓度250mM NaOH,1%(W/V)SDS(质粒提取用)□配制量500mL 异 1. 说明:从核酸样品中除去蛋白质时常常使用苯/酚/氯仿/ □配置方法1. 量取下列溶液置于500mL烧杯中。
125 1)。
氯仿可使蛋白(:24 :)质变性并有戊醇(25:24:10而异戊醇则有助于消除抽提过程中出现%SDS 50mL 助于液相与有机相的分离,的气泡。
2N NaOH 50mL2. 加灭菌水定容至异戊醇500mL,充分混匀。
Tris-HCl 2. 配置方法:将平衡苯酚与等体积的氯仿/3. 室温保存。
此溶液保存时间最好不要超过一个月。
)均匀混合后,移入棕色玻璃瓶中:14℃保存。
(24 注意:SDS易产生气泡,不要剧烈搅拌。
SDS W/V)10 %(9、10W/V)SDS□组份浓度%(16、Solution III□组份浓度3M KOAc,5M CH3COOH 配制量□100mL(质粒提取用)□配制量500mL 200mLSDS1. 称量10g高纯度的置于100~烧杯中,□配置方法□配置方法1. 的去离子水,加入约80mL68℃加热溶解。
量取下列溶液置于500mL烧杯中。
7.22. 滴加数滴浓盐酸调节pH值至。
KOAc147gCH3COOH 57.5mL3. 将溶液定容至100mL后,室温保存。
2. 10、加入300mL去离子水后搅拌溶解。
2 N NaOH □组份浓度2N NaOH3. 加去离子水将溶液定容至100mL 500mL。
□配制量4. □高温高压灭菌后,4 ℃保存。
配置方法17、0.5M EDTA□组份浓度塑料烧杯中(~去离子水置于1.量取80mL100200mLNaOH 0.5 M EDTA(pH8.0) □配制量溶解过程中大量放热,有可能使玻璃烧杯炸裂)。
1L□配置方法小心地逐渐加入到烧杯中,边加边搅拌。
称取 2. 8g NaOH 1. 称取186.1g Na2EDTA?2H2O,置于1L烧杯中。
2. 加入约800mL。
用去离子水将溶液体积定容至NaOH3. 待完全溶解后,100mL的去离子水,充分搅拌。
)。
(约pH值值8.020g NaOH 3. 将溶液转移至塑料容器中后,室温保存。
4. 用NaOH调节8.0时,EDTA才能完全溶解。
注意:pH2.5 N HCl 组份浓度、112.5 N HCl□值至 4. 100mL 配制量□加去离子水将溶液定容至1L。
78.4mL1. 配置方法□在21.6mL的去离子水中加入的浓盐酸5. 适量分成小份后,高温高压灭菌。
(11.6N6. ),均匀混合。
室温保存。
室温保存。
2. 组份浓度1 M DTT □18、1 M DTT组份浓度□、125 M NaCl 5 M NaCl 配制量20mL □塑料离心管内。
称取1. 3.09g DTT 1L □配制量,加入到50mL □配置方法,溶解烧杯中,加入约置于292.2g NaCl称取1. 1L)(0.01 M 的NaOAcpH5.2800mL 2. 加20mL的□配置方法的去离子水后搅拌溶解。
后使用0.22μm滤器过滤除菌。
适量分成小份后,-20 后,适量分成小份。
1L2. 加去离子水将溶液定容至℃保存。
3.组份浓度10mM A TP 19 ℃保存。
43. 高温高压灭菌后,、10mM A TP □组份浓度□Glucose )W/V%()W/V%(20 Glucose 20mL □配制量20、13塑料离心50mL称取121mg Na2A TP?3H2O,加入到配置方法□1. 100mL配制量□管内。
加入约烧杯中,~100置于20g Glucose称取1. □配置方法200mL 25mM Tris-HCl的(pH8.0),搅拌溶解。
20mL 的去离子水后,搅拌溶解。
80mL 2. 加℃保存。
适量分成小份,。
100mL加去离子水将溶液定容至 2. 3. -20高温高压灭菌后, 3. ℃保存。
4 分子生物学实验常用培养基的配制方法10mM,)pH8.0(25 mM Tris-HCl 组份浓度□Solution I 、14.1、Ampicillin □组份浓度100mg/ml Ampicillin K2HPO4)100mL。
2.称取下列试剂,置于1L烧杯中。
(100mg/ml)□配制量50mLTryptone 12g 5g Ampicillin置于50mL离心管中。
□配置方法1. 称量Yeast Extract 。
24g 2. 加入40mL灭菌水,充分混合溶解后,定容至50mL Glycerol 4mL 3. 用0.22μm滤膜过滤除菌。
3. 加入约800mL的去离子水,充分搅拌溶解。
℃保存。
4. 小份分装(1mL/份)后,-20 4. □组份浓度24mg/mL IPTG 加去离子水将培养基定容至1L后,高温高压灭菌。
2、IPTG5. 待溶液冷却至60℃以下时,加入100mL(24mg/mL)□配制量50mL 的上述灭菌磷酸盐缓冲液。
50mL离心管中。
置于配置方法1. 称量1.2g IPTG6. 4℃保存。
加入40mL灭菌水,充分混合溶解后,定容至50mL。
2.7、TB/Apm培养基□组份浓度3. 用0.22μm滤膜过滤除菌。
1.2%(W/V)Tryptone2.4℃保存。
%(W/V)Yeast Extract 份)后,4. 小份分装(1mL/-20 0.4 3、X- Gal □组份浓度20mg/mL X- Gal %(V/V)Glycerol□配制量50mL 17mM KH2PO420mg/mL()72mM K2HPO4 置于□配置方法1. 称取1g X-Gal50mL离心管中。