第6、7章 分子结构、晶体结构自测题
- 格式:doc
- 大小:42.00 KB
- 文档页数:2
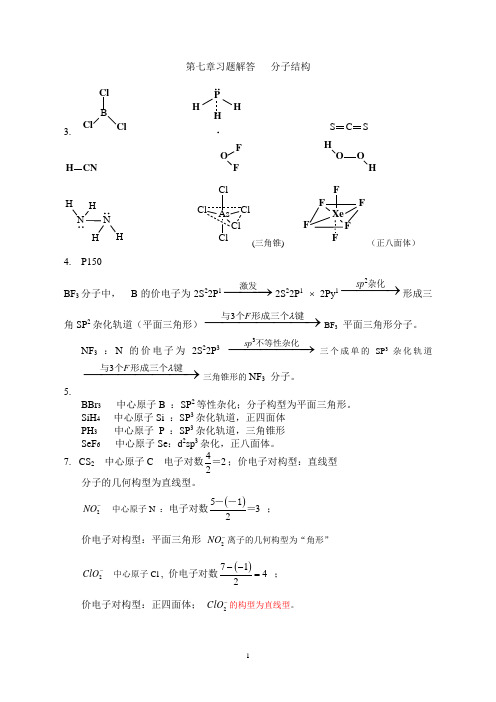
第七章习题解答 分子结构3.BClClClP HHHC S S H CNOFFOH O HH H N H(三角锥)(正八面体)4. P150BF 3分子中, B 的价电子为2S 22P 1−−−→激发2S 22P 1 ⨯ 2Py 12sp −−−→杂化形成三角SP 2杂化轨道(平面三角形)3F λ−−−−−−→与个形成三个键BF 3平面三角形分子。
NF 3 :N 的价电子为2S 22P 33sp −−−−−→不等性杂化三个成单的SP 3杂化轨道3F λ−−−−−−→与个形成三个键三角锥形的NF 3 分子。
5.BBr 3 中心原子B :SP 2等性杂化;分子构型为平面三角形。
SiH 4 中心原子Si :SP 3杂化轨道,正四面体 PH 3 中心原子 P :SP 3杂化轨道,三角锥形 SeF 6 中心原子Se :d 2sp 3杂化,正八面体。
7. CS 2 中心原子C 电子对数422=;价电子对构型:直线型分子的几何构型为直线型。
2NO -中心原子N :电子对数()532--1= ; 价电子对构型:平面三角形 2NO -离子的几何构型为“角形”2ClO -中心原子Cl , 价电子对数()7142--= ; 价电子对构型:正四面体; 2ClO -的构型为直线型。
3I - 中心离子I - ;价电子对数()71252--+=;价电子对构型:三角双锥;3I -的几何构型为直线型。
3NO - 中心原子N ;价电子对数()5132--=; 价电子对构型:平面三角形;3NO -的几何构型为平面三角形3BrF 中心原子 Br ;价电子对数7352+=; 价电子对构型:三角双锥;分子的几何构型为“T ”形。
4PCl +中心原子 P ;价电子对数54142+-=; 价电子对构型:正四面体;离子的几何构型:正四面体4BrF-中心原子 Br ;价电子对数()74162+--=; 价层电子对构型:正八面体;离子的几何构型为:平面正方形5PF 中心原子 P ;价层电子对数5552+=; 价层电子对构型:三角双锥;分子的几何构型:三角双锥5BrF 中心原子Br ;价电子对数7+562=; 价层电子对构型:正八面体;5BrF 分子的几何构造:四方锥36[]AlF - 中心原子:Al ; 价电子对数()36362+--=;价层电子对构型:正八面体;36[]AlF -离子的几何构型:正八面体11. 4CH :非极性分子; 虽然C -H 键有极性,但由于4CH 是空间正四面体分子,键的极性刚好抵消。

高中化学竞赛专题考试——分子结构1 (路易斯结构式、共振式、VSPER 理论)1.008Zr Nb Mo T cRu Rh Pd Ag Cd In S n S b T e I Hf T a W Re OsIr Pt Au Hg T l Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt一. 选择题(每题只有一个正确选项,每题2分,共50分)1. 根据鲍林近似能级图,在多电子原子中,基态时,下列电子均处于一定的能级,其中占据能级最高轨道的电子是: ( )A 2,1,1,+1/2B 3,1,1,+1/2C 3,2,1,+1/2D 4,0,0,1/22. 下列离子的电子构型可以用[Ar]3d 6表示的是 ( )A Mn 2+B Fe 3+C Co 3+D Ni 2+3. 下列离子半径变小的顺序正确的是 ( )A F ->Na +>Mg 2+Al 3+B Na +>Mg 2+>Al 3+>F -C Al 3+>Mg 2+>Na +>F -D F ->Al 3+>Mg 2+>Na +4. 下列元素的原子中,第一电离能最大的是 ( )A BeB BC CD N5. 下列物质中,含极性键的非极性分子是 ( ) A H 2O B HCl C SO 3 D NO 26. 下列分子中,没有配位键的是 ( ) A CO B (BeCl 2)2 C CH 3OBF 3 D N 2H 47. NO 3— 合理的共振式总数为 ( ) A 1 B 2 C 3 D 48.下列分子中,键级等于零的是 ( )A .O 2 B. F 2 C. N 2 D. Ne 29.原子轨道沿两核连线以“肩并肩”方式进行重叠的是 ( )A. б键B. 氢键C. π键D. 离子键10. 下列物种中,键长最短的是 ( ) A O 2 B O 2+ C O 2— D O 22—11. 下列化合物中,极性最大的是 ( ) A CS 2 B H 2O C SO 3 D SnCl 412. 下列物种中,既是路易斯酸,也是路易斯碱的是 ( ) ACCl 4 B SOCl 2 C NH 2— D Hg 2+13. 估计下列分子中,键角最小的是 ( ) ( ) A NH 3 B PH 3 C AsH 3 D SbH 314.估计下列分子或离子中,键角最小的是 ( ) A NH 3 B NO 3— C NF 3 D NCl 315. 几何形状是平面三角形的离子是()A SO-23B SnCl-3C CH-3D NO-316. 下列分子或离子为平面四方构型的是()A ICl4—B ClO4—C BrF4+D SF417. 下列分子或离子中,属于三角锥构型的是()A BCl3B H3O+C BrF3D CH+318. 下列化合物中,可能含有卤桥键的是()A SnCl4B BeCl2C CCl4D NCl319. IF5是共价化合物,但液态IF5是电的良导体,原因是IF5二聚后电离,得到各带一个单位正负电荷的阴阳离子,则在该液体中存在的阳离子的几何构型是()A 三角双锥B 四方锥C 平面四方D 变形四面体20 下列哪一个分子的空间构型为折线型()A N3—B I3—C SO32—D CO32—21.下列分子中,偶极矩不为零的是()A BeCl2B BF3C NF3D CH422. 下列分子或离子中,键角最大的是()A XeF2B NCl3C CO-23D PCl+423 通过测定AB2型分子的偶极距,能够判断:()A分子的空间构型 B 两元素的电负性之差C A—B键的极性D A—B键的键长24. 下列分子中含有两个不同键长的是()A CO2B SO3C SF4D XeF425. 下列分子中,最不容易聚合的是()A N2O5B BeCl2C AlCl3D NO2二、填空题(共50分)26.(粒子σ键π键N2HCNBBr3(CN)2SiCl427.(10分)写出下列物质的Lewis结构(若有多种共振式,请规范写出,注明形式电荷):分子或离子Lewis结构式H2O3(火箭燃料)HOCNNH2OHSbF5N2O328.(20分)填写下列表格分子或离子中心原子孤电子对数价层电子对数理想电子对构型分子或离子空间构型BeCl2PCl5SO2NOClI3—ClO2—XeF4ClO3FXeO3XeO429.(12分)在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。

分子结构和晶体结构模拟练习题一、选择题:1.1229下列卤化物中,共价性最强的是()(A)LiF(B)RbCl(C)LiI(D)BeI 22.7033下列离子半径大小顺序正确的是()(A)F ->Na +>Mg 2+>Al 3+>O 2-(B)O 2->F ->Na +>Mg 2+>Al 3+(C)O 2->F ->Al 3+>Mg 2+>Na +(D)Na +>Mg 2+>Al 3+>F ->O 2-3.4032下列物质熔点变化顺序中,不正确的是()(A)NaF>NaCl>NaBr>NaI(B)NaCl<MgCl 2<AlCl 3<SiCl 4(C)LiF>NaCl>KBr>CsI(D)Al 2O 3>MgO>CaO>BaO4.4027试判断下列说法,正确的是()(A)离子键和共价键相比,作用范围更大(B)所有高熔点物质都是离子型的(C)离子型固体的饱和水溶液都是导电性极其良好的(D)阴离子总是比阳离子大5.4019下列物质中,既有离子键又有共价键的是()(A)KCl(B)CO(C)Na 2SO 4(D)6.4023下列原子轨道中各有一个自旋方向相反的不成对电子,则沿x 轴方向可形成σ键的是()(A)2s -4(B)2p x -2p x (C)2p y -2p y (D)3d xy -3d xy 7.1007下列分子中含有两个不同键长的是()(A)CO 2(B)SO 3(C)SF 4(D)XeF 4+4NH 2z d8.7057下列分子或离子中,键长最短而键强度最大的一种是()(A)(B)O 2(C)(D)9.7034下列各组原子轨道中不能叠加成键的是()(A)p x –p x (B)p x –p y (C)s –p x (D)s –p z10.4096下列各组双原子分子中,均具有顺磁性的是()(A)O 2,B 2(B)C 2,O 2(C)B 2,Be 2(D)Be 2,O 211.1041在气态C 2中,最高能量的电子所处的分子轨道是()(A)σ2p (B)σ*2p (C)π2p (D)π*2p12.7379溴的沸点是58.8℃,而氯化碘的沸点是97.4℃,ICl 比Br 2的沸点高的主要原因是()(A)ICl 的分子量比Br 2大(B)ICl 是离子型化合物,而Br 2为共价型分子(C)ICl 的蒸气压比Br 2高(D)ICl 是极性分子,而Br 2为非极性分子13.4308的几何构型是()(A)平面三角形(B)三角锥形(C)T 形(D)直线形14.4300下列分子中偶极矩非零的是()(A)SF 6(B)SF 4(C)PCl 5(D)BCl 315.7053BF 3与NH 3之间的结合力是()(A)分子间力(B)氢键(C)π键(D)配位键16.7046如下分子偶极矩为零的是()O 2+O 2-O 22-CO 32-(A)(B) (C)(D)17.4037下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V 形)的是()(A)(B)SO 2(C)H 3O +(D)OF 218.1087下列物质的熔点由高到低的顺序为()a.CuCl 2b.SiO 2c.NH 3d.PH 3(A)a>b>c>d(B)b>a>c>d(C)b>a>d>c(D)a>b>d>c19.1073下列各晶体中,熔化时只需克服色散力的是()(A)K(B)H 2O(C)SiC(D)SiF 420.7042下列说法中正确的是()(A)色散力仅存在于非极性分子之间(B)极性分子之间的作用力称为取向力(C)诱导力仅存在于极性分子与非极性分子之间(D)相对分子质量小的物质,其熔点、沸点也会高于相对分子质量大的物质21.4042下列各体系中,溶质和溶剂分子之间,三种范德华力和氢键都存在的是()(A)I 2的CCl 4溶液(B)I 2的酒精溶液(C)酒精的水溶液(D)CH 3Cl 的CCl 4溶液 C HCl H Cl N N H H HH O O H C ClH Cl H4NH二、填空题(共16题32分)1.1077Ag +半径126pm ,I -半径216pm ,按半径比规则AgI 应具有__________型晶格,正、负离子的配位数之比应是__________;但它却具有立方ZnS 型晶格,正、负离子配位数之比__________,这主要是由于______________________造成的。

第六章化学键理论本章总目标:1:掌握离子键、共价键和金属键的基本特征以及它们的区别;2:了解物质的性质与分子结构和键参数的关系;3:重点掌握路易斯理论、价电子对互斥理论、杂化轨道理论以及分子轨道理论。
4:熟悉几种分子间作用力。
各小节目标:第一节:离子键理论1:掌握离子键的形成、性质和强度,学会从离子的电荷、电子构型和半径三个方面案例讨论离子的特征。
2:了解离子晶体的特征及几种简单离子晶体的晶体结构,初步学习从离子的电荷、电子构象和半径三个方面来分析离子晶体的空间构型。
第二节:共价键理论1;掌握路易斯理论。
2:理解共价键的形成和本质。
掌握价键理论的三个基本要点和共价键的类型。
3:理解并掌握价层电子对互斥理论要点并学会用此理论来判断共价分子的结构,并会用杂化轨道理论和分子轨道理论来解释分子的构型。
第三节:金属键理论了解金属键的能带理论和三种常见的金属晶格。
第四节:分子间作用力1:了解分子极性的判断和分子间作用力(范德华力)以及氢键这种次级键的形成原因。
2;初步掌握离子极化作用及其强度影响因素以及此作用对化合物结构及性质的影响。
习题一选择题1.下列化合物含有极性共价键的是()(《无机化学例题与习题》吉大版)A.KClO3B.Na2O2C. Na2OD.KI2.下列分子或离子中键能最大的是()A. O2B.O2-C. O22+D. O22-3. 下列化合物共价性最强的是()(《无机化学例题与习题》吉大版)A.LiIB.CsIC. BeI2D.MgI24.极化能力最强的离子应具有的特性是()A.离子电荷高,离子半径大B.离子电荷高,离子半径小C.离子电荷低,离子半径小D.离子电荷低,离子半径大5. 下列化合物中,键的极性最弱的是()(《无机化学例题与习题》吉大版)A.FeCl3B.AlCl3C. SiCl4D.PCl56.对下列各组稳定性大小判断正确的是()A.O2+>O22-B. O2->O2C. NO+>NOD. OF->OF7. 下列化合物中,含有非极性共价键的离子化合物是()(《无机化学例题与习题》吉大版)A.H2O2B.NaCO3C. Na2O2D.KO38.下列各对物质中,是等电子体的为()A.O22-和O3B. C和B+C. He和LiD. N2和CO9. 中心原子采取sp2杂化的分子是()(《无机化学例题与习题》吉大版)A.NH3B.BCl3C. PCl3D.H2O10.下列分子中含有两个不同键长的是()A .CO2 B.SO3 C. SF4 D.XeF411. 下列分子或离子中,不含有孤电子对的是()(《无机化学例题与习题》吉大版)A. H2OB. H3O+C. NH3D. NH4+12.氨比甲烷易溶于水,其原因是()A.相对分子质量的差别B.密度的差别C. 氢键D.熔点的差别13.下列分子属于极性分子的是()(《无机化学例题与习题》吉大版)A. CCl4B.CH3OCH3C. BCl3D. PCl514.下列哪一种物质只需克服色散力就能使之沸腾( )A.HClB.CH3Cl l4D.NH315.下列分子中,中心原子采取等性杂化的是()(《无机化学例题与习题》吉大版)A. NCl3B.SF4C. CH Cl3D.H2O16.下列哪一种物质既有离子键又有共价键( )A.NaOHB.H2O C.CH3Cl D.SiO217.下列离子中,中心原子采取不等性杂化的是()(《无机化学例题与习题》吉大版)A. H3O+B. NH4+C. PCl6-D.BI4-18.下列哪一种分子的偶极矩最大( )A.HFB.HClC.HBrD.HI19.下列分子中,属于非极性分子的是()(《无机化学例题与习题》吉大版)A.SO2B.CO2C. NO2D.ClO220.下列分子或离子中,中心原子的杂化轨道与NH3分子的中心原子轨道最相似的是()(《无机化学例题与习题》吉大版)A. H2OB. H3O+C. NH4+D. BCl321.下列分子或离子中,构型不为直线形的是()(《无机化学例题与习题》吉大版)A. I3+B. I3-C. CS2D. BeCl222. 下列分子不存在Ⅱ键的是()(《无机化学例题与习题》吉大版)A. COCl2B. O3C.SOCl2D. SO323. 下列分子中含有不同长度共价键的是()(《无机化学例题与习题》吉大版)A. NH3B. SO3C. KI3D. SF424. 下列化合物肯定不存在的是()(《无机化学例题与习题》吉大版)A. BNB. N2H4C. C2H5OHD. HCHO二填空题1.比较大小(《无机化学例题与习题》吉大版)(1)晶格能AlF3AlCl3NaCl KCl(2)溶解度CuF2CuCl2Ca(HCO3) NaHCO32.NO+、NO2、NO2-的几何构型分别是、、、其中键角最小的是。


高二化学选修化学键和晶体结构测试题总分120分时间60分钟2009.9第I卷选择题一、选择题(本题包括6小题,每小题4分,共24分。
每小题只有一个....选项符合题意。
)1.在单质的晶体中,一定不存在A.离子键B.分子间作用力C.共价键D.金属离子与自由电子间的作用2.下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是A.碘和氯化钾B.金刚石和重晶石C.二氧化硅和干冰D.软脂酸甘油酯和冰醋酸3.下列物质中含有离子键的是A.氯化铝B.乙醇C.硫酸D.苛性钠4.下列分子中,所有原子都满足最外层8电子结构的是A.乙炔B.三氟化硼C.五氯化磷D.二硫化碳5.下列关于只含非金属元素的化合物的说法中,正确的是A.一定是共价化合物B.其晶体有可能是离子晶体C.其晶体不可能是离子晶体D.其晶体不可能是原子晶体6.金属具有延展性的原因A.金属原子半径都比较大,价电子较少B.自由电子受外力作用时能迅速传递能量C.金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈的作用D.金属受外力作用变形时,金属阳离子与自由电子间强烈的作用被破坏二.选择题(本题包括10小题,每小题4分,共40分。
每小题有一个或两个..选项).....正确7.下列各组物质中,按熔点由低到高排列正确的是A.O2、I2、Hg B.CO2、KCl、SiO2C.H2S 、H2As、H2O D.SiC、NaCl 、SO28.下列关于NaHSO4的说法中正确的是A.NaHSO4固体是离子晶体B.NaHSO4晶体中阳离子和阴离子的个数是2:1C.NaHSO4晶体熔化时破坏的是离子键和共价键D.NaHSO4的水溶液中有两种阳离子O。
下9.(无锡市二模)我国科学家成功地研制出一种长期依赖进口、价格昂贵的物质1882列说法正确的是A .它是O 3的一种同素异形体B .它是1682O 的同分异构体C .1882O 与1682O 互为同位素D .1mol 1882O 分子中含有20mol 电子10.短周期的三种元素X 、Y 、Z 位于同一周期,它们的最高价氧化物的水化物分别为HXO 4、H 2YO 4、H 3ZO 4,下列判断中不正确...的是 A .元素的非金属性:X >Y >Z B .阴离子的还原性:X <Y <ZC .气态氢化物的稳定性:X >Y >ZD .最高价氧化物的水化物的酸性:Z >Y >X11.KO 2的晶体结构和NaCl 相似,可以看作是Na +的位置用K +代替,Cl —的位置用O 2—代替,下列对KO 2的晶体结构的描述错误的是A .和K +距离相同且最近的O 2—共有8个B .和K +距离相同且最近的K +共有12个C .和K +距离相同且最近的O 2—构成的多面体是正八面体D .和K +距离相同且最近的O 2—构成的多面体是正六面体12.(南通一模)下列有关晶体的说法正确的是A .金属晶体是由金属离子间的相互作用形成的B .冰熔化时,水分子中的共价键发生断裂C .白磷为分子晶体,分子结构为正四面体,其键角为109°28′D .固体不导电,但熔融状态下和溶于水能导电不可能是分子晶体的性质13、下列说法正确的是A .极性分子可能是离子化合物,也可能是共价化合物。
晶体结构与性质单元测试出题人:陈冰测试时间:120分钟可能用到的原子量:H:1 C;12 N:14 O:16 Na:23第Ⅰ卷(选择题共60分)一、选择题(本题包括15小题,每小题3分,共45分。
每小题只有一个....选项符合题意。
)1.下列化学式能真实表示物质分子组成的是A.NaOH B.SO3C.CsCl D.SiO22.下列晶体中不属于原子晶体的是A.干冰B.金刚砂C.金刚石D.水晶3.支持固态氨是分子晶体的事实是A.氮原子不能形成阳离子B.铵离子不能单独存在C.常温下,氨是气态物质D.氨极易溶于水4.下列分子晶体:①HCl ②HBr ③HI ④CO ⑤N2⑥H2熔沸点由高到低的顺序是A.①②③④⑤⑥B.③②①⑤④⑥C.③②①④⑤⑥D.⑥⑤④③②①5.下列的晶体中,化学键种类相同,晶体类型也相同的是A.SO2与SiO2B.CO2与H2OC.NaCl与HCl D.CCl4与KCl6.固体熔化时,必须破坏非极性共价键的是A.冰B.晶体硅C.溴D.二氧化硅7.当SO3晶体熔化或气化时,下述各项中发生变化的是A.分子内化学键B.核外电子总数C.分子构型D.分子间作用力8.已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合,下列关于C3N4晶体的说法正确的是A.C3N4晶体是分子晶体B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子D.C3N4晶体中微粒间通过离子键结合9.下列各项所述的数字不是6的是A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl- 的个数B.在金刚石晶体中,最小的环上的碳原子个数C.在二氧化硅晶体中,最小的环上的原子个数D.在石墨晶体的片层结构中,最小的环上的碳原子个数10.六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。
2021新高考化学二轮配套练习题:专题限时集训6 分子结构(含化学键)与晶体结构及其性质含解析专题限时集训(六)分子结构(含化学键)与晶体结构及其性质(限时:45分钟)1.下列叙述错误的是()A.C2H4分子中有π键B.CH4的中心原子的杂化方式为sp3杂化C.HCl和HI化学键的类型和分子的极性都相同D.键角:CH4〈NH3<H2OD[杂化类型相同时,孤电子对越多,键角越小,D项错误.]2.(2020·济宁模拟)下列说法正确的是()A.甲醛(HCHO)和光气(COCl2)分子中:键角∠H—C—H 〈∠Cl—C—ClB.基态氮原子的价电子排布图:C.3p x所代表的含义是:第三电子层沿x轴方向伸展的p轨道D.四硼酸根离子X m-(含B、O、H)的球棍模型如图,配位键存在于4、5和4、6原子之间C[H的电负性比Cl小,HCHO中H—C的共用电子对比COCl2中Cl-C的共用电子对靠近碳原子,H—C中C的两对成键电子对排斥力大,键角大,故键角∠H—C—H>∠Cl—C—Cl,A 项错误;B项所示价电子排布图违反了洪特规则,正确的价电子排布图是,B项错误;能级前的数字代表能层,p 能级有x、y、z三个不同伸展方向的轨道,C项正确;4号B原子形成4个化学键,其中包括3个共价键和1个配位键,即4、5号原子之间为配位键,其他为共价键,D项错误。
]3.下列有关微粒性质的排列顺序错误的是()A.GeX4(X表示Cl、Br或I)为分子晶体,熔沸点:GeCl4<GeBr4〈GeI4B.共价键的极性:H2O2〉CO2〉NOC.还原性:H2O<H2S〈H2SeD.中心原子的孤电子对数:BeCl2<H2S<OF2D[A项,GeX4(X表示Cl、Br或I)为分子晶体,GeCl4、GeBr4、GeI4结构相似,随相对分子质量增大,分子间作用力增大,熔沸点为GeI4〉GeBr4〉GeCl4,正确;B项,两元素电负性差值越大,形成共价键的极性越强,正确;C项,非金属性O>S〉Se,还原性H2Se>H2S〉H2O,正确;D项,BeCl2、H2S、OF2的中心原子分别为Be、S、O,孤电子对数S与O相等,错误.]4.下列说法不正确的是()A.NH4F的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既具有离子键又具有共价键的离子化合物B.Na2O是离子晶体,其溶于水生成NaOH的过程中既有离子键的断裂又有共价键的形成C.AlCl3的二聚体Al2Cl6的结构式为,其中Al原子的杂化方式为sp3杂化D.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对D[NH4F由F-和NH错误!构成,故NH4F中既有离子键又有共价键,A项正确;Na2O是离子化合物,其溶于水生成NaOH的过程中,Na2O中离子键断裂,生成NaOH时有共价键形成,B项正确;AlCl3的二聚体Al2Cl6的结构式为,其中每个铝原子参与形成三个共价键、一个配位键,故Al原子的杂化方式为sp3杂化,C项正确;杂化轨道可用于形成σ键和容纳未参与成键的孤电子对,不能用于形成π键,D项错误。
晶体结构测试题(答案另附)晶体结构测试题廖显威教授(Ⅰ)0 1.设有一AB型晶体,晶胞参数是a=b=3.98A,c=3.72A,α=β=γ=90℃,一个晶胞中有两个A,其坐标是(0,0,0),①该晶体属于什么晶系?11(,,0)22,已知晶胞中一个B的坐标是11(0,,)22。
②属于什么格子?③一个晶胞中含有几个B?晶胞中另外一些B原子的坐标能否确定,写出其坐标,若不能确定,说明其理由。
2.铜有一种氧化物,其晶胞结构可描述如下:A原子占据立方体的顶点及体心,而在每间隔一个小立方体的中心处放上一个B原子。
①说明A与B各代表什么原子,并写出该氧化物的分子式。
②该晶体的晶格型式为何?结构基元是什么?一个晶胞中有几个结构基元?③Cu原子和氧原子的配位数各是多少?④已知晶胞参数a=4.26A,计算Cu原子间,O原子间及铜氧原子间的最近距离。
3.金属钋晶体是简单立方晶格结构,按紧密堆积原理,计算晶体中空隙体积的百分数。
4. 在CaF2 和六方ZnS 晶体中,正离子占据什么空隙?正离子占据空隙的百分率为多少?5. 某黄铜中Cu 和Zn 的摩尔分数分别是0.75 和0.25,该合金的结构跟纯铜相同(立方最密堆积),只是Zn 原子统计的无序取代了Cu 原子。
在每个原子的位置上,Cu 和Zn 的占有率正比于合金的组成,即合金可以看作是由Cu0.75Zn0.25 组成的。
已知合金的密度为8.51g/cm 3,计算合金的统计原子半径。
(相对原子质量:Cu 63.5 ,Zn 65.4)(第26 届Icho 竞赛试题)6. 设有一AB 4 型晶体,属立方晶系,每个晶胞中有一个 A 和四个B,一个 A 的坐标是1 1 1 ( , , )2 2 2 ,四个 B 原子的坐标是1 1 1 1 1 1(0,0,0),( , ,0),( ,0, ),(0, , )2 2 2 2 2 2,此晶体的晶格型式为何?7. 某一立方晶系晶体,晶胞参数的顶点位置全为 A 占据,面心为B 占据,体心为原子C 占据。
无机材料科学基础自测题3晶体结构与缺陷第3章晶体结构与晶体缺陷一、选择题1、金红石晶体中,所有O2-作稍有变形的立方密堆排列,Ti4+填充了(d)。
A 全部四面体空隙B全部八面体空隙 C 1/2四面体空隙 D 1/2八面体空隙2、SiO2晶体中有(a)种晶型之间的转变属于重建型转变A 3B 4C 53、萤石(CaF2)结构中[CaF8]立方体之间是( B )相连的。
A 共顶B 共棱C 共面4、滑石(3MgO·4SiO2·H2O)和高岭土(Al2O3·2SiO2·2H2O)分别属于(b )层状结构的硅酸盐矿物。
A 1:1和2:1B 2:1和1:1 C3:1 和2:15、(c )相同是形成连续固溶体的必要条件。
A 离子大小B 极化性质C 晶体结构6、Fe1-x O是由于存在(B )而形成非化学计量化合物。
A 间隙原子B 负离子过剩C 正离子过剩7、非化学计量化合物MO2-x中存在氧空位,在电场作用下形成( c )。
A 绝缘体B 孔穴导电C 电子导电8、如果减少周围氧气的分压,Zn1+x O的密度将( b )。
A 变小B 增大C 不变9、在UO2晶体中,O2-的扩散是按(C )机制进行的。
A 搀杂点缺陷B 空位C 间隙10、TiO2在还原气氛中可形成()型非计量化合物。
A 阳离子填隙B 阳离子空位C 阴离子填隙D阴离子空位11、TiO2在还原气氛中可形成()型半导体。
A p型B n型12、若有一个变价金属氧化物XO,在还原气氛下形成阴离子缺位型非化学计量化合物,其中金属元素X与氧原子数之比为X:O=1.1:1,则其化学式应为()。
A X1.1OB XO0.90C XO0.91D XO1.1二、判断题1、MgO不可以生成填隙型固溶体()。
2、热起伏可以使离子晶体中生成肖特基缺陷()。
3、置换型固溶体有可能是连续固溶体()。
4、晶体的位移型转变通常是很快的晶型转变()。
第6、7章化学键与分子结构、晶体结构自测题
一、单选题
1.既存在离子键和共价键,又存在配位键的化合物是()
(A)H3PO4(B)Ba(NO3)2(C)NH4F (D)NaOH
2.下列化合物中,中心原子不服从八隅体规则的是()
(A)OF2(B)SF2(C)PCl3(D)BCl2
3.下列各物质中,那一个的化学键的极性最大()
(A)NaCl (B)MgCl2(C)AlCl3(D)SiCl4
4.下列原子轨道沿x键轴重叠时,能形成σ键的是()
(A)p x-p x(B)p y-p y(C)p x-p z(D)s-d z2
5.下列原子轨道沿x键轴重叠时,能形成π键的是()
(A)p x-p x(B)p y-p z(C)p y-p y(D)p x-p y
6.下列各个答案中,可能不存在的硫的化合物是()
(A)SF2(B)SF4(C)SF3(D)SF6
7.下列分子中,中心原子采取不等性sp3杂化的是()
(A)BF3(B)BCl3(C)OF2(D)SiCl4
8.用价层电子对互斥理论判断,下列分子或离子中,空间构型为平面正方形的是()(A)CCl4(B)SiF4(C)NH4+(D)ICl4-
9.下列分子中,键和分子均具有极性的是()
(A)Cl2(B)BF3(C)CO2(D)NH3
10.下列分子中,偶极矩为零的是()
(A)BF3(B)NF3(C)PF3(D)SF4
11. 乙炔分子(C2H2)中,碳原子采取的是()
(A)sp2杂化(B)等性sp3杂化(C)sp杂化(D)不等性sp3杂化
12. 下列物质中,只需克服色散力就能沸腾的是()
(A)CCl4(B)CHCl3 (C)CH3Cl (D)H2O
13. 水具有反常的高沸点是由于存在着()
(A)氢键(B)取向力(C)共价键(D)孤电子对
14. 根据杂化轨道理论,H2S分子的杂化方式是()
(A)sp等性杂化(B)sp2不等性杂化(C)sp3等性杂化(D)sp3不等性杂化15. 下列那种化合物中实际上没有氢键?()
(A)H3BO3(B)C2H6(C)N2H4(D)都没有氢键
二、填空题
1.形成配位键时,中心原子应具备的条件是配位体应具备的条件是。
2.磷可以形成PCl5分子是由于磷属于第3周期元素,其主量子数n=3,杂化时可动用轨道,形成杂化轨道,分子的空间构型是。
3.ClF3分子中,中心原子Cl的杂化轨道是,分子的空间构型是。
4.物质NH3、H3BO3、HNO3、C2H5OH、C6H6中,具有氢键的物质是,这些物质的氢键的类型分别为。
5.在共价化合物中,键的极性大小与的差值有关,分子极性的大小可由的大小来量度。
6. PCl3分子,中心原子采取杂化,其几何构型为,偶极
矩。
7. 在非极性分子之间存在的分子间力为力,而在极性分子之间存在着、
和力。
8. 邻硝基苯酚的熔、沸点比对硝基苯酚的熔、沸点,这是由于邻硝基苯酚存在,而对硝基苯酚存在。
这两种异构体中,较易溶于水。
三、问答题
1.指出下列各分子中各个C原子所采用的杂化轨道。
CH4、C2H2、C2H4、H3COH、CH2O
2. 写出下列分子中心原子所采用的杂化轨道:
CS2、BF3、CBr4、
3. 写出下列离子中心原子所采用的杂化轨道:
PF4+、NO2+、NO3-、AlF63-、IF6+。
4. 为什么存在H3O+和NH4+而不存在CH5+?为什么存在SF6而不存在OF6?
5.用价层电子对互斥理论,说明XeF4、XeO4、XeO3、XeF2、XeOF2、XeOF4的分子形状。
6.已知在AB5、AB4、AB3、AB2 4种化合物的分子中,中心原子的电子对数都是5,而孤对电子数分为0,1,2,3,按价层电子对互斥理判断它们的几何构型。
7. 对于下列分子和离子:CO2、NO2+、NO2、NO2-、SO2、ClO2
判断它们的形状,指出每个分子或离子的不成对电子数,指出中性分子的极性。
8.写出O2,O+2,O-2,O2-2的键级,键长长短次序及磁性。
9.写出第二周期同核双原子分子的分子轨道表示式,其中哪些分子不能存在?比较各分子的稳定性和磁性
10.在AB型分子:N2、NO、O2、C2、F2、CN、CO中,哪几个得电了变为AB-离子时比AB分子的键能大?哪几个失去电子变为AB+离子时,比AB分子的键能大?
四、综合题
A、B两元素分别位于第二周期和第三周期,其价电子数分别是4和7。
A和B可形成常温下是液体的共价化合物AB4。
(1)写出A、B两元素的名称。
(2)推测分子AB4中A的杂化类型及A与B之间的共价键类型。
(3)推测分子AB4的空间构型及分子的极性。
(4)AB4在常温下的物理状态及该化合物分子间存在什么作用力?。