元素周期表(可编辑格式)
- 格式:xls
- 大小:68.00 KB
- 文档页数:6

元素周期表中各元素介绍氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:氕、氘、氚。
氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米?/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。
在高温下,氢是高度活泼的。
除稀有气体元素外,几乎所有的元素都能与氢生成化合物。
非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
氦,原子序数2,原子量4.002602,为稀有气体的一种。
元素名来源于希腊文,原意是“太阳”。
1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。
后有人用无机酸处理沥青铀矿时得到一种不活泼气体,1895年英国科学家拉姆赛用光谱证明就是氦。
以后又陆续从其他矿石、空气和天然气中发现了氦。
氦在地壳中的含量极少,在整个宇宙中按质量计占23%,仅次于氢。
氦在空气中的含量为0.0005%。
氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上全是氦4。
氦在通常情况下为无色、无味的气体;熔点-272.2°C(25个大气压),沸点-268.9°C;密度0.1785克/升,临界温度-267.8°C,临界压力2.26大气压;水中溶解度8.61厘米?/千克水。

第2课时元素周期表基础过关练题组一元素周期表的结构1.(原创)“中国紫”——硅酸铜钡(BaCuSi2O6)被认为是人工制造的。
这种紫色颜料在自然界中还未被发现,而秦始皇陵兵马俑是已知的有确切出土地点和年代的最早使用它的实物。
其中不属于短周期元素的是( )A.Ba和CuB.Ba和SiC.Cu和OD.Si和O2.(2020北京西城高一期末)下列元素中,属于第三周期的是( )A.氢B.碳C.氧D.氯3.(2019天津静海一中高一下月考)下列说法中正确的是( )A.元素周期表中元素排序的依据是元素的相对原子质量B.元素周期表中元素排序的依据是原子的质量数C.元素周期表有十六个纵列,也就是十六个族D.在元素周期表中,从ⅢB族到ⅡB族的10个纵列中,所有的元素都是金属元素4.(2019河北辛集中学高一下第一次阶段考试)“嫦娥一号”的四大科学目标之一是探测下列14种元素在月球上的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于短周期元素的有( )A.5种B.7种C.8种D.9种5.下列各图若为元素周期表的一部分(表中数字代表原子序数),其中合理的是( )6.下列关于元素周期表的叙述,错误的是( )A.镁是第ⅡA族元素B.第ⅠA族元素全部是金属元素C.氧族中含金属元素D.第三周期中既有金属元素又有非金属元素7.(2019河北邯郸高一下月考)无机化学命名委员会在1989年作出决定,把长式元素周期表原先的主、副族及族号取消,由左到右改为18列。
按此规定,下列说法中错误的是( )A.第15列元素的最高价氧化物的化学式是R2O3B.第17列元素自上而下单质熔、沸点逐渐升高C.第11列中肯定没有非金属元素D.在18列元素中,第3列的元素种类最多题组二元素周期表在元素推断中的应用8.元素X的原子有3个电子层,最外电子层上有4个电子。
则X元素位于周期表的( )A.第四周期ⅢA族B.第四周期ⅦA族C.第三周期ⅣB族D.第三周期ⅣA族9.A、B、C、D为短周期元素,在周期表中所处的位置如下图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数。
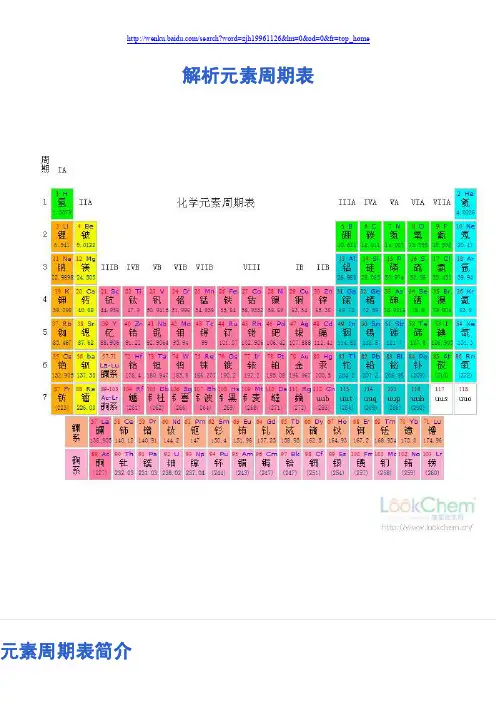
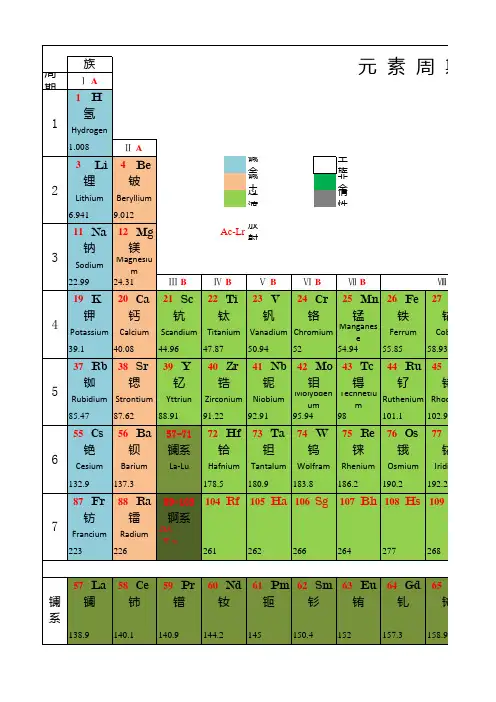
解析元素周期表元素周期表简介化学元素周期表元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,后来又经过多名科学家多年的修订才形成当代的周期表。
元素周期表中共有118种元素。
每一种元素都有一个编号,大小恰好等于该元素原子的核内电子数目,这个编号称为原子序数。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。
共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
化学元素周期表口诀A、按周期分:第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老把银哥印西堤碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 很简单了~就是---- 防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
教学设计一、导入新课,明确目标1、复习提问,检测上节课知识(1)原子是不是一个实心体?(2)原子内还有哪些微粒?2、导入:(展示)某品牌矿泉水标签上标明本品含:硒:0.013,锶0.0596…(单位mg/L)。
这里的硒、锶等是指元素、原子、还是…?3、出示学习目标,同学齐读,理解。
二、自主预习梳理新知1、根据元素的原子结构和性质,把现在已知的一百多种元素按科学有序地排列起来,这样得到的表叫元素周期表。
2、元素周期表的结构:(1)每一格:在元素周期表中,每一种元素均占据一格。
对于每一格,均包括、、、等内容。
此外在周期表中,还用不同的颜色对和做了区分。
(2)每一横行:周期表每一横行叫做一个周期,共有个横行,有个周期。
(3)每一纵行:周期表的个纵行中,除第8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫做一个族,共有个族。
三、合作探究生成能力目标导学一:元素教师利用多媒体,介绍几种原子我们把质子数都是6的一类原子叫做碳元素,而质子数都是8的一类原子叫做氧元素等等。
(1)定义:具有相同核电荷数的一类原子的总称[思考]怎样区分氢元素和氧元素?[归纳]元素的种类是由核内质子数决定的。
也就是说质子数不同,元素的种类就不同。
(2)特点:元素是一类原子的总称,是宏观概念,只讲种类,不讲个数。
[讲解]由定义可知,元素是一类原子的总称,具体说就是具有相同核电荷数的一类原子的总称。
是宏观概念,只讲种类,不讲个数。
那么在用元素描述物质的组成时,只能说该物质由几种元素组成,而不能说该物质由几个元素组成。
(3)元素在自然界中的存在。
[过渡]物质的种类很多,但组成物质的元素种类并不多,到目前为止,发现的元素种类仅一百多种。
它们在地壳、生物细胞(包括人体中)、海水、空气中的含量分别是多少呢?[分析]在地壳中,含量最多的元素顺序为:氧、硅、铝、铁。
1.表示4个氢原子的符号是()A. 4H2 B 4H C. 2H2 D.H42.“博士伦”隐形眼镜洗液的主要成分是H202(双氧水),下列说法正确的是()A.H202是由氢气和氧气组成的B.H202是由氢元素和氧元素组成的C.H202是由氢分子和氧分子构成的D.H202是由两个氢元素和两个氧元素构成的3.“H-2”的说法中,正确的是()A.属于一种新元素B.跟氢原子相同的原子C.是氢元素的另一种原子D.与氢元素不同类的原子4.连线:⑴纯净物 A.由同种元素组成⑵混合物 B.由不同种物质组成⑶化合物 C.分子中含有不同种元素的原子⑷单质 D.由一种物质组成⑸氧化物E.由两种元素组成,其中一种是氧元素5.下列各组元素符号的第一个字母相同的是()A.铁、锌、钠B.钙、铝、铜C.铝、银、镁D.碳、钙、氯。

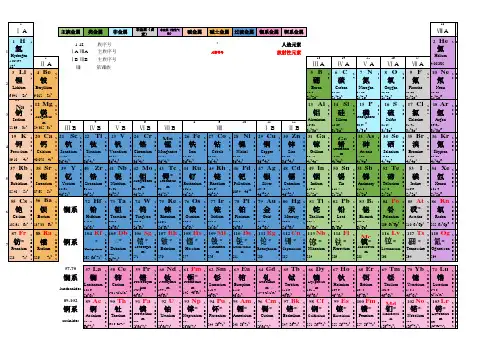
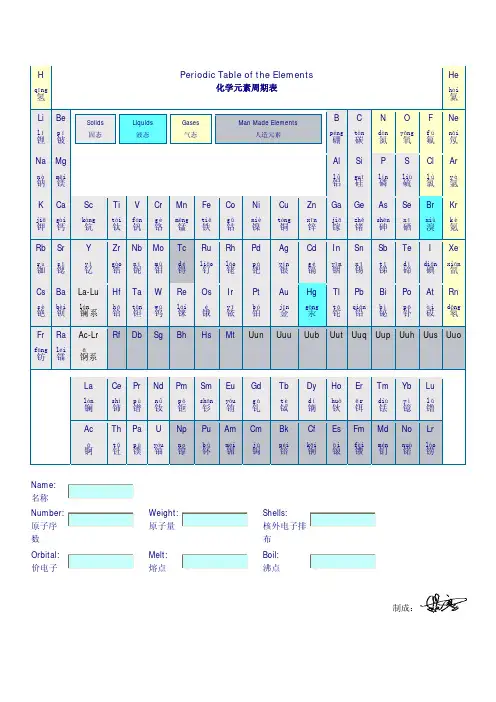
Excel 实验指导-制作元素周期表元素周期表有7个周期、16个族和4个区,元素在周期表中的位置能反映该元素的原子结构。
下面例子主要运用公式、合并单元格和插入形状等功能,来制作元素周期表和查询、测试元素属性表。
本例还运用了添加边框样式和设置填充颜色等功能来美化工作表。
本实例共分两部分:第一部分:元素周期表1.实验目的●合并单元格●插入形状●设置填充颜色2.操作步骤(1)在“周期表”工作表中,分别输入元素、原子结构等一些相应内容。
并设置A1单元格的【对齐方式】为“文本右对齐”,如图9-57所示。
图9-5Excel 输入元素周期数据提示新建空白工作薄,将Sheet1工作表标签【重命名】为“周期表”。
重命名单击执行(2)分别选择A 列和B 列至AK 列,在【单元格】组中的【格式】下拉列表中,执行【列宽】命令。
并在弹出的【列宽】对话框中输入Excel 75和3,如图9-58所示。
图9-5Excel 设置列宽(3)依照相同方法,执行【格式】下拉列表中的【行高】命令,并设置第1行至第21行的行高为15,如图9-59所示。
图9-59 设置行高(4)在B1至AK1单元格区域中,将B1至C1单元格区域合并后居中。
依照相同方法,分别将该区域中其他的单元格区域合并后居中,如图9-60所示。
图9-60 合并单元格提 示 设置A1至AK1单元格区域的【字体颜色】为“深红”,并单击【加粗】按钮。
(5)依照相同方法,在A3至AK21单元格区域中,选择相应的单元格区域,并设置为“合并后居中”。
然后将该区域中其他单元格中的内容居中显示,如图9-61所示。
图9-61 合并单元格(6)在【插图】组中的【形状】下拉列表中,选择【线条】栏中的直线形状,并在A执行输入执行输入单击单击单击1至A2单元格区域中绘制该形状。
然后设置其【形状轮廓】为“黑色,文字1”,如图9-62所示。
图9-6Excel 插入线条形状提示选择形状,在【形状样式】组中的【形状轮廓】下拉列表中,选择【黑色,背景1】色块。
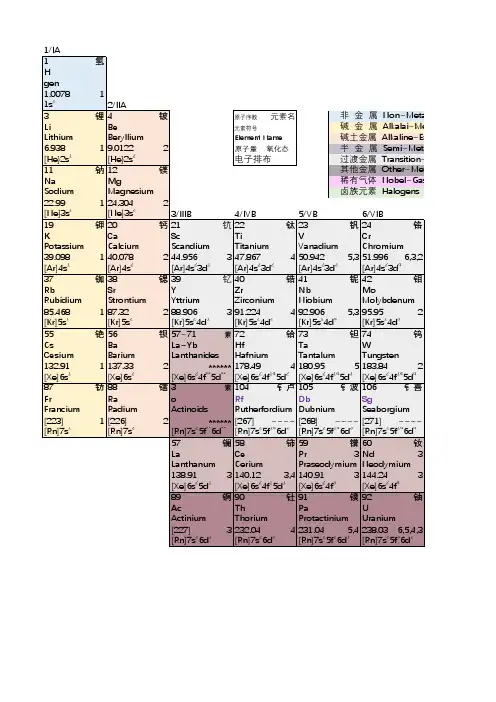
H氢qīngPeriodic Table of the Elements化学元素周期表He氦hàiLi锂l ǐBe铍p íSolids 固态Liquids 液态Gases 气态Man Made Elements人造元素B硼péngC碳tànN氮dànO氧yǎngF 氟f úNe氖nǎiNa 钠n àMg 镁měiAl 铝l ǚSi硅guīP磷línS硫liúCl 氯l ǜAr氩y àK钾jiǎ Ca钙gàiSc钪kàngTi钛tàiV钒fánCr 铬g èMn锰měngFe铁tiěCo 钴g ǔNi镍nièCu铜tóngZn锌xīnGa镓jiāGe锗zhěAs砷shēnSe 硒x īBr溴xiùKr 氪k èRb 铷r úSr 锶s īY 钇y ǐZr 锆gàoNb 铌n íMo钼m ùTc 锝d éRu钌liǎoRh铑lǎo Pd 钯p áAg银yínCd 镉g éIn铟yīnSn 锡x īSb 锑t īTe 碲d ìI碘diǎnXe氙xiān Cs 铯s èBa 钡bèi La-Lu镧lán系Hf 铪h āTa 钽tǎnW 钨w ūRe铼lái Os 锇éIr 铱y īPt 铂b ó Au金jīnHg汞gǒng Tl铊t āPb铅qiānBi 铋b ìPo 钋p ōAt 砹àiRn氡dōngFr 钫fāng Ra镭léiAc-Lr 锕ā系 Rf Db Sg Bh HsMtUunUuu Uub Uut Uuq Uup Uuh Uus UuoLa镧lán Ce铈shìPr镨p ǔNd 钕n ǚPm 钷p ǒSm钐shānEu铕yǒuGd 钆g áTb 铽t èDy 镝d íHo钬huǒEr 铒ěrTm铥diūYb 镱y ìLu 镥l ǔAc 锕āTh 钍t ǔPa 镤p úU铀yóuNp 镎n áPu 钚b ùAm镅méiCm 锔j ūBk锫péi Cf锎kāi Es 锿āiFm镄fèi Md钔ménNo锘nuòLr铹láo Name: 名称Number: 原子序数 Weight: 原子量 Shells: 核外电子排布Orbital: 价电子 Melt: 熔点Boil: 沸点制成:。

化学元素周期表之歌化学元素周期表口诀规律!一、原子半径同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减; 同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
二、主要化合价(最高正化合价和最低负化合价)同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外;最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。
元素最高价的绝对值与最低价的绝对值的和为8 三、元素的金属性和非金属性同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减; 四、单质及简单离子的氧化性与还原性同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。
同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱。
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。
五、最高价氧化物所对应的水化物的酸碱性同一周期中,从左到右,元素最高价氧化物所对应的水化物的酸性增强(碱性减弱); 同一族中,从上到下,元素最高价氧化物所对应的水化物的碱性增强(酸性减弱)。
六、单质与氢气化合的难易程度同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易; 同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难。
七、气态氢化物的稳定性同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强; 同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱。
此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充:随着从左到右价层轨道由空到满的逐渐变化,元素也由主要显金属性向主要显非金属性逐渐变化。