配位滴定教案模板
- 格式:doc
- 大小:248.50 KB
- 文档页数:8

配位滴定法【要求】1.熟悉配位平衡的副反应系数,明确条件形成常数的概念。
2.掌握EDTA滴定法的基本原理并能正确选择滴定的pH条件。
3.熟悉常用金属指示剂的选择及EDTA法的应用范围。
4.了解EDTA滴定的方式。
【内容】一、概述配位滴定法是以配位反应为基础的滴定分析,通常所说的配位滴定法主要是指以EDTA为滴定剂,滴定金属离子(M)的方法。
二、EDTA与金属离子的反应大都以1:1的计量关系进行,形成配合物稳定,其反应为M+Y=MY,平衡常数[][][]YMMY MY=K三、EDTA配位反应平衡在EDTA水溶液中总浓度为C Y,其中[Y]称为EDTA 的有效浓度。
当pH值降低,使[Y]降低,不利于生成MY,这种现象称为酸效应。
由于其它配体存在,使[M]降低,不利于生成MY,这种现象称为配位效应。
两种效应的大小可分别用副反应系数来衡量αγ=Cγ/[Y],可查表得αγ[H]。
α[M]=C M/[M]可根据其它配体的浓度及其与金属离子的稳定常数计算。
条件稳定常数K′MY是指在各种副反应存在的情况下,经酸效应和配位效应等副反应系数校正后的稳定常数,在一定条件下为常数K′MY=KMY/αγ•αM四、滴定曲线与酸碱滴定曲线相类似,影响pM突跃范围的主要因素是K′MY和金属离子的分析浓度C。
通常将logC•K′MY≥6作为准确滴定的条件(相对误差±0.1%)五、金属离子指示剂以符号In表示。
其本身具有颜色,当与M形成MIn 配合物时,形成另一种颜色。
其变化过程是:滴定前加入指示剂M+In=MIn(A 色)。
滴定时M+Y=MY,终点时MIn+Y=MY+In(B色)。
指示剂必需具备两个条件:即MI n与I n的颜色应有明显的区别;MI n的稳定性要符合K′MIn≥104,K′MY/K′MIn≥102,若K′Min<104,终点易提前;若KMIn>KMY则终点及至终点后指示剂不变色,称为指示剂的封闭现象。



第八章配位化合物与配位滴定第八章配位化合物与配位滴定第一节配位化合物一、配位化合物的定义配位化合物(简称配合物,也称络合物)是指独立存在的稳定化合物进一步结合而成的复杂化合物。
例:[Cu(NH3)4]SO4是由一个Cu2+和四个NH3分子组成的独立基团。
特点:1.在结构中都包含有中心离子和一定数目的中性分子或阴离子相结合而成的结构单元,此结构单元表现出新的特征。
2.在配位化合物中中心离子或阴离子或中性分子通过形成配位共价键而结成独立的结构单元。
配位化合物的定义:由中心离子(或原子)和一定数目的中性分子或阴离子通过形成配位共价键相结合而成的复杂结构单元称配位单元,凡是由配位单元组成的化合物称配位化合物。
若配位单元带电荷称配离子,如[Ag(CN)2]-,配离子与带相反电荷的离子组成中性配合物。
若配位单元不带电荷,则配位单元本身就是配合物,如Fe(CO)5另外,必须指出有一类叫复盐的化合物,如KCl·MgCl2·6H2O、KAl(SO4)2·12H2O无复杂离子和复杂的配位单元,不是配合物。
二、配合物的组成配合物在组成上一般包括内界和外界两部分。
中心体(离子或原子)内界配合物配体(单齿或多齿配体)外界现以[Cu(NH3)4]SO4为例说明配合物的组成。
内界外界[ Cu (NH3) 4 ]2+ SO42-中配配配外心位位位界离原体数离子子子组成:配合物的组成由外界离子、配体、中心离子(或原子)构成。
1.中心离子(或原子)也叫形成体,它位于配合物的中心,一般是金属离子,以过渡态金属离子最常见,也有中性原子或高氧化态的非金属元素。
如:Fe(CO)5中的Fe为形成体,是原子。
[PF6]-中的P是形成体,非金属元素。
作为中心离子的条件是:必须具有空的价电子轨道,可以接受配体所给予的孤对电子。
周期表中绝大多数元素可作为中心离子,常见的一些过渡元素如铁、铜、银、金、锌、汞、铂等元素的离子或原子,它们具有(n-1)d、ns、np、nd等的空的价电子轨道,都是强的形成体。


第十二章配位滴定法§12-1 概述配位滴定法是以配位反应为基础的滴定分析方法。
它是用配位剂作为标准溶液直接或间接滴定被测物质。
在滴定过程中通常需要选用适当的指示剂来指示滴定终点。
本章重点介绍以乙二胺四乙酸(EDTA)为滴定剂的配位滴定分析方法。
一、配位滴定剂(EDT A)大多数金属离子都能与多种配位剂形成稳定性不同的配合物,但不是所有的配位反应都能用于配位滴定。
能用于配位滴定的配位反应除必须满足滴定分析的基本条件外,还能生成稳定的、可溶于水的中心离子与配体比例恒定的配合物。
由多基配体与金属离子形成的具有螯合环结构的配合物称为螯合物。
螯合物稳定性高,螯合比恒定,能满足滴定分析的基本要求。
目前应用最多的滴定剂是乙二胺四乙酸等氨羧有机配位体,它们能与大多数的金属离子形成稳定的可溶的螯合物,能满足配位滴定的要求。
因此配位滴定法主要是指形成螯合物的配位滴定法。
乙二胺四乙酸简称EDTA,或EDTA酸,常用H4Y表示。
其结构式为:在水溶液中,乙二胺四乙酸两个羧基上的质子转移到氮原子上,形成双偶极离子:在酸度较高的溶液中,H4Y的两个羧基可再接受两个H+而形成H6Y2+,这样它就相当于一个六元酸,有六级离解平衡。
H4Y在水中的溶解度低(22 0C时每100ml水溶解0.02g),所以常用的是其二钠盐Na2H2Y·2H2O,(也称EDTA)作为滴定剂。
它在水溶液中的溶解度较大,22 0C时每100ml水可溶解11.2g,此时溶液的饱和浓度约为0.3mol·L-1,pH值约为4.4。
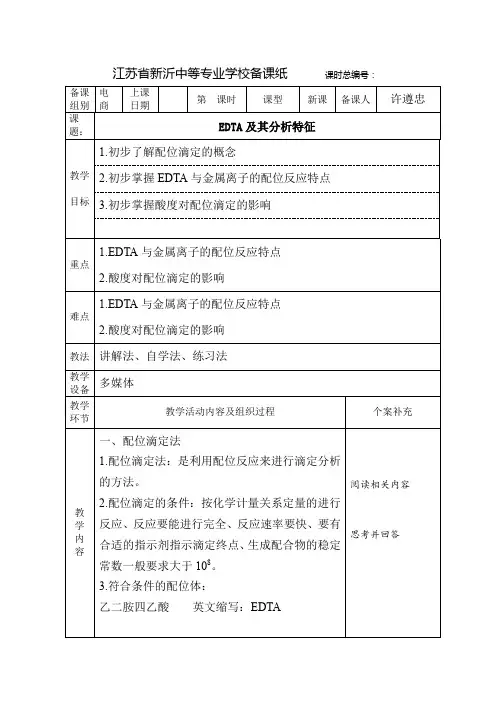
在水溶液中,EDTA有H6Y2+、H5Y+、H4Y、H3Y-、H2Y2-、HY3-、Y4-七种型体存在,但是在不同的酸度下,各种型体的浓度是不同的,他们的浓度分布与溶液pH的关系如图12-1所示。
由图可见,在pH<1的强酸性溶液中,EDTA主要以H6Y2+型体存在;在pH为2.67~6.16的溶液中,主要以H2Y2-型体存在;在pH>10.26的碱性溶液中,主要以Y4-型体存在。
江苏省新沂中等专业学校备课纸课时总编号:江苏省新沂中等专业学校备课纸课时总编号:江苏省新沂中等专业学校备课纸课时总编号:江苏省新沂中等专业学校备课纸课时总编号:江苏省新沂中等专业学校备课纸课时总编号:江苏省新沂中等专业学校备课纸课时总编号:江苏省新沂中等专业学校备课纸课时总编号:江苏省新沂中等专业学校备课纸课时总编号:=0.2000×29.73×10-3×1/2×56.08/0.4090 =40.76%例5-6:溴量法测定苯酚的含量。
结论:1/6KBrO3~1/2Br2~1/2I2~S2O32-~1/6苯酚教师指导学生阅读教材相关内容,并求出结果。
三、课堂小结(略)四、作业1.P154 T162.P155 T18(不求滴定度)江苏省新沂中等专业学校备课纸课时总编号:江苏省新沂中等专业学校备课纸课时总编号:18化工《酸碱滴定法》单元测试姓名_____________ 得分_______________一、选择题(每题只有一个正确答案,每题3分,共30分)1.滴定分析反应进行完全的标志是()。
A:被测组分100%转化成生成物B:被测组分99.9%转化成生成物C:被测组分:99.99%转化成生成物D:被测组分99.8%转化成生成物2.硫酸的摩尔质量时98.08g/mol,则它的基本单元的摩尔质量时()A:98.08g/mol B:48.04g/mol C:98.08 D:48.043. 50mL的滴定管的最小分度值是0.1mL,可以估读到()mL。
A:0.1 B:0.01 C:0.001 D:0.00014.求0.01mol/L的氢氧化钠溶液的PH=()。
A:1 B:2 C:12 D:135. HAc的PKa=4.76,则由0. 1mol/L的NaAc和0. 1mol/L HAc所组成的缓冲溶液的缓冲范围是()。
A:3.76-4.76 B:4.76-5.76 C:3.76-5.76 D:无法确定6.甲基橙指示剂的变色范围是()A:2.9-4.1 B:3.0-4.4 C:3.1-4.4 D:4.4-6.27.弱酸可以用强碱直接滴定的条件是()A:C a K a≥10-8B:C a K a≥10-9C:C a K a≥10-6 D:C a K a≥10-78.弱酸强碱盐可以用强酸直接滴定的条件是()A:K a≤10-8B:K a≤10-7C:K a≤10-6D:K a≤10-59.用盐酸标准溶液滴定氢氧化钠和碳酸钠的混合液达到第一化学计量点时,消耗盐酸的体积是V1,达到第二化学计量点时,消耗盐酸的体积是V2,则下列V1和V2的大小关系中,正确的是()。

第五章配位滴定法教学目的、规定:掌握配位反映中副反映系数的计算和条件稳定常数的计算;熟悉配位剂的特性;掌握配位滴定中化学计量点时参数的计算和批示剂的作用原理及使用条件;熟悉配位滴定中原则溶液的配制与标定及滴定条件的选择。
理解配位滴定的应用。
教学重点及难点:配位反映中副反映系数和条件稳定常数。
概述:配位(络合)滴定法是以形成配位化合物反映为基础的滴定分析法。
大多数无机配位剂与金属离子形成的配位化合物,其稳定常数小,因而无机配位剂在滴定分析中无法广泛应用。
有机配位剂中氨羧配位剂与金属离子形成的络合物构成一定并且很稳定,除碱金属离子外,几乎能与全部金属离子配位。
现在配位剂应用最广的是 EDTA(乙二胺四乙酸)。
EDTA 与金属离子配位的特点是:(1)EDTA 几乎能与全部的金属离子形成配位物,形成的螯合物立体构造中含有多个五元环,因此,绝大多数配位物都相称稳定。
(2)EDTA 与金属离子形成的配位物都是简朴的1∶1的关系,计算时都是1∶1的关系。
(3)EDTA 与金属离子形成的配位物大多数是易溶于水的,故能在水溶液中滴定。
(4)EDTA 与金属离子的配位物大多数是五色的,便于用批示剂批示终点。
因此现在惯用的配位滴定就是 EDTA 滴定。
§6-1 配位滴定法的基本原理一、配位平衡1.配位物的稳定常数M + X == MXK MX[MX ] [M ][ X ]K MX 称为配合物(MX )的稳定常数。
当金属离子与配位剂形成 MX n 的配合物时,其形成是分级的,每级都有稳定常数,其各级稳定常数的乘积称为累积稳定常数。
用 β 表达。
β1 = K 1 第一级累积稳定常数β2 = K 1·K 2第二级累积稳定常数……βn = K 1·K 2…K n第 n 级累积稳定常数2.配位反映的副反映系数配位滴定中涉及的化学平衡比较复杂,除了被测金属离子 M 与滴定剂 Y 之间的主反映外,还存在其它的某些副反映,其总的平衡关系可用下式表达:M + Y=MYMLMOHHYNYMHY MOHYML 2 M(OH)2 H 2YOHHNH L OH┇ ┇ ┇ML nM(OH)nH 6Y显然,这些副反映的发生都将对主反映产生一定的影响。

案首教学内容一、配位滴定对化学反响的要求能形成配合物的反响很多,但能用于配位滴定的反响必须符合以下要求。
≥1 生成的配合物必须足够稳定,以保证反响完全,一般应满足K稳108。
2 生成的配合物要有明确组成,即在一定条件下只形成一种配位数的配合物,这是定量分析的根底。
3 配位反响速率要快。
4 能选用比拟简便的方法确定滴定终点。
二、配位滴定的标准溶液〔一〕EDTA及其配合物〔二〕EDTA的配位平衡〔三〕EDTA标准滴定溶液的配制与标定三、金属指示剂〔一〕金属指示剂的作用原理〔二〕金属指示剂应具备的条件〔三〕常用的金属指示剂〔四〕金属指示剂在使用中应注意的问题案首教学内容1、将碳酸钙基准物于称量瓶中,在110 C枯燥2小时,冷却后,准确称取~碳酸钙于250mL烧杯中,盖上外表皿,加水5-10ml润湿,再从杯嘴边逐滴参加浓盐酸5毫升淋洗入杯中,加热溶解,待冷却后转移至250mL容量瓶中,稀释至刻度摇匀。
2、用移液管移取25mL标准钙溶液于250mL锥形瓶中,参加约25 mL 水,10mL10%NaOH溶液及少量〔约10mg米粒大小〕钙指示剂,摇匀后,用EDTA溶液滴定至溶液由酒红色变为蓝色,即为终点。
案首教学内容知识点4、工业用水硬度的测定1、吸取水样50ml于250mL锥形瓶中,用吸量管参加三乙醇胺溶液〔1:2〕3ml,摇匀后参加缓冲溶液5ml及少许鉻黑T指示剂,摇匀。
2、用EDTA标准溶液滴定至溶液由酒红色变为蓝色。
数据记录与处理案首教学内容称取硫酸镍液体样品g ,精确至0.0001g ,加水70mL ,参加10mLNH 3-NH 4Cl 缓冲溶液〔0.2g58.69 go1]。
计算式: 10001000)()(⨯⨯⨯=m Ni M cV Ni w注:1.所有原始数据必须请裁判复查确认后才有效,否那么考核成绩为零分。
2.所有容量瓶稀释至刻度后必须请裁判复查确认后才可进行摇匀。
3.记录原始数据时,不允许在报告单上计算,待所有的操作完毕后才允许计算。
第14、15次课学时 4一、课程回顾:(提问)1、沉淀滴定法有哪几类?2、什么是莫尔法?怎么用?3、什么是佛尔哈德法?二、讲授新课:一、配合物(一)、配合物及其组成1.中心离子中心离子绝大多数为金属离子特别是过渡金属离子。
2.配体和配位原子配合物中同中心离子直接结合的阴离子或中性分子叫配体,配体中具有孤电子对并与中心离子形成配位键的原子称为配位原子(单基(齿)配体,多基(齿)配体)3.配位数配合物中直接同中心离子形成配位键的配位原子的总数目称为该中心离子的配位数配位数=配位体数×齿数4.配离子的电荷数配离子的电荷等于中心离子和配体电荷的代数和。
(二)、配合物的命名配离子按下列顺序依次命名:阴离子配体→中性分子配体→“合”→中心离子(用罗②判断在某一pH值下测定某种离子,什么离子有干扰。
③判断当有几种金属离子共存时,能否通过控制溶液酸度进行选择滴定或连续滴定。
3.配位滴定曲线图8-3是0.01000 mol·L-1EDTA标准溶液滴定0.01000 mol·L-1Ca2+溶液的滴定曲线。
图中pCa表示钙离子浓度的负对数。
(三)、金属指示剂配位滴定中的指示剂是用来指示溶液中金属离子浓度的变化情况,所以称为金属离子指示剂,简称金属指示剂。
1.金属指示剂的变色原理M + In ⇌ MIn(甲色)(乙色)MIn + Y ⇌ MY + In(乙色)(甲色)2.金属指示剂应具备的条件①在滴定的pH条件下,MIn与In的颜色应有显著的不同,这样终点的颜色变化才明显。
②MIn的稳定性要适当(一般要求K f,MIn>104),且其稳定性小于MY(一般lg K f,MY-lg K f,Min ≥2)。
③MIn应是水溶性的,指示剂的稳定性好,与金属离子的配位反应灵敏性好,并具有一定的选择性。
3.金属指示剂在使用中存在的问题(20分钟)金属指示剂EDTA配位定曲线。
剖析化学电子讲义滴定剖析法第三节配位滴定法教课目标:1、认识配合物观点及构造特色。
2、掌握乙二胺四乙酸( EDTA )配位剂特色及其在剖析测定中的应用。
3、掌握溶液 pH 对配位滴定的影响。
4、认识金属指示剂的作用原理及需要条件。
教课要点:掌握配位滴定剖析法的基来源理、金属指示剂的原理、常用的 EDTA 在剖析应用方面的特征。
教课内容:一、方法简介复习无机化学内容:Cu(NH 3)4 SO4配位键和离子键命名:硫酸四氨合铜配位体: NH 3配位数:4配位原子:N1、配位滴定法( coordinative titration):以配位反响为基础的滴定剖析法。
2、作为配位滴定的反响一定切合的条件:① 生成的配合物要有确立的构成,即中心离子与配位剂严格按必定比率化合。
② 生成的配合物要有足够的稳固性。
③ 配位反响速度要足够快。
④ 有适合的反应理论终点抵达的指示剂或其余方法。
二、 EDTA 及其剖析应用方面的特征1、 EDTA 的性质:EDTA :Ethlene-diamine tetraacetic acid 乙二胺四乙酸分子构造:剖析化学电子讲义滴定剖析法含两个氨基(—N<);含四个羧基(— COOH)的氨羧配位剂,用 H4Y 表示。
EDTA 物理性质:①溶于水, 22℃时的溶解度为 0.02g/100mL;② 难溶于酸和一般有机试剂;③ 易溶于氨溶液、苛性碱溶液中,生成相应的盐;④乙二胺四乙酸二钠盐( Na2H2Y ·2H2O)习惯上也称为 EDTA 。
Na2H2 Y ·2H2O:白色结晶状粉未,无臭无味,无毒,稳固。
室温下饱和溶液的浓度为 0.3mol/L ,中性, pH = 4.7。
2+++电离过程: H6Y H+ H5Y在酸性溶液中 H6Y 2+就相当于六元酸,有六级离解均衡。
H6Y 2+H++ H5Y +Ka1 = 10-0.9H5Y +H++H4Y Ka2 = 10-1.6H4Y H++ H3Y -Ka3 = 10-2.0H3Y H++H2Y 2-Ka4 = 10-2.67H2Y 2-H++HY 3-Ka5 = 10-6.16在水溶3-液中有 7 种离子 H6Y2+、H5Y+、H4Y 、H3Y -、H2Y 2-、HY 3-和 Y 4-七种离HY H++Y4-Ka6 = 10-10.26子存在。