- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3)指示剂与金属离子生成的配合物应易溶于水。 指示剂僵化——如果指示剂与金属离子生成的配合物 不溶于水,生成胶体或沉淀,在滴定时,指示剂与 EDTA的置换作用进行缓慢而使终点拖后的现象。 例:PAN指示剂在温度较低时易发生僵化; 可通过加乙醇或加热的方法增大MIn的溶解度, 避免指示剂僵化现象的发生。
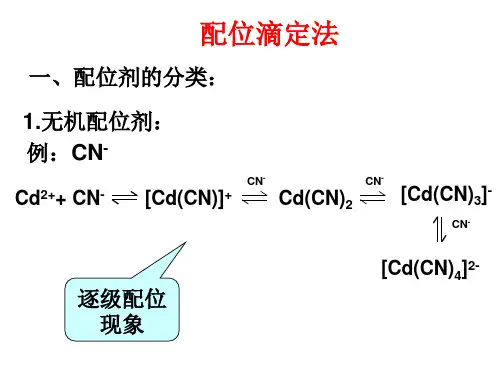
2.EDTA及其性质
(1) EDTA结构
(2)EDTA性质:EDTA ( H4Y), 获得两个质子,生成六元弱酸
H6Y2+ ;溶解度较小, 常用其二钠盐Na2H2Y.2H2O,溶解度较 大。
(3)EDTA在溶液中的存在形式
在高酸度条件下,EDTA是一个六元弱酸,在溶液中存在有 六级解离平衡:
有七种存在形式: 1)在pH >12时, 以Y 4-形式存在; 2)Y4-形式是配位的有效形式;
可理解为加入的滴定剂充当“第三者”的角色。
指示剂封闭——指示剂与金属离子生成了稳定的配合 物(即K ’ MIn >K ’MY), 终点时不能被滴定剂置换出来 的现象。 例:铬黑T 滴定Ca2+、Mg2+时,若有 Fe3+、Al3+、 Cu2+ 、Ni2+ 等离子存在,铬黑T便被封闭,可加三 乙醇胺掩蔽。
3.金属指示剂
(1)作用原理
金属指示剂是一种有颜色的、具有酸碱性质的 有机染料(In,甲色),能与金属离子生成另一种颜 色的有色络合物(MIn,乙色),且指示剂络合物MIn稳 定性小于EDTA络合物MY稳定性(K’MIn<K’MY)。因 此达到计量点时,稍过量的EDTA便完全置换出指示 剂络合物MIn中的金属离子,释放出游离的金属指示 剂, 溶液随之由乙色变为甲色.
三 、硬度与测定
1.硬度及分类
⑴按阳离子分:总硬度 = 钙硬度[Ca2+] +镁硬度[Mg2+]
(2)按阴离子分:总硬度 = 碳酸盐硬度 + 非碳酸盐硬度 碳酸盐硬度:碳酸盐硬度包括重碳酸盐如Ca(HCO3)2、 Mg(HCO3)2和碳酸盐如MgCO3, CaCO3的总量。一般加热煮沸 可以除去,因此称为暂时硬度。 Ca(HCO3)2 = CaCO3↓+CO2↑+H2O ( 由于生成的CaCO3 等沉淀,在水中还有一定的溶解度,所以碳酸盐
=17.86mg/LCaCO3 1)mgCaCO3 /L, 1mmol/L=100.1CaCO3mg/L=10°(法国度); 2) mg CaO/L, 1mmol/L=56.1 CaOmg/L=5.6°(德国度) (3)德国度:一般地,硬度指的是德国度。 1度=10mg/L所引起的硬度(以CaO计)。 (4)法国度:1法国度=10mg /L所引起的硬度(以CaCO3计)。 以CaO 或以CaCO3计有点类似与酸碱滴定中碱度的表示方法。
3)化学计量点:此时 Ca 2+几乎全部与EDTA络合, [CaY]=0.01/2=0.005 mol/L ;[Ca 2+]=[Y4-]=X ;KCaY=1010.69 由稳定常数表达式[Ca2+]2=CCaY,sp/KCaY,得:0.005/X2 = 1010.69 , 所以 [Ca 2+]=3.2×10-7 mol/L ;pCa=6.49
3.硬度的测定
(1)总硬度测定:[Ca2+ + Mg2+] 的测定 在一定体积的水样中,加入一定量的NH3—NH4Cl 缓 冲 溶 液 , 调 节 pH=10.0 , ( 加 入 三 乙 醇 胺 , 掩 蔽 Fe3+,Al3+) ,加入铬黑T指示剂,溶液呈红色,用EDTA 标准溶液滴定至由紫红色变为蓝色。 C V 计算公式:总硬度(mmol/L )= EDTA EDTA 1000
总有αY(H)≥1
[Y' ]>[Y]。
4) 当pH>12,αY(H) =1时,表示 [Y' ]=[Y]; pH ~ lg αY(H)曲线称为酸效应曲线.
由于酸效应的影响,EDTA与金属离子形成配合 物的稳定性降低,为了反映不同pH条件下配合物的 实际稳定性,因而需要引入条件稳定常数。
5.络合滴定中的副反应及条件稳定常数
(2) 溶液pH小于12时滴定
当溶液pH小于12时,存在酸效应; lgK’MY=lgK MY -lgαY(H) 将滴定pH所对应的酸效应系数代入上式,求出 K’MY后计算。
2.影响滴定突跃的主要因素
(1) 络合物的条件稳定常数 K’MY越大,滴定突跃越大。 (2)被滴定金属离子的浓度 CM越大,滴定突跃越大。
4)化学计量点后: EDTA溶液过量0.02mL(+0.1%) [Y4-]=0.01000× 0.02/(20.00+20.02)=5.00×10-6 mol/L [CaY]=0.01000×20.00/(20.00+20.02)=5.00×10-3 mol/L 由稳定常数表达式[Ca2+]=[CaY]/(KCaY· [Y])]得: [Ca 2+]=2.00×10-8 mol/L ; pCa=7.69 由计算可得滴定突跃范围: pCa=5.3~7.69 ; 化学计量点: pCa=6.49
硬度并不能由加热煮沸完全除尽。)
非碳酸盐硬度:非碳酸盐硬度主要包括 CaSO4 、MgSO4 、 CaCl2 、MgCl2 等的总量,经加热煮沸不能除去,故称为永久 硬度。
2.硬度的单位
(1)mmol/L( 以 Ca2+ 、Mg2+计 ):
(2 )mg/L;这是现在的通用单位。1°=10mg/LCaO
C EDTA V ' EDTA M Ca Ca 2 (mg/L) 1000 V水
Mg硬度计算公式:
Mg2 (mg/L) C EDTA (VEDTA V ' EDTA ) M Mg V水 1000
4.天然水中碱度与硬度的关系
(1)总碱度<总硬度 :即钙、镁离子过量
即C(HCO3-)<C(1/2 Ca2+)+C(1/2 Mg2+) 碳酸盐硬度=总碱度<总硬度; 非碳酸盐硬度=总硬度-总碱度
(4)与无色金属离子形成无色络合物, 与有色金
属离子一般生成颜色更深的络合物。
4.酸度对络合滴定的影响
(1)酸效应:由于H+ 的存在,使络合剂参加主体 反应能力降低的现象称为酸效应。
(2)酸效应系数: pH溶液中,EDTA的各种存在形 式的总浓度[Y'],与能参加配位反应的有效存 在形式Y4-的平衡浓度[Y]的比值。
例题: 计算0.01000 mol/L EDTA 溶液滴定20.00 mL 0.01000 mol/L Ca 2+溶液的滴定曲线。
(1) 溶液在pH>12时进行滴定时:
酸效应系数αY(H)=1; K 'MY = K MY = [MY] /([M] [Y4-]
1)滴定前:溶液中Ca 2+离子浓度:
[Ca 2+ ] = 0.01 mol / L , pCa = -lg [Ca 2+ ] = -lg0.01 = 2.00 2)化学计量点前:已加入19.98mL EDTA(剩余0.02mL钙 溶液,此时CaY中的Ca2+ 浓度忽略,因为与剩余游离的 Ca2+比相差2个数量级。) [Ca2+] = 0.01000×0.02 / (20.00+19.98)= 5×10-6 mol/L, pCa =5.3
由于酸度的影响是主要的,通常金属离子无水解
效应,且不存在金属离子的副反应,只考虑酸效应。
二、络合滴定
1.络合滴定曲线
在络合滴定中,随着EDTA滴定剂的不断加入,被滴 定金属离子的浓度不断减少, 以被测金属离子浓度 的负对数pM(pM=-lg[M])对加入滴定剂体积作图,可 得络合滴定曲线即pM~V曲线。
(2)总碱度>总硬度 :即碳酸氢根过量
即 C(HCO3-)>C(1/2 Ca2+)+C(1/2 Mg2+) 碳酸盐硬度=总硬度 <总碱度; 没有非碳酸盐硬度, 负硬度(如Na+、K+生成的碳酸氢盐)=总碱度-总硬度
NaHCO3、KHCO3、Na2CO3、K2CO3等称为负硬度。
(3)总碱度=总硬度:
金属指示剂变色过程:
滴定前加入指示剂, M + In 甲色 = MIn 乙色 溶液呈乙色
以EDTA进行滴定,滴定反应为:
终点,
M + Y = MY
溶液由乙色 甲色
MIn + Y = MY + In 乙色 甲色
例:络合滴定法测定镁离子,滴定前加入铬黑T (EBT)指示剂,溶液呈紫红色:
铬黑T(蓝色) + Mg2+ = Mg2+-铬黑T(紫红色), 滴定终点时,滴定剂EDTA夺取Mg2+ -铬黑T中的Mg2+,使铬黑T
游离出来,溶液呈蓝色,反应如下:
Mg2+ -铬黑T(紫红色) + Y = 铬黑T (蓝色) + Mg2+ -Y 因此滴定时溶液颜色变化为紫红色 蓝色。
(2)金属指示剂应具备的条件
1)在滴定的pH范围内,游离指示剂与其金属配合
物之间应有明显的颜色差别;
2)指示剂与金属离子生成的配合物稳定性应适当; 不能太小:否则未到终点时指示剂游离出来使终点 提前。 不能太大:稳定性太高又使终点延后。应确保滴定 剂能将金属离子从与指示剂形成的络和物中被置换 出来。
4、在Ca ,Mg的混合液中,用EDTA法测定Ca要消除Mg的干 扰,宜用:( D ) A、控制酸度法 B、络合掩蔽法 C、氧化还原掩蔽法 D、沉淀掩蔽法 5、某溶液主要含Ca2+、Mg2+及少量Fe3+、Al3+.在pH=10时, 加入三乙醇胺后以EDTA滴定,用铬黑T为指示剂,则测出 的是( C ) A、Mg2+ B、Ca2+ C、Ca2+.、Mg2+ D、Fe3+ 、Al3+






![山东大学期末考试复习-水分析化学[第三章配位滴定法]山东大学期末考试知识点复习](https://uimg.taocdn.com/aacfb347ff4733687e21af45b307e87101f6f889.webp)