【金版学案】2014-2015学年高中化学人教版必修二课时训练:第3章 第1节 第1课时 甲烷的性质
- 格式:doc
- 大小:514.50 KB
- 文档页数:5
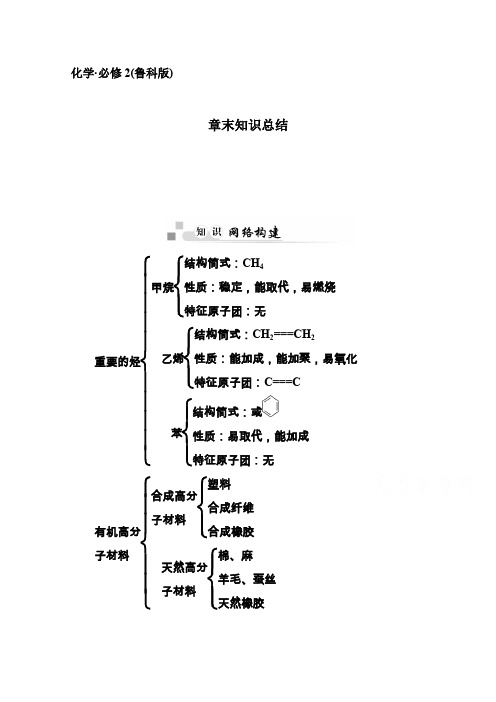
化学·必修2(鲁科版)章末知识总结重要的烃⎩⎪⎪⎪⎪⎨⎪⎪⎪⎪⎧甲烷⎩⎪⎨⎪⎧结构简式:CH 4性质:稳定,能取代,易燃烧特征原子团:无乙烯⎩⎪⎨⎪⎧结构简式:CH 2===CH 2性质:能加成,能加聚,易氧化特征原子团:C===C苯⎩⎪⎨⎪⎧结构简式:或性质:易取代,能加成特征原子团:无有机高分子材料⎩⎪⎪⎨⎪⎪⎧合成高分子材料⎩⎪⎨⎪⎧塑料合成纤维合成橡胶天然高分子材料⎩⎪⎨⎪⎧棉、麻羊毛、蚕丝天然橡胶热点一 烃的燃烧规律若烃的分子式用C x H y 表示,烃完全燃烧的化学方程式可表示为:C x H y +⎝ ⎛⎭⎪⎫x +y 4O 2――→点燃xCO 2+y 2 H 2O 。
根据不同的情况,可总结出与烃完全燃烧有关的几条规律:1.等物质的量的烃完全燃烧耗氧量的计算。
(1)耗O 2量的多少取决于⎝ ⎛⎭⎪⎫x +y 4,(x +y 4)值越大,耗O 2量越大。
(2)产生CO 2的量取决于x ,x 越大,产生CO 2的量也越多。
(3)产生H 2O 的量取决于y ,y 越大,产生H 2O 的量也越多。
注意:实验式(最简式)相同、分子式不同的两种烃,等物质的量完全燃烧时,耗O 2量并不相等。
耗O 2量也可用上述规律进行比较,但两种烃的耗O 2的量之比、产生CO 2的量之比、产生H 2O 的量之比完全相同,比值等于两种烃分子中C(或H)原子个数之比。
2.等质量的烃完全燃烧耗氧量的计算。
因等质量的H 比等质量的C 耗O 2多,故:(1)耗O 2量的多少取决于y x ,y x值越大,耗O 2量越大。
注意:y x值越大,意味着烃分子中H 的质量分数越大,耗O 2量也越大。
(2)产生H 2O 的量取决于y x ,y x值越大,产生H 2O 的量也越大。
(3)产生CO 2的量取决于y x ,y x值越大,产生CO 2的量越小。
注意:实验式相同的烃,y x相同,等质量完全燃烧时耗O 2量、产生CO 2的量、产生H 2O 的量完全相同。

第一节最简单的有机化合物——甲烷课时1甲烷学习目标:1.了解有机化合物的概念。
2.掌握甲烷的分子结构,了解甲烷的物理性质及存在、用途。
3.掌握甲烷的化学性质,认识取代反应的特点。
(重点)[自主预习·探新知]1.有机化合物和烃及其包含关系【提醒】含碳化合物不一定都是有机物。
如CO、CO2、碳酸盐、氰化物等为无机物。
2.甲烷的存在组成与结构(1)甲烷的存在和用途(2)组成和结构(3)空间结构甲烷分子以碳原子为中心,四个氢原子为顶点形成正四面体形,4个C —H 键的长度和强度相同,夹角相等。
【提醒】 可利用CH 4分子中共价键的夹角为109°28′且相同,说明CH 4为正四面体形而不是正方形。
3.甲烷的性质(1)物理性质颜色 状态 气味 密度(与空气相比)水溶性 无色 气体 无味比空气小 极难溶于水(2)化学性质①稳定性通常状况下,CH 4性质稳定,与强酸、强碱、强氧化剂均不反应。
②氧化反应(燃烧)点燃条件下,CH 4能在空气中燃烧,化学方程式为CH 4+2O 2――→点燃CO 2+2H 2O ,燃烧火焰呈淡蓝色。
③与Cl 2的取代反应a .CH 4与Cl 2在光照条件下,反应生成一氯甲烷的化学方程式(用结构式表示物质) 。
b .甲烷的4种氯代产物都不溶于水,常温下CH 3Cl 为气体,其他三种为液体。
(3)有机物取代反应概念:有机物分子中的某些原子或原子团被其他的原子或原子团所替代的反应。
[基础自测]1.判断对错(对的打“√”,错的打“×”)。
(1)含碳化合物一定为有机物,含碳、氢的化合物一定是烃( )(2)沼气、坑道气、天然气的主要成分均为甲烷( )(3)甲烷的结构式为,空间构型为正方形()(4)CH4易燃易爆,是一种还原性气体,能使酸性KMnO4溶液褪色()(5)CH4、H2、CO的燃烧火焰相似,均为淡蓝色火焰()2.写出下列反应的化学方程式(1)甲烷与氧气的反应:_______________________________________。


第三章测评(时间:90分钟满分:100分)可能用到的相对原子质量:C 12N 14Ti 48Fe 56一、选择题(本题包括10个小题,每小题只有一个选项符合题意。
每小题2分,共20分)1.下列说法正确的是()A.金属晶体的熔点都比分子晶体的熔点高B.在金属晶体中,自由电子与金属离子的碰撞有能量传递,可以用此来解释金属的导热性C.金属键可以看作是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性D.NaCl和SiC晶体熔化时,克服的粒子间作用力类型相同Hg的熔点比分子晶体I2的熔点低,A错误;金属中自由电子受热后运动速率增大,与金属离子碰撞频率增大,传递了能量,故金属有良好的导热性,B正确;金属键是金属阳离子和自由电子之间的强烈相互作用,自由电子为整个金属的所有阳离子共有,所以金属键没有方向性和饱和性,而共价键有方向性和饱和性,C错误;NaCl晶体属于离子晶体,NaCl熔化需要克服离子键,SiC晶体属于共价晶体,熔化时需要克服共价键,D错误。
2.晶体具有各向异性。
如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨与层垂直方向上的。
晶体各向异性的主要表现是()电导率和与层平行方向上的电导率之比为1104①硬度②导热性③导电性④光学性质A.只有①③B.只有②④C.只有①②③D.①②③④,表现在硬度、导热性、导电性、光学性质等方面。
3.下列说法正确的是()A.具有规则几何外形的固体一定是晶体B.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个C.熔点由高到低:NaI>NaBr>NaCl>NaFD.含有共价键的晶体一定具有较高的熔、沸点及硬度,判断是否为晶体的关键是看固体物质是否具有各向异性及是否具有固定的熔点,A错误;采用沿x、y、z三轴切割的方法可知,氯化钠晶胞中与每个Na+距离相等且最近的Na+个数是12,B正确;离子键强弱与离子半径、离子电荷有关,从F-到I-,其离子半径逐渐增大,所以离子键由强到弱、熔点由高到低的顺序为NaF>NaCl>NaBr>NaI,C错误;含有共价键的晶体不一定具有高的熔、沸点及硬度,如分子晶体的熔、沸点及硬度较低,D错误。


第一章 物质结构 元素周期律第一节 元素周期表1.碱金属元素原子最外层的电子都是 个,在化学反应中它们容易失去 个电子;碱金属元素中金属性最强的是 ,原子半径最小的是 。
卤素原子最外层的电子都是 个,在化学反应中它们容易得到 个电子;在卤族元素中非金属性最强的是 ,原子半径最小的是 。
2.查阅元素周期表,判断下列元素中不属于主族元素的是( )A .磷B .钙C .铁D .碘3.下列关于F 、C1、Br 、I 性质的比较,不正确的是( )A .它们的原子核外电子层数随核电荷数的增加而增多B .被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大C .它们的氢化物的稳定性随核电荷教的增加而增强D .单质的颜色随核电荷数的增加而加深4.放射性同位素钬 16667Ho 的原子核内的中子数与核外电子数之差是( )A .32B .67C .99D .1665.在63Li 、7 3Li 、23 11Na 、24 12Mg 、14 6C 、14 7N 中:(1) 和 互为同位素;(2) 和 的质量数相等,但不能互称同位素;(3) 和 的中子数相等,但质子数不等,所以不是同一种元素。
6.查阅元素周期表,从每个方格中可以得到哪些信息?以一种元素为例,将你获得的信息用图表示出来。
7.在元素周期表中找到金、银、铜、铁、锌、钛的位置(周期和族),并指出这些元素的核电荷数。
8.寻找你家中的食品、调味品、药品、化妆品、洗涤剂、清洁剂及杀虫剂等,查阅标签或说明书,看一看其中含有哪些元素,查阅它们在周期表中的位置;查阅哪些物品中含有卤族元素。
试着向你的家人说明其中卤素的有关性质。
9.写出下列反应的化学方程式,并指出氧化剂和还原剂。
(1)锂在空气中燃烧(2)钾与水反应(3)溴与碘化钾反应(4)氯化亚铁与氯气反应10.甲、乙、丙、丁四种元素的原子序数如表中所示,从周期表中找出这四种元素。
(1)填写下表(2)写出这几种元素的单质间反应的化学方程式:甲与乙:乙与丙:乙与丁:11.截止到1999年,人们已经发现了113种元素,是否可以说我们已经发现了113种原子? 为什么?第二节元素周期律1.元素周期表的第三周期元素,从左到右,原子半径逐渐;元素的金属性逐渐,非金属性逐渐。
第3章重要的有机化合物第1节认识有机化合物第2课时有机化合物的结构特点1.关于CH4和的叙述正确的是()A.均能用通式C n H2n+2来表示B.与所有烷烃互为同素异形体C.因为它们结构相似,所以它们的化学性质相似,物理性质相同D.通常情况下它们都是气态烷烃解析:二者均为烷烃,互为同系物,化学性质相似,但物理性质不同,后者为液态。
答案:A2.下列化学用语表示不正确的是()A.甲烷的结构式为B.异丁烷的结构简式为C.戊烷的分子式为C5H10D.丙烷的分子球棍模型图为解析:戊烷的分子式为C5H12,C项错误。
答案:C3.下列化学式只表示一种纯净物的是()A.C2H6B.C4H10C.C2H4Cl2D.C解析:A是CH3CH3,无同分异构体。
B有CH3CH2CH2CH3和两种同分异构体。
C中CH2ClCH2Cl与CHCl2CH3是同分异构体。
D中碳有多种不同单质,如金刚石、石墨等。
答案:A4.在下列结构的有机化合物中:属于同分异构体的正确组合是()A.②和⑤B.②和③C.①和②D.③和④解析:①和④、②和③的分子式相同而结构不同,分别为同分异构体;②和⑤为同种物质。
答案:B5.某烃具有同分异构体,且各同分异构体的一氯代物的种数相同,该烃的分子式是()A.CH4B.C3H8C.C4H10D.C5H12解析:A、B项的物质没有同分异构体,C项C4H10有CH3CH2CH2CH3和两种结构,其分子中均有2种等效氢原子,即一氯代物都有2种;D项,C5H12有CH3CH2CH2CH2CH3、和C(CH3)43种结构,其分子中分别有3种、4种和1种等效氢原子,即一氯代物分别有3种、4种、1种。
答案:C6.下列几组物质中,互为同位素的有________,互为同素异形体的有________,互为同系物的有________,互为同分异构体的有________,属于同种物质的有________。
①O2和O3②35Cl和37Cl③CH3CH3和CH3CH2CH3④⑤CH3(CH2)2CH3和(CH3)2CHCH3解析:①是氧元素的两种单质,互为同素异形体;②是氯元素的两种不同原子,互为同位素;③中乙烷与丙烷互为同系物;④中属于同种物质;⑤两者分别为正丁烷与异丁烷,互为同分异构体。
第3课时 元素周期表和元素周期律的应用一、元素的金属性和非金属性1.元素周期表的分区2.分界线附近元素的性质既能表现出一定的________,又能表现出一定的________。
3.元素金属性和非金属性的递变元素性质递变⎩⎪⎪⎨⎪⎪⎧ 同周期从左到右⎩⎪⎨⎪⎧ 原子半径逐渐 失电子能力 ,得电子能 力 金属性 ,非金属性 同主族从上到下⎩⎪⎨⎪⎧ 原子半径逐渐 失电子能力 ,得电子能力 金属性 ,非金属性二、元素的化合价与元素在周期表中的位置之间的关系1.主族元素最高正化合价(O 、F 除外)=__________=________。
2.金属元素____负化合价,________形成简单的阴离子;非金属元素(除氢外),________ 形成简单的阳离子。
3.非金属元素的化合价(1)最高正价(O 、F 除外)等于原子所能失去或偏移的________________。
(2)最低负价等于使它达到________稳定结构所需得到的电子。
(3)最高正价与最低负价绝对值之和等于____。
三、元素周期表和元素周期律的应用1.根据元素在周期表中的位置推测其____________和______。
2.根据元素的__________推测它在周期表中的位置。
3.指导新元素的发现及预测它们的________________。
4.指导其他与化学相关的科学技术。
如在周期表中____________________________,可以找到半导体材料。
在____________中寻找催化剂和耐高温、耐腐蚀的合金材料。
知识点一 元素的金属性和非金属性与其在元素周期表中位置的关系1.下列关于元素周期表和元素周期律的叙述正确的是( )A .元素的性质随着相对原子质量的递增,呈周期性的变化B .周期表中,元素族序数都等于该族元素原子的最外层电子数C .第三周期中,随着核电荷数的递增,元素的金属性逐渐增强D .随着核电荷数的递增,ⅦA 族元素的单质熔、沸点升高,碱金属元素单质熔、沸点 降低2.镭是元素周期表中第七周期 ⅡA 族元素,下列关于镭的性质的描述中不正确的是( )A .在化合物中显+2价B .单质能与水反应置换出H 2C .氢氧化物呈两性D .碳酸盐难溶于水知识点二 元素化合价与元素在周期表中位置的关系3.已知下列反应:Cu +X 2=====△CuX 2,2Cu +Y=====△Cu 2Y,2KX +Z 2=====△2KZ +X 2。
安徽省高中化学人教版必修2(教案)目录:第一章物质结构元素周期律蔡霞第一节元素周期表第二节元素周期律第三节化学键第二章化学反应及能量陈运峰第一节化学能与热能第二节化学能与电能第三节化学反应的速率和限度第三章有机化合物杨建军第一节最简单的有机化合物----甲烷第二节来自石油和煤的两种基本化工第三节生活中两种常见的有机物第四节基本营养物质第四章化学与自然资源的开发利用庞咏梅第一节开发利用金属矿物和海水资源第二节资源综合利用环境保护第一章物质结构元素周期律元素周期表第1课时一、课标点击能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置。
二、三维目标知识与技能1、初步掌握周期表的结构。
2、初步掌握元素性质与原子结构的关系。
过程与方法1、引导学生自主学习:认识周期表的结构。
2、自主探究:探究IA、元素原子结构与性质的关系。
情感、态度与价值观1、通过化学史学习,培养勇于创新、不断探索的科学品质。
2、使学生树立:“科学技术是不断发展变化的”唯物主义观点三、教学重点:1、周期表的结构。
2、碱金属元素的原子结构与性质的关系。
四、教学难点:碱金属元素的原子结构与性质的关系。
五、教学方法:阅读比较、合作交流、归纳总结表(一)Na 、K 与O 2反应第一节 元素周期表(第1课时)一、 元素周期表 原子序数=核电核数 =质子数 =核外电子数 1、周期表周期 三个短周期四个长周期 主族 族 副族Ⅷ O 族二、元素的性质与原子结构 1、碱金属元素(一)碱金属元素结构异同:异:核电荷数:由小→大;电子层数:由少→多;同:最外层电子数均为1个。
(1)钾与氧气燃烧实验:22KO O K 燃烧+(2)钾与水反应实验: ↑+=+22222H KOH O H K碱金属元素递变性:随核电荷数递增,从Li 到Cs ,电子层数递增,原子核对最外层电子吸引逐渐减弱。
(二)、卤族元素(1)卤族元素单质的物理性质的变化规律 (2)卤素单质与氢气反应剧烈程度:F 2>Cl 2>Br 2>I 2;生成氢化物稳定性:HF>HCl>HBr>HI(3)卤素单质间的置换反应2NaBr + Cl 2 = 2NaCl + Br 2 2NaI + Cl 2 = 2NaCl + I 2 2NaI + Br 2 = 2NaBr + I 2 随核电荷数增加,单质氧化性强弱顺序:F2 Cl 2 Br 2 I 2 氧化性逐渐减弱[规律]:同一主族中,随原子核外电子层数增加,得电子能力逐渐减弱,失电子能力逐渐增强,非金属性逐渐减弱,金属性逐渐增强。
化学·必修2(人教版)
有机化合物
第一节最简单的有机化合物——甲烷
第1课时甲烷的性质
水平检测
1.据报道,2011年5月3日上午,墨西哥北部一处煤矿发生瓦斯爆炸,造成多名矿工死伤。
瓦斯爆炸往往与矿坑中的甲烷有关,下列叙述中错误的是() A.点燃甲烷不必事先进行验纯
B.甲烷燃烧放出大量的热,所以是一种很好的气体燃料
C.煤矿的矿井要注意通风并严禁烟火,以防爆炸事故的发生
D.点燃混有空气的甲烷不一定会爆炸
解析:甲烷的爆炸极限为5%~15.4%(即甲烷体积在空气中含量为5%~15.4%)。
如果甲烷中混有空气,点燃时可能会发生爆炸,因此点燃之前必须验纯。
答案:A
2.在光照条件下,将等物质的量的甲烷和氯气充分反应,所得产物中物质的量最多的是()
A.CH3Cl B.CH2Cl
C.CHCl3D.HCl
解析:光照条件下,甲烷和氯气的取代反应每一步都生成了HCl,故产物中HCl的物质的量最多。
答案:D
3.下图分别是CH4、CCl4、CH3Cl的分子球棍模型图,下列说法正确的是()
A.CH4、CCl4和CH3Cl都是正四面体结构
B.CH4、CCl4都是正四面体结构
C.CH4和CCl4中的化学键均为非极性键
D.CH4、CCl4的结构相同,性质也相同
解析:CCl4分子的空间结构同CH4相似,为正四面体结构,CH3Cl中的C—H 键和C—Cl键不同,不是正四面体结构。
答案:B
4.下列说法正确的是()
A.含碳元素的化合物都是有机物
B.完全燃烧只生成CO2和H2O的化合物都是烃
C.大多数有机物分子中碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是非极性共价键和极性共价键
D.有机物完全燃烧只可能生成CO2和H2O
解析:有机物通常是指含碳元素的化合物,但CO、CO2、Na2CO3等少数物质,虽含有碳元素,但其性质却跟无机物相似,故一般把它们归为无机物,A项错误。
完全燃烧只生成CO2和H2O,仅说明该化合物中含有C、H两种元素,但不一定说明只由C、H两种元素组成,例如,乙醇(C2H6O)完全燃烧也只生成CO2和H2O,但乙醇不是烃,B项错误。
有机物中碳与碳之间不论是单键、双键、三键,都是非极性共价键,而碳与其他原子间多为极性共价键,C项正确。
有些有机物除含碳、氢、氧外,还含有氮、硫、卤素、磷等,它们完全燃烧可能还会生成SO2、氮的氧化物等物质,D项错误。
答案:C
5.下列物质在一定条件下可跟CH4发生化学反应的是()
A.酸性高锰酸钾溶液
B.溴水
C.氢氧化钠溶液
D.溴蒸气
解析:在通常情况下,CH4的化学性质比较稳定,不与强酸、强碱、强氧化剂发生反应,不能使酸性高锰酸钾溶液、溴水褪色,但在光照条件下能与溴蒸气发生取代反应。
答案:D
6.已知天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应前者较大。
下列叙述:①天然气与煤、石油相比是较洁净的能源;②等质量的CH4和CO2产生的温室效应也是前者
大;③燃烧天然气也是酸雨的成因之一。
其中正确的是()
A.只有①B.只有③
C.①和②D.①②和③
解析:根据题示信息。
等物质的量的CH4和CO2产生的温室效应前者较大,那么等质量的CH4和CO2,前者物质的量大,产生的温室效应更大,所以②正确;天然气燃烧的产物是CO2和H2O,而煤、石油燃烧的产物除CO2和H2O外,还有SO2等有害气体,所以天然气是比较洁净的能源,①正确;酸雨主要是硫的氧化物和氮的氧化物溶于水所致,大量排放SO2是其主要原因,而天然气的燃烧不会产生SO2,③不正确。
答案:C
能力提升
7.将1 mol甲烷和适量的Cl2混合后光照,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为()
A.1.5 mol B.3 mol
C.4.5 mol D.6 mol
解析:解答此题宜用原子守恒法。
CH3Cl、CH2Cl2、CHCl3、CCl4中的碳原子都是从CH4中来的,故这四种取代物共1 mol,设CH3Cl的物质的量为x,则x +(x+0.1 mol)+(x+0.2 mol)+(x+0. 3 mol)=1 mol,得x=0.1 mol,即CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次为0.1 mol、0.2 mol、0.3 mol、0.4 mol,含Cl原子的物质的量共为0.1 mol×1+0.2 mol×2+0.3 mol×3+0.4 mol ×4=3 mol。
而一个Cl2分子中只有一个Cl原子参加取代反应,因此消耗的Cl2也为3 mol。
答案:B
8.(双选题)下列叙述正确的是()
A.由甲烷分子呈正四面体形结构可推知一氯甲烷分子也呈正四面体形结构B.在甲烷的四种氯的取代物中,只有四氯甲烷是非极性分子
C.由甲烷(CH4)的氯代物有4种,可推知乙烷
D.由于CH4是易燃易爆的气体,所以点燃CH4前一定要检验其纯度
解析:CH4是正四面体结构,但CH3Cl中因C—Cl键不同于C—H键,所以是四面体结构,而不是正四面体结构,故A项错误;在甲烷的四种氯代物中,只有CCl4是正四面体结构,其结构对称,正负电荷的中心重合,是非极性分子,
其余三者都是极性分子,故B 项正确;由乙烷的结构式可知,其一氯取代物有1种,二氯取代物有2种,三氯取代物有2种,四氯取代物有2种,五氯取代物和六氯取代物各有1种,这样,C 2H 6的氯代物共有9种,而非6种,故C 项错误;点燃H 2、CO 、CH 4等易燃易爆的气体前,一定要验纯,这是实验的基本常识,D 项正确。
答案:BD
9.个体小煤矿经常发生瓦斯爆炸事故,造成多人伤亡,因此在矿井里,必须采取安全措施,如通风、严禁烟火等,而且要随时检查瓦斯的体积分数,如果空气中含甲烷5%~15%,遇到明火会发生爆炸。
发生最强烈爆炸时空气中甲烷所占的体积分数是( )
A .5%
B .9.1%
C .10.5%
D .15%
解析:爆炸极限是指可燃性气体与空气的混合物点燃能发生爆炸的浓度范围。
事实上在这个浓度范围内爆炸强弱程度不同,其中有一个爆炸最强点,它所要满足的条件是:在混合气体中,可燃性气体与助燃性气体的体积比恰好是完全
反应时的比值。
根据反应CH 4+2O 2――→点燃CO 2+2H 2O ,恰好完全反应时V (CH 4)∶
V (O 2)=1∶2,空气中氧气所占的体积比约为1/5,甲烷占混合气体的体积分数约为1/(1+10)×100%=9.1%。
答案:B
10.如图,某气体X 可能由H 2、CO 、CH 4中的一种或几种组成,将X 气体燃烧,把燃烧后生成的气体通过A 、B 两个洗气瓶。
试回答下列问题。
(1)若A 洗气瓶的质量增加,B 洗气瓶的质量不变,则气体X 是________。
(2)若A 洗气瓶的质量不变,B 洗气瓶的质量增加,则气体X 是________。
(3)若A 、B 两个洗气瓶的质量都增加,则气体X 可能是________。
解析:此题主要考查根据洗气瓶中质量的变化,确定原气体X 的成分。
由于
2H 2+O 2=====点燃2H 2O ,2CO +O 2=====点燃2CO 2,CH 4+2O 2――→点燃CO 2+2H 2O
又浓H2SO4吸收水,石灰水吸收CO2,则得:
(1)若A瓶质量增加,B瓶质量不变,说明气体X燃烧只生成水,故X为H2。
(2)若A瓶质量不变,B瓶质量增加,说明气体X燃烧只有CO2生成,故X 为CO。
(3)若A、B两瓶质量都增加,说明气体X燃烧产物既有H2O又有CO2,故X气体为不确定成分。
它可以是CH4或以下组合:H2、CO;H2、CH4;CO、CH4;H2、CO、CH4。
答案:(1)H2(2)CO(3)CH4或H2、CO或H2、CH4或CO、CH4或H2、CO、CH4。