初三中考化学竞赛考试试卷3(1)及答案(最新整理)
- 格式:pdf
- 大小:215.87 KB
- 文档页数:5
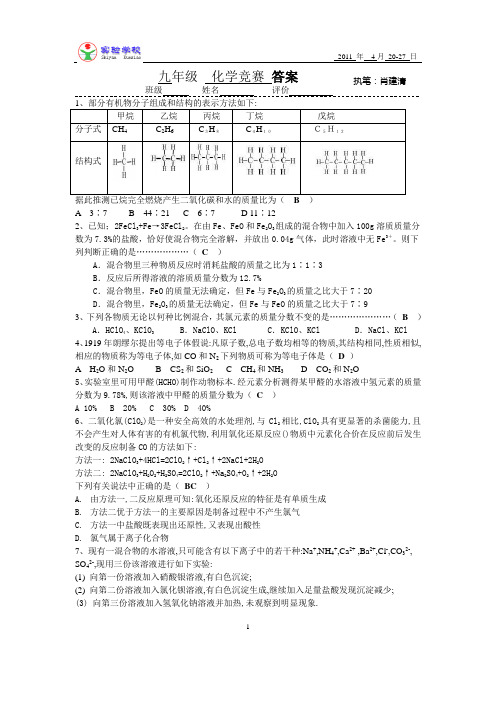
1九年级 化学竞赛 答案班级 姓名 评价据此推测已烷完全燃烧产生二氧化碳和水的质量比为( B )A 3∶7B 44∶21C 6∶7D 11∶122、已知;2FeCl 3+Fe →3FeCl 2。
在由Fe 、FeO 和Fe 2O 3组成的混合物中加入100g 溶质质量分数为7.3%的盐酸,恰好使混合物完全溶解,并放出0.04g 气体,此时溶液中无Fe 3+。
则下列判断正确的是………………( C )A .混合物里三种物质反应时消耗盐酸的质量之比为1∶1∶3B .反应后所得溶液的溶质质量分数为12.7%C .混合物里,FeO 的质量无法确定,但Fe 与Fe 2O 3的质量之比大于7∶20D .混合物里,Fe 2O 3的质量无法确定,但Fe 与FeO 的质量之比大于7∶93、下列各物质无论以何种比例混合,其氯元素的质量分数不变的是…………………( B )A .HClO 4、KClO 3B .NaClO 、KClC .KClO 、KClD .NaCl 、KCl 4、1919年朗缪尔提出等电子体假说:凡原子数,总电子数均相等的物质,其结构相同,性质相似,相应的物质称为等电子体,如CO 和N 2下列物质可称为等电子体是( D )A H 2O 和N 2OB CS 2和SiO 2C CH 4和NH 3D CO 2和N 2O5、实验室里可用甲醛(HCHO)制作动物标本.经元素分析测得某甲醛的水溶液中氢元素的质量分数为9.78%,则该溶液中甲醛的质量分数为( C )A 10%B 20%C 30%D 40%6、二氧化氯(ClO 2)是一种安全高效的水处理剂,与Cl 2相比,ClO 2具有更显著的杀菌能力,且不会产生对人体有害的有机氯代物,利用氧化还原反应()物质中元素化合价在反应前后发生改变的反应制备CO 的方法如下:方法一: 2NaClO 3+4HCl=2ClO 2↑+Cl 2↑+2NaCl+2H 2O方法二: 2NaClO 3+H 2O 2+H 2SO 4=2ClO 2↑+Na 2SO 4+O 2↑+2H 2O下列有关说法中正确的是( BC )A. 由方法一,二反应原理可知:氧化还原反应的特征是有单质生成B. 方法二优于方法一的主要原因是制备过程中不产生氯气C. 方法一中盐酸既表现出还原性,又表现出酸性D. 氯气属于离子化合物7、现有一混合物的水溶液,只可能含有以下离子中的若干种:Na +,NH 4+,Ca 2+ ,Ba 2+,Cl -,CO 32-, SO 42-,现用三份该溶液进行如下实验:(1) 向第一份溶液加入硝酸银溶液,有白色沉淀;(2) 向第二份溶液加入氯化钡溶液,有白色沉淀生成,继续加入足量盐酸发现沉淀减少;(3) 向第三份溶液加入氢氧化钠溶液并加热,未观察到明显现象.执笔:肖建清 审核:姚登银2根据上述实验以下推断正确的是(BD)A.该溶液中一定存在Cl- B该溶液中一定存在Na+C 该溶液中一定存在Ba2+和NH4+ D该溶液中一定存在SO42-和CO32-8、用铝屑,稀硫酸,氢氧化钠溶液制备Al(OH)3有如下三种方案:方案一:2Al+3H2SO4=Al2(SO4)3+3H2↑ Al2(SO)3+6NaOH=2Al(OH)3↓+3Na2SO4方案二:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4方案三: 2Al+3H2SO4=Al2(SO4) 3 +3H2↑2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2(SO4)3+ 6NaAlO2+12H2O=8Al(OH)3↓+3Na2SO4欲制取相同质量的Al(OH)3(假设原料的利用率为100%),有关说法正确的是(AC)A. 三种方案中产生氢气的质量相等 B三种方案中消耗铝屑的质量不相等C. 方案三中消耗的硫酸质量最小 D 方案二中消耗氢氧化钠的质量最小9、有关专家提出”以废治废”的治理污染新思路,并且起到了一定的成效。

初三化学竞赛试题及答案一、选择题(每题2分,共20分)1. 物质的量是表示一定数目粒子的集合体,其单位是摩尔。
1摩尔任何物质都含有相同数目的粒子,这个数目以阿伏伽德罗常数(NA)表示。
请问,阿伏伽德罗常数的数值最接近以下哪个数值?A. 6.02×10^23 mol^-1B. 6.02×10^24 mol^-1C. 6.02×10^25 mol^-1D. 6.02×10^26 mol^-12. 根据题目1的描述,1摩尔氢气含有的氢原子数是多少?A. 2NAB. NAC. 2NAD. 3NA3. 以下哪种物质属于电解质?A. 金属铜B. 蒸馏水C. 硫酸D. 石墨4. 原子核外电子排布遵循的规律不包括以下哪一项?A. 能量最低原理B. 泡利不相容原理C. 洪特规则D. 同位旋规则5. 以下哪种反应属于氧化还原反应?A. 酸碱中和反应B. 金属与酸反应C. 碳酸钙受热分解D. 水的电解二、填空题(每空1分,共10分)1. 化学方程式表示的意义包括反应物和生成物的种类、反应的条件、反应物和生成物的________(物质的量比)、反应物和生成物的________(微观粒子数比)。
2. 根据题目1,2H2 + O2 → 2H2O 表示2个氢分子和1个氧分子反应生成2个水分子,其反应物和生成物的微观粒子数比为________。
三、计算题(共10分)1. 已知某化合物中碳元素的质量分数为40%,氢元素的质量分数为6.7%,其余为氧元素。
试求该化合物的实验式。
四、实验题(共10分)1. 描述如何通过实验确定某溶液是酸性还是碱性,并说明实验原理。
初三化学竞赛试题答案一、选择题1. A2. B3. C4. D5. B二、填空题1. 质量比,微观粒子数比2. 2:1三、计算题根据题目,设化合物的实验式为CxHyOz,根据质量分数可得:12x : y : 16z = 40% : 6.7% : (100% - 40% - 6.7%)通过计算,可以得到x : y : z的比值,进而确定实验式。

九中化学竞赛试题及答案一、选择题(每题2分,共10分)1. 下列元素中,属于碱金属的是:A. 钠B. 钾C. 钙D. 钡答案:A2. 根据元素周期表,下列元素中原子半径最大的是:A. 氢B. 锂C. 钠D. 钾答案:D3. 以下化合物中,属于共价化合物的是:A. NaClB. CaOC. H2OD. Fe答案:C4. 在化学反应中,氧化还原反应的特征是:A. 有元素的化合价变化B. 有气体生成C. 有沉淀生成D. 有颜色变化答案:A5. 根据化学平衡原理,下列说法正确的是:A. 增加反应物浓度,平衡不移动B. 增加反应物浓度,平衡向正反应方向移动C. 增加反应物浓度,平衡向逆反应方向移动D. 增加反应物浓度,平衡不受影响答案:B二、填空题(每题3分,共15分)1. 元素周期表中,第IA族元素的原子最外层电子数为______。
答案:12. 根据酸碱中和反应的原理,盐酸和氢氧化钠反应生成的盐是______。
答案:氯化钠3. 化学方程式2H2 + O2 → 2H2O中,氧气的化学计量数是______。
答案:14. 根据质量守恒定律,化学反应前后______不变。
答案:元素种类和质量5. 标准状况下,1摩尔任何气体的体积约为______升。
答案:22.4三、简答题(每题5分,共20分)1. 描述什么是氧化还原反应,并给出一个例子。
答案:氧化还原反应是指在化学反应中,原子或离子之间发生电子转移的过程。
例如,铁与稀盐酸反应生成氯化亚铁和氢气,铁被氧化,氢被还原。
2. 解释为什么说水是生命之源?答案:水是生命之源,因为它是所有生物体内化学反应的介质,参与细胞内物质的运输,调节体温,并且是构成生物体的基本组成部分。
3. 简述化学平衡的移动原理。
答案:化学平衡的移动原理是指在一定条件下,当一个化学反应达到平衡状态时,如果改变反应条件,如温度、压力或浓度,平衡会向能够减弱这种改变的方向移动。
4. 描述元素周期表的结构及其对化学元素分类的意义。

初三化学竞赛试题及答案一、选择题(每题2分,共20分)1. 下列物质中,属于混合物的是()A. 氧气B. 蒸馏水C. 空气D. 纯碱答案:C2. 化学变化的本质特征是()A. 有气体生成B. 有沉淀生成C. 有新物质生成D. 有颜色变化答案:C3. 下列物质中,属于单质的是()A. 二氧化碳B. 氢气C. 氧化钠D. 氯化钠答案:B4. 根据质量守恒定律,下列说法正确的是()A. 反应物的质量总和等于生成物的质量总和B. 反应物的质量总和小于生成物的质量总和C. 反应物的质量总和大于生成物的质量总和D. 反应物的质量总和可能等于生成物的质量总和答案:A5. 金属活动性顺序中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属不能置换出酸中的氢,据此判断,下列叙述中正确的是()A. 铜能与稀盐酸反应生成氢气B. 铁能与硫酸铜溶液反应生成铜C. 镁能与稀盐酸反应生成氢气D. 银不能与稀盐酸反应生成氢气答案:D6. 根据金属活动性顺序,下列金属中,活动性最强的是()A. 铁B. 铜C. 锌D. 银答案:C7. 根据金属活动性顺序,下列金属中,活动性最弱的是()A. 铁B. 铜C. 锌D. 银答案:D8. 根据金属活动性顺序,下列金属中,能与稀硫酸反应生成氢气的金属是()A. 铁B. 铜C. 锌D. 银答案:A9. 根据金属活动性顺序,下列金属中,不能与稀硫酸反应生成氢气的金属是()A. 铁B. 铜C. 锌D. 银答案:B10. 根据金属活动性顺序,下列金属中,能与硫酸铜溶液反应生成铜的金属是()A. 铁B. 铜C. 锌D. 银答案:A二、填空题(每题2分,共20分)11. 空气的成分主要包括氮气、氧气、稀有气体、二氧化碳、水蒸气和其他气体和杂质。
其中,氧气的体积分数约为21%,氮气的体积分数约为78%,稀有气体的体积分数约为0.94%。
12. 金属活动性顺序中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属不能置换出酸中的氢。

初三年级化学竞赛试题答案一、选择题1. 化学变化的基本特征是(C)A. 有新物质生成B. 有能量变化C. 有新物质生成和能量变化D. 有颜色变化2. 根据质量守恒定律,下列说法正确的是(B)A. 化学反应前后元素的种类会改变B. 化学反应前后原子的种类、数目不变C. 化学反应前后物质的总质量会减少D. 化学反应前后物质的总质量会增加3. 根据题目所给的化学反应方程式,计算生成物的质量,正确的选项是(D)[具体计算过程需要根据题目所给的化学反应方程式进行]4. 根据题目所给的实验操作,正确的操作步骤是(A)[具体操作步骤需要根据题目所给的实验操作进行分析]5. 根据题目所给的化学概念,下列说法错误的是(C)A. 单质是由同种元素组成的纯净物B. 化合物是由不同种元素组成的纯净物C. 混合物是由多种物质组成的物质D. 氧化物是由两种元素组成的化合物,其中一种是氧元素二、填空题1. 根据题目所给的化学方程式,填写反应物和生成物的化学式:[根据题目所给的化学方程式进行填写]2. 根据题目所给的实验现象,填写相应的化学概念:[根据题目所给的实验现象进行填写]3. 根据题目所给的化学性质,填写相应的化学元素或化合物:[根据题目所给的化学性质进行填写]三、简答题1. 请简述质量守恒定律的含义及其应用。
[质量守恒定律是指在化学反应中,反应前后物质的总质量保持不变。
它在化学实验设计、化学反应的定量分析等方面有重要应用。
]2. 请描述实验中观察到的某种化学反应现象,并解释其原因。
[根据题目所给的实验现象进行描述和解释]四、计算题1. 根据题目所给的化学反应方程式和已知条件,计算生成物的质量。
[根据题目所给的化学反应方程式和已知条件,列出比例式进行计算]2. 根据题目所给的溶液浓度和体积,计算溶质的质量。
[根据溶液的浓度和体积,应用公式进行计算]五、实验题1. 根据题目所给的实验目的和材料,设计一个简单的化学实验,并描述实验步骤和预期结果。

初中化学竞赛试题说明:1、考试时间:2小时2、本试卷共6页,满分100分。
附加题20分计入总分。
答案必须写在答题卷上。
3、可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24Si:28 S:32 C1:35.5 Fe:56 Cu.:64 Zn:65 Ba:137一、选择题(本题包括15个小题,每小题2分,共30分。
每小题有1个或2个选项符合题意。
若有两个答案的错1个不得分,漏选1个扣1分。
)1、为了警示世人因气候变化对人类危害的关注,2009年“世界环境日”的主题是:“团结起来应对气候变化”。
下列做法或认识不符合这—主题的是A、提倡乘坐公共交通、骑自行车或步行的方式出行B、在生产和生活活动中提倡使用节能技术和节能用具C、植树造林,严禁乱砍滥伐D、广泛使用酒精、沼气,既可解决能源问题,也有利减轻温室效应2、分类法是一种行之有效、简单易行的科学方法。
某同学用下表所示形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。
下列各组中,有错误的组合是选项甲乙、丙、丁A 常见干燥剂浓硫酸、石灰石、碱石灰B 常见合金不锈钢、焊锡、生铁C 常见营养物质蛋白质、维生素、无机盐D 常见碱烧碱、纯碱、熟石灰3、2008年诺贝尔化学奖授予钱永健等发明的绿色荧光蛋白标记技术,这项发明为细胞生物学和神经生物学的发展带来一场革命,对我们理解绿色荧光蛋白如何发光作出了贡献。
绿色荧光蛋白分子中含有氨基(一NH2,具有碱的性质)和羧基(一COOH,具有酸的性质)。
该分子具有的性质是A、只能与硫酸反应,不能与氢氧化钾反应B、只能与氢氧化钾反应,不能与硫酸反应C、既能与硫酸反应,又能与氢氧化钾反应D、既不能与硫酸反应,又不能与氢氧化钾反应4、1~18号元素中X元素的原子最外层只有1个电子,Y元素的原子的第三层有6个电子,Z元素的第二层也有6个电子,在化合物中只有Z元素的化合价为负。
由这三种元素组成的化合物的化学式可能是A、XYZ4B、X2YZ3C、X3YZ4D、XYZ3 5.咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通肥皂洗涤时,会发现黄色污渍变为红色,浸泡在水中后红色又变黄色。
欢迎阅读初三化学竞赛试题及答案可能用到的原子量:H : 1 C : 12 O : 16 Na : 23 Mg : 24 Al : 27Cl : 35.5 K : 39 Ca : 40 Fe : 56 Cu : 64 Ba : 137一、下列每小题分别有1个或2个选项符合题意,请把符合题意的答案的标号填在答题纸相应的空格里,每小题2分,本大题共40分。
1.1803年,道尔顿(英)提出原子学说,对化学发展起了推动作用。
其主要论点有:①物质是由原子构成的;②原子是微小的、不可分割的实心球体;③同种原子的性质和质量都相同。
从现A2A3A45.1C678A.饱和石灰水(二氧化碳)B.稀硫酸(氯化钡)C.氢氧化钙的饱和溶液(碳酸钠和消石灰)D.稀盐酸(水)9.分别向Na2CO3、(NH4)2SO4、NaCl、NH4Cl四种溶液中加入下列一种试剂,便可将它们鉴别出来,这种试剂是()A.盐酸B.氯化钙溶液C.氢氧化钠溶液D.氢氧化钡溶液10.在溶液中可以相互反应生成硫酸铜的是()A.Cu+H2SO2(稀) B.CuO+H2SO4C.Cu(OH)2+Na2SO4D.CuCl2+Na2SO411.KClO3和KCl的混合物中含KCl a克,加热分解完全后,KCl的质量是2a克,则原混合物中KClO3和KCl的质量比约是()A .1 : 1B .2 : 1C .1.64 : 1D .1.5 : 112.在一定条件下,同一反应进行的快慢与反应物的浓度成正比。
现用100克质量百分比浓度为30%的硫酸溶液与过量的镁粉反应,为了使反应慢一点而不影响生成氢气的总量,可向所用的硫酸中加入适量的( )A .氢氧化钠B .水C .硫酸钾溶液D .碳酸钠溶液 13.下列有关实验操作的叙述,正确的是( ) A .用100毫升量筒量取8.5毫升水B .在台式天平的左右盘中各放一纸片,调平后,左盘放药品,右盘放砝码并调整游码,称取一定质量的氢氧化钠固体C .加热试管前,用抹布将试管外壁擦干,以防试管受热不匀而破裂D .在看到氢气发生器中稀硫酸与锌粒反应开始产生较多气泡时,即可在气体导出管口点燃氢气14)A 15 16HCl 和NaCl 17 18 21(1 (3(522氨气。
初三化学竞赛试题及答案一、选择题(每题2分,共20分)1. 下列物质中,属于混合物的是()A. 空气B. 蒸馏水C. 纯碱D. 铁矿石答案:A2. 以下化合物中,含有氧元素的是()A. NaClB. CuSO4C. CaCO3D. Na2CO3答案:D3. 根据质量守恒定律,化学反应前后不变的是()A. 元素的种类B. 物质的种类C. 分子的数目D. 分子的质量答案:A4. 下列物质中,属于单质的是()A. 氧气C. 二氧化碳D. 氯化钠答案:A5. 根据金属活动性顺序,下列金属中,最活泼的是()A. 铁B. 铜C. 银D. 金答案:A6. 根据酸碱盐的性质,下列物质中,属于碱的是()A. 硫酸B. 氢氧化钠C. 碳酸钠D. 氯化钠答案:B7. 根据化学反应的类型,下列反应中,属于复分解反应的是()A. 铁与硫酸反应B. 碳酸钙与盐酸反应C. 氧化铜与氢气反应D. 碳与氧气反应答案:B8. 下列物质中,属于氧化物的是()B. 氧气C. 二氧化碳D. 氢气答案:C9. 根据溶液的酸碱性,下列溶液中,呈酸性的是()A. 碳酸钠溶液B. 硫酸溶液C. 氢氧化钠溶液D. 氯化钠溶液答案:B10. 下列物质中,属于酸的是()A. 硫酸B. 碳酸钠C. 氢氧化钠D. 氯化钠答案:A二、填空题(每题2分,共20分)1. 氢气在氧气中燃烧生成______。
答案:水2. 铁在潮湿的空气中容易生锈,这是因为铁与______和氧气发生了反应。
答案:水3. 根据金属活动性顺序,排在氢前面的金属可以与酸反应生成______。
答案:氢气4. 碳酸钠的化学式是______。
答案:Na2CO35. 氧化钙与水反应生成______。
答案:氢氧化钙6. 硫酸铜溶液与铁反应生成______和硫酸亚铁。
答案:铜7. 根据酸碱盐的性质,氢氧化钠属于______。
答案:碱8. 根据化学反应的类型,碳酸钙与盐酸反应属于______反应。
答案:复分解9. 根据溶液的酸碱性,硫酸溶液呈______性。
初中化学应用知识竞赛初赛样题考试时间:60分钟,总分:100分;姓名______________ 评分______________________ 相对原子质量H —1 C —12 O —16 Na —23 Mg —24 S—32 Cl —35.5 K —39 Ca—40 Cu--64一、精挑细选,每小题有1个或2个正确的答案哦!(每小题2分,共30分)1、健康的食品关系千家万户,下列有关做法中,合理的是A •用工业石蜡或滑石粉给瓜子抛光、美容”B •用明胶+色素”制作人造鱼翅”C •用适量的小苏打使面包松软可口D •将过期奶粉掺入合格奶粉继续售卖2、下列关于环境保护问题的叙述中,错误的是()A •“绿色化学”是指对环境产生负面影响的化学B •“白色污染”主要是指白色粉尘等对环境造成的污染C •“温室气体”主要是指二氧化碳、甲烷等气体D. “酸雨”是由大气中含硫和和氮的氧化物等导致的3、元素X的氢氧化物的化学式为X(OH)m ,元素Y的钾盐的化学式为KnY,则X与Y两元素组成化合物的化学式为()A • XmYn B. YmXn C. XnYm D. YnXm4、近年来赤潮在我国时有发生,当赤潮发生时,海水中的某些微小浮游生物大量繁殖,使水体呈红、紫等颜色,并对生物造成危害。
下列说法中,不正确的是()A •赤潮是水体富营养化的结果B •含磷洗衣粉广泛使用与排放是发生赤潮的主要原因之一C.在封闭的海湾更易发生赤潮 D .赤潮的发生是与人类活动无关的自然现象5、已知镁在空气中燃烧时,会发生如下两个反应3Mg+N 2=Mg 3N2 2Mg+O 2=2MgO则24g镁在空气中完全燃烧所得产物的质量为()A .等于33.3gB .等于40gC • 33.3g---40g 之间D .小于33.3g 或大于40g6、原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2—1.下列有关X的说法不正确的是()A、X能形成化学式为X(OH)3的物质 B . X可能形成化学式为KXO 3的物质C . X原子的最外层电子数和核电荷数肯定为奇数D . X能与某些金属元素形成化合物)第1页共10页7、氢气将是一种很有前途的新能源。
20**年黄高优录考试选拔赛试卷3 可能用到的相对原子质量: H-1 O-16 C-12 S-32 Na-23 Fe-56 CI-35.5 N-14Ca-40、选择题(本题包括 12个小题,每小题3分,共36分。
每小题有1个或2个选项符合1、 著名的居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些特定的粒子。
一种元素的原子经过放射变成了另一种元素的原子,据此推断放射出的粒子一定是 A. 电子 B. 中子 C. 质子 D. 原子核2、 人体是一座元素的“仓库”,地壳中天然存在的化学元素,大多数能在人体中找到,其 中含量最高的元素是A. 氢B. 碳C. 氧D. 钙3、 科学家最近在-100 C 的低温下合成一种化合物X ,此分子的模型如下图,其中每个• 代表一个碳原子,每个O 代表一个氢原子。
下列说法中不正确的是备 A •该分子的分子式为 C 5H 4B .该分子中碳元素的质量分数是 93.75%C .该分子中的氢原子与碳原子的个数比是 4:5( D •等质量的该物质与甲烷相比,燃烧时消耗的氧气更多/ 4、 已知R 元素的相对原子质量 m 与其原子核内的质子数和中子数之和在数值上相等。
若 核外有x 个电子,则其原子核内的中子数为A. m- x +2B. m +x - 2C. m - x - 2D. m +x - 25、 在反应X+2J R+2M 中,已知R 和M 的相对分子质量之比为 1:2,当1.5 gX 和一定量的Y充分反应后,生成了 3.6 gM 。
则在上述反应中,参加反应的X 和Y 的质量比为 A.1:2 B.2:1 C.1:4 D.4:16、 某学生用托盘天平称量 5.5 gKCI 晶体(1 g 以下用游码),称量时误将药品与砝码的位 置颠倒。
该学生所称 KCl 的实际质量是A.6 gB.5.5 gC.5.0 gD.4.5 g7、 与Na +具有相同质子数和电子数的微粒是A.F 一B.NH 4+ C.OH 一 D.H 2。