人教版高中化学必修一课件第一章第二节(2)
- 格式:pptx
- 大小:237.32 KB
- 文档页数:21




化学的研究对象和任务研究物质的组成、结构、性质以及变化规律创造新物质,探索物质世界的奥秘为工农业生产、国防建设、环境保护等提供科学依据和技术支持研究高效、清洁的能源开发和利用技术,如太阳能、风能等可再生能源的转化和存储。
化学与能源研究环境污染的治理和生态保护,如大气、水体和土壤污染的化学原理和控制技术。
化学与环境研究新材料的合成、改性和应用,如高分子材料、纳米材料等的制备和性能。
化学与材料研究生命过程中的化学变化,如生物大分子的合成与分解、药物设计与合成等。
化学与生命化学与生产生活的关系高中化学课程分为必修和选修两部分,其中必修课程包括化学1和化学2两个模块。
化学1模块主要包括物质的组成与结构、化学反应与能量转化、化学物质的性质与应用等内容。
化学2模块则涵盖了化学反应原理、物质结构与性质、有机化学基础等知识点。
通过高中化学课程的学习,学生可以掌握基本的化学知识和技能,培养科学思维和实验能力,为未来的学习和工作打下坚实的基础。
0102030405高中化学课程的结构和内容03原子由原子核和核外电子构成,原子核由质子和中子组成,质子带正电荷,中子不带电荷,核外电子带负电荷。
原子结构元素周期表是按照原子序数递增的顺序排列的表格,包括7个横行(周期)和18个纵列(族),每个元素在周期表中都有特定的位置。
元素周期表元素的性质与其在周期表中的位置密切相关,包括金属性、非金属性、氧化性、还原性等。
元素性质原子结构与元素周期表分子结构与化学键分子结构分子由原子通过化学键连接而成,分子结构决定了物质的性质和用途。
化学键化学键是连接原子的作用力,包括离子键、共价键、金属键等。
离子键是阴阳离子间的静电作用,共价键是原子间通过共用电子对形成的相互作用,金属键是金属原子间通过自由电子形成的相互作用。
分子间作用力分子间存在相互作用力,包括范德华力、氢键等。
范德华力是分子间瞬时偶极矩的相互作用,氢键是氢原子与电负性较大的原子(如N、O、F)之间的相互作用。


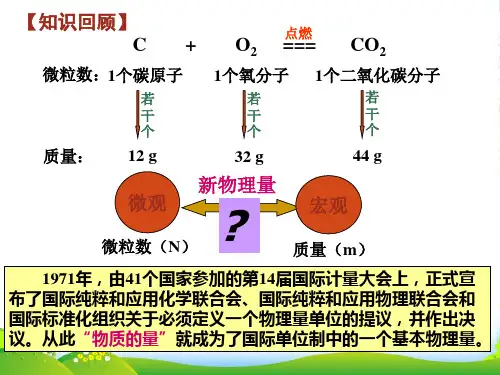
第一章从实验学化学§1.2 化学计量在实验中的应用(第一课时)主备人:张爱丽时间:2009年9月4日课程标准:认识摩尔是物质的量的基本单位,能用于进行简单的化学计算,体会定量研究的方法对研究和学习化学的重要作用省教学要求:掌握物质的量的定义、符号及摩尔的定义、符号,了解阿伏加德罗常数的涵义掌握摩尔质量的概念,理解物质的量、摩尔质量、物质的质量之间的关系教学目标:知识与技能:1、使学生认识摩尔是物质的量的基本单位,了解物质的量与微观粒子之间的关系;了解摩尔质量的概念。
2、了解提出摩尔这一概念的重要性和必要性,懂得阿伏加德罗常数的涵义。
3、使学生了解物质的量、摩尔质量、物质的质量之间的关系。
能用于进行简单的化学计算。
4、初步培养学生演绎推理、归纳推理、逻辑推理和运用化学知识进行计算的能力。
过程与方法:1、培养学生计算能力,并通过计算帮助学生更好地理解概念和运用、巩固概念。
2、培养学生的逻辑推理、抽象概括能力。
情感态度与价值观:通过对概念的透彻理解,培养学生严谨、认真的学习态度,体会定量研究的方法对研究和学习化学的重要作用。
教学重点:物质的量及其单位教学难点:物质的量及其单位教学方法:启发、诱导、讨论、分析、对比、讲授、归纳等方法教学过程:Ⅰ、课前检测(1)1 mol氧。
()(2)0.25 mol CO2。
()(3)摩尔是7个基本物理量之一。
()(4)1 mol小麦含有6.02×10 23个麦粒。
()2、已知1mol水分子数为6.02×10 23个,则0.5mol水分子数为_________个2 mol水分子数为___________个。
【小组讨论2】你能得出物质的量(n)与微粒个数(N)和阿佛加德罗常数(N A)的关系吗?【师生共同探讨2】 4、物质的量(n)与微粒个数(N)和阿伏加德罗常数(N A)的关系n=N/N A【练习】例1:6.02×1022个N aCl分子,其物质的量为多少?2.5mol O2含有多少个O原子?【小组讨论3】请大家回顾表1、表2,思考:1molH20与1mol铝质量相等吗?【师生共同探讨3】 1mol任何粒子集体中都含有6.02×10 23 个粒子;而1mol任何粒子或物质的量以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。