新教材高中化学必修一第二节元素周期律
- 格式:ppt
- 大小:3.54 MB
- 文档页数:40

可编辑修改精选全文完整版(新教材)人教版高中化学必修1第四章第2节《元素周期律》优质说课稿(新教材)人教版高中化学必修一第四章第2节《元素周期律》优质说课稿今天我说课的内容是部编人教版(新教材)高中化学必修1第四章第2节《元素周期律》。
丰富多彩的物质世界是由一百多种元素组成的。
那么,这些元素之间有什么内在联系吗?它们是如何相互结合形成多种多样的物质呢?最初,人们是通过分类整理的方法对元素之间的联系进行研究的。
随着元素周期表的建立和元素周期律的发现,特别是原子结构的奥秘被揭示,人们从微观角度探索元素之间的内在联系,进一步认识了元素性质及其递变规律,并通过研究粒子间的相互作用,认识化学反应的本质;逐步建立了结构决定性质的观念。
通过第四章学习,从宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知、科学探究与创新意识、科学态度与社会责任5个方面培养学生化学学科核心素养。
本章共有三节,本课是第二节,主要讲述元素周期律,承载着实现本章教学目标的任务。
为了更好地教学,下面我将从课程标准、教材分析、教学目的和核心素养、教学重难点、学情分析、教学准备、教学方法、教学过程等方面进行说课。
一、说课程标准。
普通高中化学课程标准(2017版2020年修订):【内容要求】“ 3.1 原子结构与元素周期律:结合有关数据和实验事实认识原子结构、元素性质呈周期性变化的规律,建构元素周期律。
知道元素周期表的结构,以第三周期的钠、镁、铝、硅、硫、氯,以及碱金属和卤族元素为例,了解同周期和主族元素性质的递变规律。
体会元素周期律(表)在学习元素化合物知识与科学研究中的重要作用。
”二、说教材。
本课是人教版化学必修1第四章《物质结构元素周期律》第二节内容,“元素周期律”是高中化学必修课程中的核心内容之一,是高中一年级学习的重点内容。
本节要在初中知识的基础上进一步加深学习周期表中同周期元素的性质变化规律。
人们从微观角度探索元素之间的内。





第四章元素周期律第2节元素周期性表和元素周期律的应用(二课时)“元素周期表”是必修一模块第四章。
新课程标准对本节内容要求是:认识原子结构、元素性质与元素在元素周期表中位置的关系。
知道元素和核素的含义,了解原子核外电子的排布。
结合有关数据和实验事实认识原子结构、元素性质呈现周期性变化的规律,构建元素周期律。
知道元素周期表的结构,以第三周期的钠、镁、铝、硅、硫、氯,以及碱金属和卤族元素为例,了解同周期和主族元素性质的递变规律。
给出的活动与探究建议是:查阅元素周期律的发现史料,讨论元素周期律的发现对化学科学发展的重要意义。
元素周期律这部分内容始终是高中化学概念理论部分的重点内容之一。
在新课程中,更加关注概念理论知识的建构过程和各部分知识间的联系。
课程标准规定或建议的核心教学活动凸现了概念理论的建构过程,更注重科学学习方法的教育。
元素周期律是对元素性质呈现周期性变化实质的揭示,通过本节的学习,可以使学生对以前学过的知识进行概括、综合,实现由感性认识上升到理性认识,同时也会以此理论来指导后续学习,所以学好元素周期律是十分重要的。
这一课时的内容是:首先归纳周期和主族的性质递变规律,对元素周期表和元素周期律进行整体分析,然后引导元素周期表和元素周期律的应用,体现结构、位置、性质之间的相互联系与有机统一关系。
通过本节的学习,可以使学生对以前学过的知识进行概括、综合,实现由感性认识上升到理性认识,之后再以理性认识指导后续学习实践的跨越。
【宏观辨识与微观探析】1、知道元素周期表的简单分区。
【证据推理与模型认知】1、进一步认识元素周期表是元素周期律的具体表现形式。
2、学会运用元素周期表、元素周期律的有关知识,指导科学研究和工农业生产。
3、通过元素周期律、元素周期表的应用的探究,培养学生科学态度与社会责任、证据推理与模型认知能力。
1、对元素周期表结构和规律的认知。
2、金属性和非金属性的判断和归纳。
3、对“位”“构”“性”的认识。




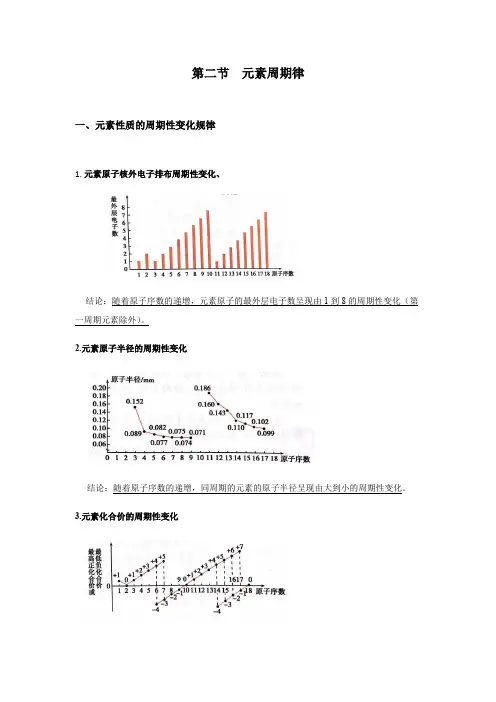
第二节元素周期律一、元素性质的周期性变化规律1.元素原子核外电子排布周期性变化、结论:随着原子序数的递增,元素原子的最外层电子数呈现由1到8的周期性变化(第一周期元素除外)。
2.元素原子半径的周期性变化结论:随着原子序数的递增,同周期的元素的原子半径呈现由大到小的周期性变化。
3.元素化合价的周期性变化结论:随着原子序数的递增,元素的最高正价呈现由+1到+7、最低负价呈现由-4到-1的周期性变化。
【总结】短周期元素微粒半径和化合价规律(1)半径比较:①“三看”法“一看”电子层数:当电子层数不同时,一般电子层数越多,半径越大。
如r(Na)>r(Li)“二看”核电荷数:当电子层数相同时,核电荷数越大,半径越小。
如r(Na)>r(Mg)“三看”核外电子数:当核电荷数相同时,核外电子数越多,半径越大。
如r(Fe2+)>r(Fe3+)②参照物比较法不同周期、不同主族时,可根据元素周期表中的相对位置及变化规律,选择一种元素作为“桥梁”来比较。
如Rb和Ca比较,因r(K)>r(Ca),r(Rb)>r(K),所以r(Rb)>r(Ca)。
(1)短周期元素化合价规律①在短周期中,元素原子的最外层电子数= 元素的最高正化合价(O、F除外)。
②F无正价,只有0价和-1价;O没有最高正价,O除了与F形成化合物显正价外,在其他化合物中都显负价。
③|元素最低负价| + 最高正价= 8(H、O、F除外)【例1】下列粒子半径大小的比较中,正确的是()A.Na+<Mg2+<Al3+<O2-B.S2->Cl->Na+>Al3+C.Na<Mg<Al<SD.Cs+>Rb+>Na+>K+【答案】B【例2】X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。
下列说法正确的是()A.原子最外层电子数:X>Y>ZB.单质沸点:X>Y>ZC.离子半径:X2->Y+>Z-D.原子序数:X>Y>Z【答案】D4.元素金属性和非金属性的周期性变化(1)探究第三周期元素性质的递变①镁与水反应镁能够与废水反应,生成氢气和氢氧化镁:Mg + 2H2OMg(OH)2↓+ H2↑;镁与水反应不如与钠反应剧烈②氢氧化铝的性质两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物。
【高中化学】元素周期律元素周期表及一些元素性质【高中化学】元素周期律元素周期表及一些元素性质一、元素周期定律(1)掌握同周期元素及其化合物性质的递变规律;同主族元素及其化合物性质的递变规律,理解元素周期律的实质。
(2)根据元素原子结构的特征或性质,可以推断未知元素的金属强度和非金属性质、元素的价态和化学式等。
(3)微粒的半径大小比较判断规律:① 电子层越多,半径越大;电子层数越小,半径越小。
②当电子层结构相同时,核电荷数多的半径小,核电荷数少的半径大。
③ 对于同一元素的不同粒子,原子核外的电子数越多,半径越大;原子核外的电子数越小,半径越小。
例如:。
二、元素周期表(1)周期表的结构:周期、族、若干水平行和若干垂直行;(2)同周期、同主族元素的性质递变规律:① 最高价氧化物对应于水合物的酸碱度;在同一时期,碱度从左到右降低,酸度增加,同一组碱度增加,酸度从上到下降低;②气态氢化物的稳定性;同周期从左到右稳定性增强,同族从上到下稳定性减弱;(3)元素在周期表中的位置与原子结构和元素性质之间的关系:①电子层数=周期数;② 最外层电子数=主族数=最高正价数;③结构、位置、性质之间的相互关系。
(4)掌握两性氧化物和氢氧化物的概念。
(5)周期表中特殊位置的元素① 其族序数等于圈数的元素:H,be,al。
②族序数等于周期数2倍的元素:c、s。
③ 族数等于周期数三倍的元素:o。
④周期数是族序数2倍的元素:li。
⑤ 周期数是族数三倍的元素:Na。
⑥最高正价与最低负价代数和为零的短周期元素:c、si。
⑦ 最高正价格为最低负价格绝对值三倍的短期要素:s。
⑧除h外,原子半径最小的元素:f。
⑨ 短周期内离子半径最大的元素:s。
⑩最高正价化合价不等于族序数的元素:o、e。
三、元素性质、存在和使用的特殊性(1)形成化合物种类最多的元素或单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最大的元素:c。
(2)空气中最丰富的元素或气态氢化物水溶液中最丰富的碱性元素:n。
高中化学教材目录(新部编人教版)高中化学-必修一绪言2第一章物质及其变化5第一节物质的分类及转化6第二节离子反应13第三节氧化还原反应20整理与提升27第二章海水中的重要元素——钠和氯31第一节钠及其化合物32第二节氯及其化合物41第三节物质的量49整理与提升58★实验活动1配制一定物质的量浓度的溶液61第三章铁金属材料63第一节铁及其化合物64第二节金属材料73整理与提升81★实验活动2铁及其化合物的性质84第四章物质结构元素周期律85第一节原子结构与元素周期表86第二节元素周期律101第三节化学键107整理与提升111★实验活动3 同周期、同主族元素性质的递变115附录Ⅰ实验室突发事件的应对措施和常见废弃物的处理方法116附录Ⅱ一些化学品安全使用标识117附录Ⅲ名词索引119附录Ⅳ部分酸、碱和盐的溶解性表(室温)120附录Ⅴ一些常见元素中英文名称对照表121附录Ⅵ相对原子质量表122元素周期表………………………………………………………………………………………………………………………■探究●钠与水的反应34●利用覆铜板制作图案70●碱金属化学性质的比较94●第三周期元素性质的递变103■研究与实践●了解纯碱的生产历史39●检验食品中的铁元素71●认识元素周期表99 ■方法导引●分类7●模型16●实验室中制取气体装置的设计46●认识元素及其化合物性质的视角69●预测96■化学与职业●化学科研工作者11●水质检验员47●测试工程师75●科技考古研究人员91………………………………………………………………………………………………………………………高中化学-必修二第五章化工生产中的重要非金属元素1第一节硫及其化合物2第二节氮及其化合物11第三节无机非金属材料19整理与提升26★实验活动4 用化学沉淀法除去粗盐中的杂质离子29★实验活动5 不同价态含硫物质的转化30第六章化学反应与能量31第一节化学反应与能量变化32第二节化学反应的速率与限度42整理与提升52★实验活动6 化学能转化成电能56★实验活动7 化学反应速率的影响因素57第七章有机化合物59第一节认识有机化合物60第二节乙烯与有机高分子材料67第三节乙醇与乙酸77第四节基本营养物质83整理与提升91★实验活动8 搭建球棍模型认识有机化合物分子结构的特点95★实验活动9 乙醇、乙酸的主要性质96第八章化学与可持续发展97第一节自然资源的开发利用98第二节化学品的合理使用107第三节环境保护与绿色化学117整理与提升123附录Ⅰ名词索引126附录Ⅱ部分酸、碱和盐的溶解性表(室温) 127附录Ⅲ一些常见元素中英文名称对照表128附录Ⅳ相对原子质量表129元素周期表………………………………………………………………………………………………………………………■探究●不同价态含硫物质的转化8●简易电池的设计与制作37●影响化学反应速率的因素43●烃的分子结构70■研究与实践●测定雨水的pH 17●了解车用能源40●了解食品中的有机化合物89●豆腐的制作115 ■方法导引●化学实验设计8●变量控制45●认识有机化合物的一般思路81■化学与职业●化工工程师9●电池研发人员39●营养师88●环境保护工程师121………………………………………………………………………………………………………………………引言1第一章化学反应的热效应3第一节反应热4第二节反应热的计算13整理与提升18第二章化学反应速率与化学平衡21第一节化学反应速率22第二节化学平衡30第三节化学反应的方向41第四节化学反应的调控44整理与提升50实验活动 1 探究影响化学平衡移动的因素53第三章水溶液中的离子反应与平衡55第一节电离平衡56第二节水的电离和溶液的pH 61第三节盐类的水解69第四节沉淀溶解平衡77整理与提升86实验活动2 强酸与强碱的中和滴定89实验活动3 盐类水解的应用92第四章化学反应与电能93第一节原电池94第二节电解池101第三节金属的腐蚀与防护107整理与提升114实验活动4 简单的电镀实验118实验活动5 制作简单的燃料电池119附录Ⅰ某些物质的燃烧热(25℃,101kPa) 120附录Ⅱ某些弱电解质的电离常数(25℃) 121附录Ⅲ常见难溶电解质的溶度积常数(25 ℃) 122附录Ⅳ名词索引123元素周期表………………………………………………………………………………………………………………………■探究●中和反应反应热的测定5●定性与定量研究影响化学反应速率因素24●盐溶液的酸碱性69●反应条件对FeCl3水解平衡的影响73■研究与实践●了解火箭推进剂11●了解汽车尾气的治理39●了解水处理过程中的化学原理84●暖贴的设计与制作112 ■方法导引●图像分析31●定性分析与定量分析67●电解质溶液中的电荷守恒与元素质量守恒72●化学方程式中的变化与守恒95●电化学过程的系统思想与方法103………………………………………………………………………………………………………………………引言2第一章原子结构与性质5第一节原子结构6第二节原子结构与元素的性质18整理与提升30第二章分子结构与性质33第一节共价键34第二节分子的空间结构41第三节分子的结构与物质的性质52整理与提升64第三章晶体结构与性质67第一节物质的聚集状态和晶体的常识68第二节分子晶体与共价晶体78第三节金属晶体与离子晶体86第四节配合物与超分子95整理与提升101实验活动简单配合物的形成104附录名词索引105元素周期表引言1第一章有机化合物的结构特点与研究方法3第一节有机化合物的结构特点4第二节研究有机化合物的一般方法12整理与提升21第二章烃25第一节烷烃26第二节烯烃炔烃32第三节芳香烃41整理与提升48第三章烃的衍生物51第一节卤代烃52第二节醇酚57第三节醛酮66第四节羧酸羧酸衍生物71第五节有机合成82整理与提升91实验活动 1 乙酸乙酯的制备与性质96实验活动2 有机化合物中常见官能团的检验97第四章生物大分子99第一节糖类100第二节蛋白质109第三节核酸118整理与提升123实验活动3 糖类的性质126第五章合成高分子127第一节合成高分子的基本方法128第二节高分子材料132整理与提升146附录名词索引148元素周期表………………………………………………………………………………………………………………………■探究●重结晶法提纯苯甲酸13●乙炔的化学性质35● 1-溴丁烷的化学性质54●羧酸的酸性73●乙酸乙酯的水解75●糖类的还原性104●高吸水性树脂的吸水性能142 ■研究与实践●乙烯的生产和应用39●自制肥皂80●大豆资源的开发和利用116●海水淡化144………………………………………………………………………………………………………………………。
新课标人教版高中化学全部教材目录必修第一册绪言第一章物质及其变化第一节物质的分类及其转化第二节离子反应第三节氧化还原反应整理与提升第二章海水中的重要元素——钠和氯第一节钠及其化合物第二节氯及其化合物第三节物质的量整理与提升实验活动1 配置一定物质的量浓度的溶液第三章铁金属材料第一节铁及其化合物第二节金属材料整理与提升实验活动2铁及其化合物的性质第四章物质结构元素周期律第一节原子结构与元素周期表第二节元素周期律第三节化学键整理与提升实验活动3同周期、同主族元素性质的递变附录Ⅰ实验室突发事件的应对措施和常见废弃物的处理方法附录Ⅱ一些化学品安全使用标识附录Ⅲ名词索引附录Ⅳ部分酸、碱和盐的溶解性表(室温)附录V一些常见元素中英文名称对照表附录V相对原子质量表必修第二册第五章化工生产中的重要非金属元素第一节硫及其化合物第二节氮及其化合物第三节无机非金属材料整理与提升实验活动4 用化学沉淀法去除粗盐中的杂质离子实验活动5 不同价态含硫物质的转化第六章化学反应与能量第一节化学反应与能量变化第二节化学反应的速率与限度整理与提升实验活动6 化学能转化成电能实验活动7 化学反应速率的影响因素第七章有机化合物第一节认识有机化合物第二节乙烯与有机高分子材料第三节乙醇与乙酸第四节基本营养物质整理与提升实验活动8 搭建球棍模型认识有机化合物分子结构的特点实验活动9 乙醇、乙酸的主要性质第八章化学与可持续发展第一节自然资源的开发利用第二节化学品的合理使用第三节环境保护与绿色化学整理与提升附录Ⅰ名词索引附录Ⅱ部分酸、碱和盐的溶解性表(室温)附录Ⅲ一些常见元素中英文名称对照表附录Ⅳ相对原子质量表元素周期表选择性必修1引言第一章化学反应的热效应第一节反应热第二节反应热的计算整理与提升第二章化学反应速率与化学平衡第一节化学反应速率第二节化学平衡第三节化学反应的方向第四节化学反应的调控整理与提升实验活动1 探究影响化学平衡移动的因素第三章水溶液中的离子反应与平衡第一节电离平衡第二节水的电离和溶液的pH第三节盐类的水解第四节沉淀溶解平衡整理与提升实验活动2 强酸与强碱的中和滴定实验活动3 盐类水解的应用第四章化学反应与电能第一节原电池第二节电解池第三节金属的腐蚀与防护整理与提升实验活动4 简单的电镀实验实验活动5 制作简单的燃料电池附录I 某些物质的燃烧热(25℃,101kPa)附录Ⅱ某些弱电解质的电离常数(25℃)附录Ⅲ常见难溶电解质的溶度积常数(25℃) 附录Ⅳ名词索引元素周期表选择性必修2物质结构与性质第一章原子结构与性质知识点1 能层与能级知识点2 基态与激发态原子光谱知识点3 构造原理与电子排布式知识点4 电子云与原子轨道知识点5 泡利原理、洪特规则、能量最低原理知识点6 原子结构与元素周期表知识点7 原子半径知识点8 电离能知识点9 电负性第二章分子结构与性质知识点1 共价键知识点2 键参数--键能、键长和键角知识点3 分子结构的测定知识点4 多样的分子空间结构知识点5 价层电子对互斥模型知识点6 杂化轨道理论简介知识点7 共价键的极性知识点8 分子间的作用力知识点9 溶解性(相似相溶原理)知识点10 分子的手性第三章晶体结构与性质知识点1 物质的聚集状态知识点2 晶体与非晶体知识点3 晶胞知识点4 晶体结构的测定知识点5 分子晶体知识点6 共价晶体知识点7 金属键与金属晶体知识点8 离子晶体知识点9 过渡晶体与混合型晶体知识点10 配合物与超分子实验探究.【实验3-2】配合物的生成(1)【实验3-3】配合物的生成和析出【实验3-4】配合物的颜色【实验3-5】配合物的生成(2)规律方法方法比较物质熔点、沸点高低的方法选择性必修3 有机化学基础第一章有机化合物的结构特点与研究方法知识点1 有机化合物的分类知识点2 有机化合物中的共价键知识点3 有机化合物的同分异构现象知识点4 有机物的表示方法知识点5 有机化合物的分离、提纯知识点6 确定实验式--元素分析知识点7 确定分子式--质谱法知识点8 确定分子结构--波谱分析规律方法方法1 研究有机化合物的一般方法方法2 同分异构体数目的判断方法方法3 同分异构体书写方法第二章烃知识点1 烷烃的结构和性质知识点2 烷烃的系统命名法知识点3 烯烃知识点4 炔烃知识点5 乙炔的实验室制法知识点6 苯知识点7 苯的同系物知识点8 稠环芳香烃实验探究【实验2-1】苯的分子结构【实验2-2】苯的同系物的性质规律方法方法1 解有机物共线、共面问题的通用模板方法2 烃的比较第三章烃的衍生物知识点1 溴乙烷知识点2 卤代烃知识点3 醇知识点4 酚知识点5 乙醛知识点6 醛类知识点7 酮知识点8 羧酸知识点9 酯知识点10 油脂知识点11 酰胺知识点12 有机合成实验探究【实验3-1】溴乙烷的取代反应【探究】1-溴丁烷的化学性质【实验3-2】乙醇的消去反应【实验3-3】乙醇的氧化反应【实验3-4】苯酚的酸性【实验3-5】苯酚的取代反应【实验3-6】苯酚的显色反应【实验3-7】乙醛的氧化反应(银镜反应)悬浊液的反应【实验3-8】乙醛与新制Cu(OH)2【探究】羧酸的酸性第四章生物大分子知识点1 糖类的组成和分类知识点2 单糖知识点3 二糖知识点4 多糖(淀粉、纤维素)知识点5 氨基酸知识点6 蛋白质知识点7 酶知识点8 核酸实验探究【实验4-1】葡萄糖的性质【实验4-2】纤维素的水解【实验4-3】蛋白质的盐析【实验4-4】蛋白质的变性【实验4-5】蛋白质的显色反应第五章合成高分子基础知识知识点1 加成聚合反应知识点2 缩合聚合反应知识点3 通用高分子材料知识点4 功能高分子材料规律方法方法高聚物单体判断的方法。