过氧化氢制取氧气要点共56页
- 格式:ppt
- 大小:6.03 MB
- 文档页数:28

实验室制取氧气知识点总结1.氧气的制备原理:氧气的制备主要依靠一些化学反应,常见的方法包括分解过氧化氢(H2O2)、加热氯酸钾(KClO3)等。
2.分解过氧化氢制取氧气:过氧化氢(H2O2)在催化剂的作用下可以分解为水(H2O)和氧气(O2),这是一种常见的制取氧气的方法。
可以使用锰(IV)氧化物或过氧化锰钾作为催化剂。
3.氯酸钾制取氧气:氯酸钾(KClO3)可以在加热的条件下分解为氧气和氯化钾。
这种方法可以使用加热管或加热瓶进行加热,通过收集氧气来制取氧气。
4.氟酸制取氧气:氟酸(HF)可以与过氧化氢反应,生成氧气。
当过量的过氧化氢和氟酸反应时,会生成氧气和水,可以通过收集氧气来制取氧气。
5.硝酸钾与焦炭制取氧气:硝酸钾(KNO3)可以在高温条件下与焦炭反应,生成氧气和氮气。
这种方法需要通过加热瓶或加热管进行加热,收集气体来制取氧气。
6.实验操作注意事项:在实验室制取氧气时,需要注意以下事项:-操作环境要保持通风良好,确保没有可燃物质存在;-实验过程中要戴好安全眼镜和化学防护手套,避免有毒气体或化学物质的接触;-对于有毒的化学试剂,应在化学废液处置系统中进行处置;-注意控制反应温度和时间,避免温度过高或反应时间过长导致安全问题。
7.氧气的性质和用途:氧气是一种无色、无味的气体。
它对大多数可燃物质具有强氧化性,可以用于燃烧、氧气焊接、氧气割炬等工业应用。
在医疗方面,氧气也被广泛应用于氧疗和抢救等场合。
8.实验的扩展:通过实验室制取氧气,我们可以了解氧气的制备原理、操作方法和注意事项。
同时,也拓宽了我们对氧气的应用领域的认识。
实验的过程带给我们更多的理论知识和实践经验,提高科学实验的能力和安全意识。

过氧化氢制取氧气的步骤
氧气是生命存在的必要物质,利用过氧化氢制取氧气的方法从技术上说,不仅
仅是在实验室里可以实现,也可以在家里居家环境自行实现,现在我们就一起分析一下利用过氧化氢制取氧气的步骤:
首先,准备工作包括:
1、准备好实验器材,实验材料,如重酸(如HCl)、氨水(NH3)、硼酸水溶液等,以及取氧容器,如玻璃瓶等;
2、准备配好H2O2溶液,应用在过氧化氢氧化反应中;
3、准备好接氧用的橡胶管,以及用于收集氧气的容器,如瓶子;
其次,过氧化氢的制备及取氧流程:
1、将重酸(如HCl) 、氨水(NH3)、硼酸水溶液混合,将混合溶液从实验室的
滴定架中滴定进去;
2、将混合液中的HCl溶解后,再加入H2O2;
3、将可溶性混合液和非溶性混合液放入立方体容器中;
4、把橡胶管插入容器,并用玻璃瓶容器收集产生的气泡;
5、等小颗粒结晶完全溶解时,会出现白色烟气,并有助于氧气产生;
6、等气泡收集到瓶中,便可取得氧气;
最后,实验完成后,需要注意几点:
1、实验室要保持通风良好的环境;
2、过氧化氢具有强烈的氧化性和强毒性,所以应做到定期检查,以免出现意
想不到的意外;
3、实验时,要多留意安全操作,如穿防腐手套,工作室用木头工具等;
4、收集好取氧容器,并保存于实验室合适的位置;
以上就是通过过氧化氢制取氧气的步骤,本实验的安全性和可行性较高,但需
要加强安全性,不能忽略任何安全操作,以免出现意外。
总之,认真对待这个过程,可以顺利的制取出氧气,真正的实现利用氧气的目的。

过氧化氢制取氧气的【摘要】本文探讨了过氧化氢制取氧气的方法和应用。
在化学性质部分介绍了过氧化氢的结构和性质,以及它可以被用来制取氧气的原理。
接着介绍了制取氧气的化学方程式和反应条件,以及工业生产和实验室制取氧气的具体方法。
在结论部分讨论了过氧化氢制取氧气在医疗、环境和工业领域的应用,并展望了未来的发展趋势。
通过本文的阐述,读者可以进一步了解过氧化氢制取氧气这一过程的重要性和实际应用。
【关键词】过氧化氢,制取氧气,化学性质,原理,化学方程式,反应条件,工业生产,实验室制取,应用,发展趋势1. 引言1.1 过氧化氢制取氧气的概述过氧化氢是一种常见的化学物质,也被称为双氧水。
它是一种无色、无臭的液体,在常温下呈淡蓝色。
过氧化氢具有强氧化性,可以用于消毒、漂白等各种应用。
过氧化氢还可以被用来制取氧气,这是一种重要的化学反应。
制取氧气是一种重要的化学反应,因为氧气是生物体呼吸和燃烧的重要物质。
过氧化氢制取氧气的过程相对简单,通过适当的条件可以使过氧化氢分解释放出氧气。
这样既可以得到纯净的氧气,又可以实现资源的充分利用。
在实际生产中,过氧化氢制取氧气已经得到了广泛应用。
无论是工业生产还是实验室研究,都可以通过这种方法制取氧气,而且效率高,操作简单。
未来,随着科学技术的不断发展,过氧化氢制取氧气的应用将会越来越广泛,为人类生活带来更多便利和进步。
2. 正文2.1 过氧化氢的化学性质过氧化氢(化学式为H2O2)是一种重要的氧化剂,也是一种带有活性氧的化合物,具有较强的氧化性和漂白性。
其化学性质主要表现在以下几个方面:1. 过氧化氢是一种不稳定的化合物,易分解为水和氧气。
这种分解反应在常温下相当缓慢,但加热或受到光照会加速分解,释放出氧气。
2. 过氧化氢可以发生双原子氧的自由基反应,生成氢氧自由基。
这种自由基具有较强的氧化性,可以与有机物发生氧化反应。
3. 过氧化氢在弱酸性条件下可以发生还原反应,将许多金属氧化物还原为金属。


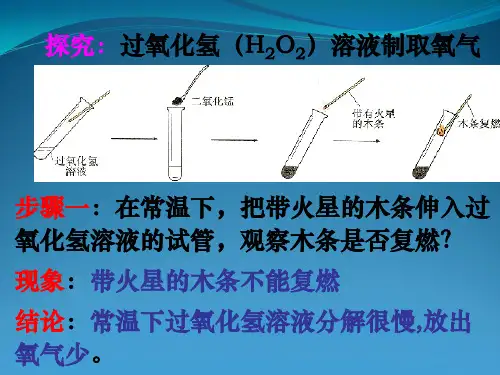

九年级化学分解过氧化氢溶液制取氧⽓
店铺中考频道在考试后及时公布各科中考试题答案和中考作⽂及试卷专家点评,请⼴⼤考⽣家长关注。
时光飞逝,不管情愿与否,⽆论准备与否,我们已⾛进初三,⾛近我们的梦!祝愿决战2014中考的新初三学员能加倍努⼒,在2014年中考中也能取得优异的成绩。
分解过氧化氢溶液制取氧⽓
反应原理:
发⽣装置:由于反应物是固体和液体,反应不需要加热,所以选择固液混合在常温下制取⽓体的装置。
收集装置:由于氧⽓不易溶于⽔,且不与⽔发⽣化学反应,所以可以选择排⽔法收集⽓体的装置。
由于氧⽓的密度⽐空⽓⼤,且不与空⽓中的成分发⽣化学反应,所以可以选择向上排空⽓法收集⽓体的装置。
验满:(⽤排⽔法收集)如果集⽓瓶⼝有⽓泡出现,说明⽓体收集满了。
(⽤向上排空⽓法收集)将带⽕星的⽊条放在集⽓瓶⼝,如果带⽕星的⽊条复燃,说明氧⽓收集满了。
检验:将带⽕星的⽊条伸⼊到集⽓瓶内,如果带⽕星的⽊条复燃,说明是氧⽓。
不能⽤加热过氧化氢溶液的⽅法制取氧⽓!因为加热过氧化氢溶液时,过氧化氢分解产⽣的氧⽓和⽔蒸⽓⼀起逸出,⽔蒸⽓的⼲扰会使带⽕星的⽊条不能复燃。


(2)双氧水(过氧化氢)制取氧气双氧水是一种广泛使用的化学物质,尤其在实验室和工业领域中。
它是一种强氧化剂,可以用于多种应用,包括制备氧气。
以下是双氧水制取氧气的步骤和相关分析。
实验步骤:材料:1.双氧水(H2O2)2.催化剂(例如:二氧化锰,MnO2)3.量筒4.烧杯5.玻璃棒6.计时器7.称量纸8.纸巾9.安全眼镜10.橡皮手套步骤:1.在一个干燥的烧杯中,将一定量的双氧水和催化剂混合在一起。
催化剂的量可以影响制氧气的速率,但不会改变反应的总量。
2.使用玻璃棒搅拌烧杯中的混合物,使其充分接触并开始分解。
3.安装好计时器,并开始计时。
你可以在纸巾上写下一个“开始”字样,以便在稍后确定氧气生成的速率。
4.在氧气产生的过程中,你会注意到有气泡产生。
当氧气以气泡的形式冒出时,使用纸巾轻轻擦拭烧杯的外壁,以便记录氧气产生的时间和速率。
5.当氧气不再产生或产生速率显著降低时,停止计时器并记录下所经过的时间。
这是反应的总时间。
6.使用称量纸称量反应过程中产生的气体质量。
将称量结果记录在实验报告中。
7.根据记录的时间和氧气生成的质量,可以计算出双氧水分解的速率。
8.最后,清理实验现场,将所有的试剂和工具放回原位。
结果与讨论:结果:在本次实验中,我们使用了双氧水和二氧化锰作为催化剂来制备氧气。
通过测量生成的气体质量和反应时间,我们计算出了双氧水分解的速率。
这个速率可以用于比较不同催化剂或不同条件下双氧水分解的效率。
讨论:双氧水是一种强氧化剂,可以用于多种应用,包括制备氧气。
在本次实验中,我们使用了二氧化锰作为催化剂来加速双氧水的分解。
二氧化锰是一种常用的催化剂,可以促进双氧水的分解反应,并提高氧气的生成速率。
然而,其他的催化剂(如铜盐、银盐等)也可以用于双氧水的分解,并具有不同的效率和选择性。
因此,在选择催化剂时需要根据具体的应用需求进行选择。
除了催化剂之外,反应温度、压力和双氧水的浓度等因素也会影响双氧水的分解速率。