气液平衡
- 格式:pdf
- 大小:56.52 KB
- 文档页数:4

气液平衡的相平衡条件
气液平衡的相平衡条件是指在闭合系统中,气体与液体达到相平衡的必要条件。
相平衡意味着系统中气体和液体之间的物质交换达到了平衡状态,即两者之间的反应速率相等。
首先,气液相平衡条件之一是液体中溶解的气体分子的逸出速率等于气体中溶
解的气体分子的溶解速率。
这意味着当气体分子从液体中逸出的速率等于气体分子溶解进液体中的速率时,系统达到气液相平衡。
这个平衡条件可以通过亨利定律来描述,该定律指出气体与液体之间的溶解度与气体的分压成正比。
其次,气液相平衡条件还要求气体和液体之间存在均匀的分配。
这意味着在相
平衡状态下,气体和液体之间的分子自由移动并且均匀分布,没有净流动的趋势。
这种均匀分配的态势是通过扩散和浓度均化过程实现的。
最后,气液相平衡还要求液体和气体之间的压力相等。
当气体溶解进液体中时,气体分子对液体施加一定的压力,这被称为溶解气体的蒸气压。
在相平衡状态下,液体的蒸气压与气体的分压相等,从而实现了压力的平衡。
总结来说,气液平衡的相平衡条件包括气体和液体之间溶解速率的平衡、分子
的均匀分配以及压力的平衡。
这些条件是系统达到气液相平衡的前提,同时也是液体和气体之间物质交换达到稳定状态的保证。

常用气液平衡的计算方法
①液相中各组分的蒸汽压必须等于气相中同组分的分压,否则,各组
分在单位时间内气化的分子数和冷凝的分子数就相等;
②液相的温度必须等于气相的温度,否则,两相间会发生热交换,当
任一相的温度升高或降低时,势必引起各组分量的变化。
这就说明在一定
温度下,气液两相平衡状态时,气液两相中的同一组分的摩尔分数比恒定。
相平衡方程如下式:
yA=kAxA
式中yA——A组分在气象中的摩尔分率;
xA——A组分在液相中的摩尔分率;
kA——A组分的平衡常数。
气液两相平衡时,两相温度相等,此温度对气相来说,代表露点温度;对液相来说,代表泡点温度。
气液平衡是两相传质的极限状态。
气液两相不平衡到平衡的原理,是
汽化和冷凝,吸收和解吸过程的基础。
例如,蒸馏的最基本过程,就是气
液两相充分接触,通过两相组分浓度差和温度差进行传质传热,使系统趋
近于动平衡。
这样,经过塔板多几接触,就能达到混合物组分的最大限度
分离。
气液相平衡常数Ki是指气液两相达到平衡时,在系统的温度、压力条件下,系统中某一组分i在气相中的摩尔分率yi与液相中的摩尔分率xi的比值。
即:
Ki=yi/xi
6
相平衡常数是石油蒸馏过程相平衡计算时最重要的参数,对于压力低于0.3Mpa的理想溶液,相平衡常数可以用下式计算:
Ki=Poi/P
式中Poi——i组分在系统温度下的饱和蒸气压,Pa;
P——系统压力,Pa。
7
对于石油或石油馏分,可用实沸点蒸馏的方法切割成看成为一各组分——假组分,借助于多元系统气液相平衡计算的方法、进行石油蒸馏过程中的气液相平衡的计算。


二、气液相平衡关系 平衡状态:在一定压力和温度下,当吸收和解吸速率相等时,气液两相达到平衡。
相平衡关系:吸收过程中气液两相达到平衡时,吸收质在气相和液相中的浓度关系1.气体在液体中的溶解度 (图8-1)平衡时溶质在气相中的分压称为平衡分压,用符号*A p 表示;溶质在液相中的浓度称为平衡溶解度,简称溶解度;它们之间的关系称为相平衡关系。
结论:①在相同的吸收剂、温度和分压下,不同溶质的溶解度不同;②分压一定时,温度越低,则溶解度越大。
较低的温度有利于吸收操作;③温度T 一定时,分压P 越大,溶解度越大。
较高的分压有利于吸收操作;④加压和降温对吸收操作有利。
2.亨利定律(1)亨利定律亨利定律内容:在总压不太高,温度一定的条件下,稀溶液上方溶剂的平衡分压*A p 与溶质在液相中的摩尔分数A x 成正比,比例系数为亨利系数E 。
即: A A Ex p =* 形式一E ——亨利系数, Pa讨论:①E 的来源:实验测得,查手册②E 的影响因素:溶质、溶剂、T 。
物系一定时, ③亨利系数表示气体溶解的难易程度。
E 大的,溶解度小,难溶气体;E 小的,溶解度大,易溶气体。
(2)亨利定律的其它形式① 溶质在液相中的浓度用量浓度A c 表示,气相用分压*A p 表示,则: Hc p A A =* 形式二 ↑↑⇒E TH ——溶解度系数,实验测定。
溶解度↓溶解度系数表示气体溶解的难易程度。
易溶气体,H ↑;难溶气体,H ↓。
溶解度系数H 和亨利系数E 的关系:剂剂EM H ρ=②溶质在气液相中的浓度均用摩尔浓度表示, 则:A A A mx x PE P p y ===** 形式三 m ——相平衡常数。
P E m = 是温度和压强的函数。
讨论:1)P 一定时, 溶解度↓。
升温不利于吸收;2)t 一定时, 溶解度↑。
加压有利于吸收。
③溶质在气液相中的浓度均用比摩尔分数表示时,AA A A X X m Y Y +=+**11 整理得: A A A X m mX Y )1(1-+=* 形式四 比摩尔分数表示的气液相平衡关系。

气液平衡关系的适用条件引言气液平衡关系是研究气体和液体在一定条件下的平衡状态的重要课题。
在化工、生物学、环境科学等领域,有许多关于气液平衡的研究正在进行中。
本文将探讨气液平衡关系的适用条件,并解释为什么这些条件对于研究和应用气液平衡非常重要。
1.温度和压力条件气液平衡关系的适用条件之一是一定的温度和压力条件。
在实验和工业应用中,我们通常需要控制气体和液体的温度和压力,以实现气液平衡的条件。
当温度和压力处于适宜的范围内时,气体和液体之间的传质和反应过程可以达到平衡状态。
2.物质性质的相似性为了实现气液平衡关系,液体和气体的物质性质应该相似。
例如,溶液中的溶质分子应该与气体分子具有相似的性质,如极性、分子大小等。
只有在这种情况下,液体和气体之间的物质传递才能达到平衡状态。
3.界面表面积的稳定界面表面积的稳定也是气液平衡关系的适用条件之一。
当液体和气体接触时,液体表面会形成一个界面,该界面的表面积应该保持稳定。
如果界面表面积不稳定,即表面活性剂的存在或其他原因导致的表面紊乱,将阻碍气体和液体之间的传质和反应过程达到平衡。
4.气液相互作用力的平衡气液平衡关系的适用条件还包括气体和液体之间的相互作用力的平衡。
在气液界面处,气体分子和液体分子之间存在各种相互作用力,如吸附力、扩散力等。
这些相互作用力的平衡对于气液平衡的形成至关重要。
只有当气体分子和液体分子之间的相互作用力达到平衡状态时,气液界面才能保持稳定并且传质过程得以进行。
5.外界环境的稳定除了上述条件外,气液平衡关系还受到外界环境的影响。
外界环境的稳定包括温度、压力和湿度的稳定,以及其他可能影响气体和液体之间相互作用的因素的稳定。
只有在外界环境稳定的条件下,气液平衡关系才能得以实现和研究。
结论成功研究和应用气液平衡关系需要满足一定的条件。
温度和压力的控制、物质性质的相似性、界面表面积的稳定、气液相互作用力的平衡以及外界环境的稳定都是实现气液平衡关系的重要因素。


气液相平衡方程
气液相平衡方程是描述气体和液体之间物质传递的数学关系。
它是化学工程、环境科学、生物工程等领域中重要的理论工具。
气液相平衡方程的基本形式是亨利定律,即气体在液体中的溶解度与气体的分压成正比。
这个方程可以用以下数学表达式表示:
C = kH * P
其中,C是气体在液体中的溶解度,kH是亨利常数,P是气体的分压。
亨利常数是气体溶解度与分压的比例常数,它依赖于具体的气体和溶剂系统。
除了亨利定律,还有其他描述气液相平衡的方程,比如罗特定律和拉乌尔定律。
罗特定律是描述溶剂中溶质的逸度与溶液中溶质的摩尔分数之间的关系。
拉乌尔定律是描述理想混合溶液的蒸气压与组成之间的关系。
在工程实践中,气液相平衡方程经常用于设计和优化化工装置。
例如,在气体吸附过程中,通过气液相平衡方程可以计算出吸附剂中溶质的负荷量。
在化学反应工程中,气液相平衡方程可以帮助确定反应器中气体和液体的相互作用,从而优化反应条件。
此外,气液相平衡方程还可以应用于环境科学研究中。
例如,在水体中溶解氧的研究中,可以利用亨利定律来计算氧气在水中的溶解度,从而评估水体的氧化能力。
在大气污染研究中,可以利用拉乌尔定律来估算不同气体在大气中的浓度。
总之,气液相平衡方程是描述气体和液体之间物质传递的重要工具。
通过这些方程,可以深入理解气体和液体的相互作用,为工程设计和科学研究提供有力的支持。


空气与水的气液平衡原理空气与水的气液平衡原理是指当水与空气接触时,两者之间会发生物质的传递和平衡,从而形成水体和大气中溶解气体浓度的关系。
这种平衡是通过溶质的扩散、吸附和脱附等过程实现的。
本文将详细介绍空气与水的气液平衡原理。
首先,我们来了解一下气体溶解于液体中的基本原理。
气体分子在液体中溶解的过程可以分为三个主要步骤:气体分子通过扩散进入液体,然后逐渐与液体分子间相互作用,最后被液体吸附或反应生成新的物质。
这一过程受到温度、压力、液体性质等因素的影响。
在空气与水的气液平衡中,空气中的气体会溶解于水中。
气体溶解水的量可由亨利定律描述:在一定温度下,气体与溶液之间的溶解度(溶解质的浓度)与该溶质的分压成正比。
即溶解度与溶液中所含有的该气体分子的压力呈线性关系。
此外,温度也是空气与水的气液平衡中的重要因素。
一般情况下,温度升高会导致溶解度降低,即在相同的压力下,高温下水对气体的溶解度会较低。
这是因为温度增加会使液体分子的热运动加剧,分子之间的吸引力减弱,从而使气体分子与液体分子之间的作用力减小,溶解度降低。
除了温度和压力,溶解质本身的特性也会对气体在水中的溶解度产生影响。
溶解度与溶质的等值、溶质-溶剂分子之间的作用力、溶质分子的大小和形状以及液相中其他溶质的有无等因素相关。
在大气和水的气液平衡中,还存在气体在水体中的分布和传输过程。
大气中的气体通过扩散作用进入水体,形成溶解气体。
溶解气体在水体中可以通过对流、扩散和水体的混合转移。
此外,气体还可以通过化学反应与水体中的其他物质发生作用而在水体中转化。
总的来说,空气与水的气液平衡是通过气体分子在液体中的溶解和由溶质分子向气相的扩散、吸附、脱附等过程实现的。
这种平衡受到温度、压力、液相特性、溶质间相互作用等因素的影响。
了解和研究空气与水的气液平衡原理对于理解环境和大气污染、水体健康与污染以及气候变化等问题具有重要意义。
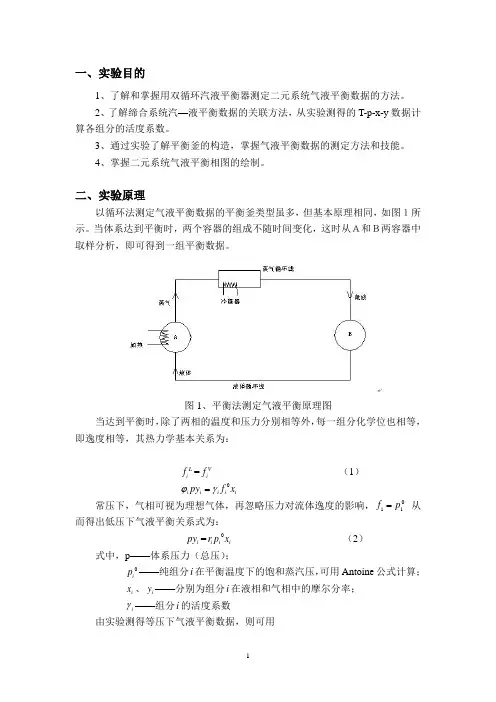
一、实验目的1、了解和掌握用双循环汽液平衡器测定二元系统气液平衡数据的方法。
2、了解缔合系统汽—液平衡数据的关联方法,从实验测得的T-p-x-y 数据计算各组分的活度系数。
3、通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。
4、掌握二元系统气液平衡相图的绘制。
二、实验原理以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1所示。
当体系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器中取样分析,即可得到一组平衡数据。
图1、平衡法测定气液平衡原理图当达到平衡时,除了两相的温度和压力分别相等外,每一组分化学位也相等,即逸度相等,其热力学基本关系为:L i f =V i f (1)0i i i i i py f x ϕγ=常压下,气相可视为理想气体,再忽略压力对流体逸度的影响,0i i p f = 从而得出低压下气液平衡关系式为:i py =0i i i r p x (2) 式中,p ——体系压力(总压);0i p ——纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算; i x 、i y ——分别为组分i 在液相和气相中的摩尔分率; i γ——组分i 的活度系数由实验测得等压下气液平衡数据,则可用i y =ii ipy x p (3) 计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson 方程关联。
Wilson 方程为: ln γ1=-ln(x 1+Λ12x 2)+x 2(212112x x Λ+Λ -121221x x Λ+Λ) (4)ln γ2=-ln(x 2+Λ21x 1)+x 1(121221x x Λ+Λ -212112x x Λ+Λ) (5)Wilson 方程二元配偶函数Λ12和Λ21采用非线性最小二乘法,由二元气液平衡数据回归得到。
目标函数选为气相组成误差的平方和,即F =2221211((j mj j y y y y ))计实计实-+-∑= (6)三、实验装置和试剂1、实验的装置:平衡釜一台、阿贝折射仪一台、超级恒温槽一台、50-100十分之一的标准温度计一支、0-50十分之一的标准温度计一支、1ml 注射器4支、5ml 注射器1支。

气液平衡条件(一)气液平衡条件什么是气液平衡条件?气液平衡条件指的是在一定温度和压力下,气体和液体之间达到平衡状态的条件。
这种平衡状态可以通过一系列维持压强、温度和组分的平衡条件来实现。
气液平衡条件的重要性了解和掌握气液平衡条件对于许多领域是至关重要的。
在化学工程、环境科学、石油工业等领域中,气液平衡条件的研究可以用于设计和优化各种过程和设备。
例如,石油工业中的油气分离过程、化学工程中的溶剂提取和吸附分离等。
气液平衡条件的主要要素要实现气液平衡,需要满足以下主要要素:•温度:气液两相之间的温度要一致,才能达到平衡状态。
•压力:气相和液相的压强要相等,以保持平衡。
•组分:气液两相的组分要具备一定的关系,例如摩尔分数。
气液平衡条件的计算方法计算气液平衡条件可以通过不同的方法和模型。
常用的方法包括经验模型、理论模型和实验方法。
•经验模型:经验模型是基于大量实验数据的经验公式,适用于某些特定条件下的气液平衡计算。
•理论模型:理论模型基于物理原理建立,可以较准确地预测气液平衡。
常用的理论模型包括热力学模型和动力学模型。
•实验方法:实验方法是通过实验测量来确定气液平衡条件。
常用的实验方法有摩尔分数测定、压力-温度相图测定等。
气液平衡条件的应用气液平衡条件的应用广泛。
以下是一些常见的应用:•气体吸附分离:利用气体在吸附剂上的吸附特性,通过调节温度和压力实现气体吸附分离。
•溶剂提取:通过选择合适的溶剂、温度和压力条件,实现对混合物中某些组分的选择性提取。
•油气分离:在石油工业中,通过控制温度和压力条件,实现原油中油气的分离。
结论气液平衡条件是实现气液相平衡的关键要素。
通过理解和应用气液平衡条件,我们可以更好地设计和优化各种化工过程和设备,提高操作效率和产品质量。
通过不断研究和改进,我们可以在各个领域中充分利用气液平衡条件的优势,并为相关产业的发展做出贡献。
气液平衡条件的实验方法摩尔分数测定摩尔分数是指气液混合物中各组分的摩尔比例。
简要叙述汽液平衡、液液平衡、气液平衡的工业应用背景
汽液平衡、液液平衡和气液平衡是化学和工程学的重要概念,它们被广泛应用于各种工业过程和设备中。
汽液平衡是指液体和气体之间的平衡状态,通常涉及到气体的吸收或溶解,例如在煤气净化和制氢过程中的气体吸收,以及在酸碱中和过程中的气体溶解。
控制汽液平衡对于提高生产效率和产品质量至关重要。
液液平衡是指不同液体之间的平衡状态,通常涉及到液体的萃取和分离,例如在石油精炼和化工生产中的液液萃取,以及在制药工艺中的分离和纯化。
控制液液平衡对于提高产品纯度和降低生产成本非常重要。
气液平衡是指气体和液体之间的平衡状态,通常涉及到气体的吸收和分离,例如在烟气脱硫和空气净化中的气液吸收,以及在化学反应和蒸馏中的气液分离。
控制气液平衡对于提高环境保护和资源利用效率非常关键。
综上所述,汽液平衡、液液平衡和气液平衡是工业过程中的重要概念,正确控制它们对于提高生产效率、产品质量和环境保护都起着非常重要的作用。
汽液平衡数据的测定汽液平衡数据是最常用的化工基础数据。
许多化工过程如精馏的设计、操作及过程控制等都离不开汽液平衡数据。
有热力学研究方面,新的热力学模型的开发,各种热力学模型的比较筛选等也离不开大量精确的汽液平衡实测数据。
现在,各类化工杂志每年都有大量的汽液平衡数据及汽液平衡测定研究的文章发表。
所以汽液平衡数据的测定及研究深受化工界人士的重视一、实验目的:通过测定常压下乙醇—水二元系统汽液平衡数据的实验,使同学们了解、掌握汽液平衡数据测定的方法和技能,熟悉有关仪器的使用方法,将课本上学到的热力学理论知识与实际运用有机地联系在一起。
从而既加深对理论知识的理解和掌握,又提高了动手的能力。
二、汽液平衡测定和种类:由于汽液平衡体系的复杂性及汽液平衡测定技术的不断发展,汽液平衡测定也形成了特点各异的不同种类。
按压力分,有常减压汽液平衡和高压所液平衡测定。
高压汽液平衡测定的技术相对比较复杂,难度较大。
常减压汽液平衡测定则相对较易。
按形态分,有静态法和动态法。
静态法技术相对要简单一些,而动态法测定的技术要复杂一些但测定较快较准。
在动态法里又有单循环法和双循环法。
双循环法就是让汽相和液相都循环,而单循环只让其中一相(一般是汽相)循环。
在一般情况下,常减压汽液平衡都采用双循环,而在高压所液平衡中,只让汽相强制循环。
循环的好处是易于平衡、易于取样分析。
根据对温度及压力的控制情况,有等温法与等压法之分。
一般,静态法采用等温测定,动态法的高压汽液平等多采用等温法。
总之汽液平衡系统特点各异,而测定的方法亦丰富多彩。
本实验采用的是常压下(等压)双循环法测定乙醇—水的汽液平衡数据。
三、实验原理:以循环法测定汽液平衡数据的平衡釜有多种形式,但基本原理是一样的。
如图书馆所示,当体系达到平衡时,A 和B 两容器中组成不随时间布景为化,这时从A 和B 两容器中取样分析可以得到一组汽液平衡实验数据。
根据下平衡原理,当所液两相达到相平衡时,汽液两相温度压力相等,同时任一组分在各相中的逸度相等,即:v L i i f f =))这里 v v i i i f y P =Φ)) 0L i i i i f r x f =))对低压汽液平衡,其汽相可以视为理想气体混合物,即1v i Φ=),忽略压力对液体逸度的影响,即0i i f P =),从而得出低压下汽液平衡关系式:i i i i Py r x P =式中 P ——体系压力(总压)i P ——纯组分i 在平衡温度下的饱合蒸汽压。
气液平衡实验报告气液平衡实验报告引言:气液平衡是物理化学中一个重要的概念,涉及到气体和液体之间的相互作用和平衡状态。
本实验旨在通过观察和测量,探究气液平衡的基本原理和相关参数的变化规律。
实验目的:1. 研究气液平衡的基本原理;2. 测量气液平衡的关键参数,如饱和蒸汽压、溶解度等;3. 探究温度、压力和溶质浓度对气液平衡的影响。
实验材料和仪器:1. 水槽;2. 温度计;3. 压力计;4. 水;5. 溶质(如盐、糖等);6. 烧杯;7. 热水浴。
实验步骤:1. 将水槽放置在实验台上,并加入适量的水;2. 将温度计插入水槽中,记录水的初始温度;3. 在烧杯中加入一定量的溶质,并搅拌使其充分溶解;4. 将烧杯放入热水浴中,加热溶液,同时观察溶质是否完全溶解;5. 当溶液达到饱和状态时,记录此时的温度和压力;6. 重复以上步骤,使用不同溶质和温度进行实验。
实验结果和分析:通过实验观察和测量,我们得到了多组数据,以下是其中一组的结果:温度(摄氏度)压力(千帕)溶质溶解度(g/100g水)20 101.3 3630 150.2 4240 200.5 4850 250.1 5460 300.8 60从上表可以看出,随着温度的升高,溶质的溶解度也随之增加。
这符合气液平衡的基本原理,即温度升高会使溶质分子的热运动增强,更有利于其与溶剂分子相互作用,从而增加溶解度。
而压力对溶解度的影响相对较小。
此外,通过实验还可以发现不同溶质的溶解度也存在差异。
这是因为不同溶质的分子间相互作用力不同,导致其溶解度的大小也不同。
因此,在实际应用中,需要根据具体情况选择合适的溶质。
实验结论:1. 温度对气液平衡的影响较大,温度升高会增加溶质的溶解度;2. 压力对气液平衡的影响相对较小;3. 不同溶质的溶解度存在差异,取决于其分子间相互作用力。
实验意义:气液平衡是许多自然和工业过程的基础,如化学反应、溶解过程、蒸发和汽化等。
通过本实验,我们深入了解了气液平衡的基本原理和相关参数的测量方法,为进一步研究和应用提供了基础。
第二节 两组分理想物系气液平衡5-2-1 两组分理想物系的气液平衡关系所谓理想物系是指液相和气相应符合以下条件:(1)液相为理想溶液,遵循拉乌尔定律。
根据溶液中同分子间与异分子间作用力的差异,可将溶液分为理想溶液和非理想溶液。
严格地说,理想溶液是不存在的,但对于性质极相近、分子结构相似的组分所组成的溶液,例如苯—甲苯、甲醇—乙醇、烃类同系物等都可视为理想溶液。
(2)气相为理想气体,遵循道尔顿分压定律。
当总压不太高(一般不高于104kPa )时气相可视为理想气体。
一、两组分理想物系的相律相律是研究相平衡的基本规律。
相律表示平衡物系中的自由度数、相数及独立组分 数间的关系,即F=C -φ+2 (5-1) 式中 F ——自由度数;C ——独立组分数;φ——相数。
式5-1中的数字2表示外界只有温度和压强这两个条件可以影响物系的平衡状态。
对两组分的气液平衡,其中组分数为2,相数为2,故由相律可知该平衡物系的自由度数为2。
由于气液平衡中可以变化的参数有四个,即温度t 、压强P 、一组分在液相和气相中的组成x 和y (另一组分的组成不独立),因此在t 、P 、x 和y 四个变量中,任意规定其中二个变量,此平衡物系的状态也就被唯一地确定了。
又若再固定某个变量(例如压强,通常蒸馏可视为恒压下操作),则该物系仅有一个独立变量,其它变量都是它的函数。
所以两组分的气液平衡可以用一定压强下的t —x (或y )及x —y 的函数关系或相图表示。
气液平衡数据可由实验室测定,也可由热力学公式计算得到。
二、用饱和蒸汽压和相平衡常数表示气液平衡关系根据拉乌尔定律,理想溶液上方的平衡分压为p A =p A ° x A (5-2) p B =p B °x B =(1-x A ) (5-2a ) 式中 p ——溶液上方组分的平衡分压,Pa ;p °——在溶液温度下纯组成的饱合蒸气压,Pa ;x ——溶液中组成的摩尔分率。
第二节气液相平衡
上节中图8-2(b)所示的湿壁塔吸收是吸收过程最基本的操作方式,它与套管换热器中的传热颇相类似。
若将吸收与传热两个过程作一比较,不难看出其间的异同:传热过程是冷、热两流体间的热量传递,传递的是热量,传递的推动力是两流体间的温度差,过程的极限是温度相等;吸收过程是气液两相间的物质传递,传递的是物质,但传递的推动力不是两相的浓度差,过程的极限也不是两相浓度相等。
这是由于气液之间的相平衡不同于冷热流体之间的热平衡。
8-2-1 平衡溶解度
在一定温度下气液两相长期或充分接触后,两相趋于平衡。
此时溶质组分在两相中的浓度服从某种确定的关系,即相平衡关系。
此相平衡关系可以用不同的方式表示。
溶解度曲线气液两相处于平衡状态时,溶质在液相中的浓度称为溶解度,它与温度、溶质在气相中的分压有关。
若在一定温度下,将平衡时溶质在气相中的分压p e与液相中的摩尔分率x相关联,即得溶解度曲线。
图8-3为不同温度下氨在水中的溶解度曲线。
从此图可以看出,温度升高,气体的溶解度降低。
液相中氨的摩尔分率x
图8-3 氨在水中的平衡溶解度图8-4 101.3kPa下SO2在水中的溶解度
溶解度及溶质在气相中的组成也可用其它单位表示。
例如,气相以摩尔分率y表示,液相用摩尔浓度C表示(其单位为kmol溶质/m3溶液)。
图8-4 为SO2在101.3kPa下的溶解度曲线,图中气、液两相中的溶质浓度分别以y、x(摩尔分率)表示。
在一定温度下,分压是直接决定溶解度的参数。
当总压不太高时(一般约小于0.5MPa,视物系而异),总压的变化并不改变分压与溶解度之间的对应关系。
但是,当保持气相中溶质的摩尔分率y为定值,总压不同意味着溶质的分压不同。
因此,不同总压下y~x溶解度曲线的位置不同。
以分压表示的溶解度曲线直接反映了相平衡的本质,用以思考和分析问题直截了当;而以摩尔分率x与y表示的相平衡关系,则可方便地与物料衡算等其他关系式一起对整个吸收过程进行数学描述。
亨利定律吸收操作最常用于分离低浓度的气体混合物,因此时吸收操作较为经济。
低浓度气体混合物吸收时液相的浓度通常也较低,即常在稀溶液范围内。
稀溶液的溶解度曲线
通常近似地为一直线,此时溶解度与气相的平衡分压p e 之间服从亨利定律,即
Ex p e = (8-1)
当以其它单位表示可溶组分(溶质)在两相中的浓度时,亨利定律也可表示为
HC p e = (8-2) mx y e = (8-3) 以上三式中,比例系数E 、H 、m 为以不同单位表示的亨利常数,m 又称为相平衡常数。
这些常数的数值越小,表明可溶组分的溶解度越大,或者说溶剂的溶解能力越大。
以上三式所用单位各不相同,但在稀溶液范围内可将溶解度曲线视为直线这一点则是共同的。
比较式(8-1)~(8-3)不难得出三个比例常数之间的关系为:
P
E m = (8-4) M HC E = (8-5) 式中P 为总压,C M 为混合液的总摩尔浓度(kmol/m 3)。
溶液中溶质的摩尔浓度C 与摩尔分率x 的关系为
x C C M = (8-6)
溶液的总摩尔浓度C M 可用1m 3溶液为基准来计算,即
m m
M M C ρ= (8-7)
式中ρm 为混合液的平均密度(kg/m 3),M m 为混合液的平均分子量。
对稀溶液,式 (8-7) 可近似为C M ≈ρs /M s ,其中ρs 、M s 分别为溶剂的密度和分子量。
将此式代入式 (8-5) 可得
S
S M H E ρ≈ (8-8) 常见物系的气液溶解度数据、亨利常数E(或H)可在有关手册中查到[1、2、3]。
必须注意,
手册中气液两相浓度常使用各种不同的单位,亨利常数的数值与单位也不同。
在较宽的浓度范围内,溶质在两相中浓度的平衡关系可一般地写成某种函数形式,
)(x f y e =
此式称为相平衡方程。
有时在有限的浓度范围内,溶解度曲线也可近似取为直线,但此直线一般未必通过原点,而与亨利定律区别。
例8-1 相平衡曲线的求取
在总压为101.3kPa 和202.6kPa 下,根据20℃的SO 2-水的气液数据绘出以摩尔分数表示气、液浓度的相平衡曲线,并计算气相组成y=0.02(摩尔分数)时,两种不同总压下的平衡液相浓度。
解:
1. 20℃下SO 2-水的气液平衡数据取自数据手册[1],列于附表第1、2列。
设100g 水中溶解的SO 2克数为 a ,则溶液中SO 2的摩尔分数x 为
例8-1附表 20℃SO 2-水平衡数据
气相浓度y e a
gSO 2/100gH 2O
p e kPa 液相浓度 x P=101.3kPa P=202.6kPa 0.02
0.05
0.10
0.20
0.30
0.50
1.00 0.0666 0.1600 0.4270 1.133 1.879 3.466 7.864 5.62×10-5 1.41×10-4
2.81×10-4 5.62×10-4 8.43×10-4 1.40×10-3 2.81×10-3 6.58×10-4 1.58×10-3 4.21×10-3 11.2×10-3 18.6×10-3 34.2×10-3 77.6×10-3
3.29×10-4 0.74×10-3 2.10×10-3 5.60×10-3 9.30×10-3 17.1×10-3 38.8×10-3
按此式将附表第1列的溶液浓度换算成摩尔分数x
列入附表第3列。
气相浓度
在P=101.3kPa 及202.6kPa 下将附表第2列SO 2分
压p e 换算成y e 列入第4、5列。
根据气、液平衡浓
度y e ~x 作图,即得20℃下SO 2-水的平衡曲线,如
图8-5所示。
2.当混合气中SO 2浓度y=0.02时, 可由图8-
5之平衡曲线查得液相的平衡浓度为
P=101.3kPa x e =0.930×10-3 图8-5 20℃下SO 2-水的相平衡曲线 P=202.6kPa x e =1.65×10-3
由本例可知,总压
P 的变化将改变y~x 平衡曲线的位置。
这是由于对指定气相组成y ,总压增加使SO 2分压增大,溶解度x 也随之增大。
8-2-2 相平衡与吸收过程的关系
判别过程的方向 设在101.3kPa 、20℃下稀氨水的相平衡方程为y e =0.94x ,今使含氨10mol%的混合气和x=0.05的氨水接触(图8-6 a)。
因实际气相浓度y 大于与实际溶液浓度x 成平衡的气相浓度y e =0.047,故两相接触时将有部分氨自气相转入液相,即发生吸收过程。
同样,此吸收过程也可理解为实际液相浓度x 小于与实际气相浓度y 成平衡的液相浓度 x e =y/m=0.106,故两相接触时部分氨自气相转入液相。
反之,若以y=0.05的含氨混合气与x=0.1的氨水接触(图8-6 b),则因y < y e 或x > x e , 部分氨将由液相转入气相,即发生解吸过程。
指明过程的极限 今将溶质浓度为y 1的混合气送入某吸收塔的底部,溶剂自塔顶淋入作逆流吸收(图8-7 a)。
若减少淋下的吸收溶剂量,则溶剂在塔底出口的浓度x 1必将增高。
但即使在塔很高、吸收溶剂量很少的情况下,x 1也不会无限增大,其极限是气相浓度y 1的平衡浓度x 1e ,即
m y x x e 11max 1==
18
1006464+=a a
x P
p y e
e =
反之, 当吸收剂用量很大而气体流量较小时, 即使在无限高的塔内进行逆流吸收 (图8-7 b),出口气体的溶质浓度也不会低于吸收剂入口浓度x 2的平衡浓度y 2e ,即
22min 2mx y y e ==
图8-6 判别过程的方向 图8-7 吸收过程的极限
由此可见,相平衡关系限制了吸收溶剂离塔时的最高浓度和气体混合物离塔时的最低浓度。
计算过程的推动力 平衡是过程的极限,只有不平衡的两相互相接触才会发生气体的吸收或解吸。
实际浓度偏离平衡浓度越远,过程的推动力越大,过程的速率也越快。
在吸收过程中,通常以实际浓度与平衡浓度的偏离程度来表示吸收的推动力。
图8-8为吸收塔的某一截面,该处气相溶质浓度为y ,液相溶质浓度为x 。
在x ~y 表示的平衡溶解度曲线图上,该截面的两相实际浓度如点A 所示。
显然,由于相平衡关系的存在,气液两相间的吸收推动力并非 (y - x),而可以分别用气相或液相浓度差表示为 (y- y e )或(x e -x )。
(y- y e )称为以气相浓度差表示的吸收推动力,(x e -x )则称为以液相浓度差表示的吸收推动力。
图8-8 吸收推动力。