2020-2021【化学】化学科普阅读题的专项培优 易错 难题练习题(含答案)及答案
- 格式:doc
- 大小:119.00 KB
- 文档页数:9

一、中考初中化学科普阅读题1.阅读短文并回答问题。
白炽灯泡白炽灯泡的灯丝是由金属钨制作的,其灯丝发光时温度可达2000℃左右,为防止灯丝在高温下氧化,在制作灯泡时要抽真空,在制作大功率灯泡时,还要把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华。
白炽灯泡工作时,电能转化为光能的效率较低,因此逐渐被节能灯和LED灯所替代。
(1)由于钨的_____较高,所以用钨制作灯丝;(2)灯泡内充入稀有气体氦等,主要是为了_____;(3)白炽灯泡逐渐退出市场,是由于_____。
【答案】熔点做保护气,使灯泡耐用白炽灯泡工作时,电能转化为光能的效率较低,浪费能源【解析】【详解】(1)金属钨的熔点高,所以可以用来制灯丝;故填:熔点;(2)稀有气体化学性质稳定,可以用作保护气,使灯泡耐用,题干信息中把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华故填:做保护气,使灯泡耐用;(3)白炽灯泡工作时,电能转化为光能的效率较低,浪费能源,因此逐渐被节能灯和LED 灯所替代;故填:白炽灯泡工作时,电能转化为光能的效率较低,浪费能源。
故答案为(1)熔点;(2)做保护气,使灯泡耐用;(3)白炽灯泡工作时,电能转化为光能的效率较低,浪费能源。
2.阅读下面科普短文。
随着生活水平的提高,人们正在不断改善着自己的居家环境,房屋装修越来越普遍。
房屋装修会对室内空气质量产生影响,严重时会危害人体健康。
为推行“健康住宅”,保障人们的身体健康,国家制定了《室内空气质量标准》,已于2003年3月1日起开始实施。
房屋装修后室内空气污染物的检测参照国家《室内空气质量标准》GB/T18883﹣2002,采集60户装修后0~18个月的室内空气样品,检测甲醛、苯、氨的含量(检测前关闭门窗12小时,并打开室内所有橱柜和抽屉,以保证污染物有一个最大释放和平衡过程)。
检测结果见下表。
超标率(%)895035检测结果分析(1)室内空气主要污染物及原因由上表看出,装修后室内空气的首要污染物为甲醛,其次是苯和氨。

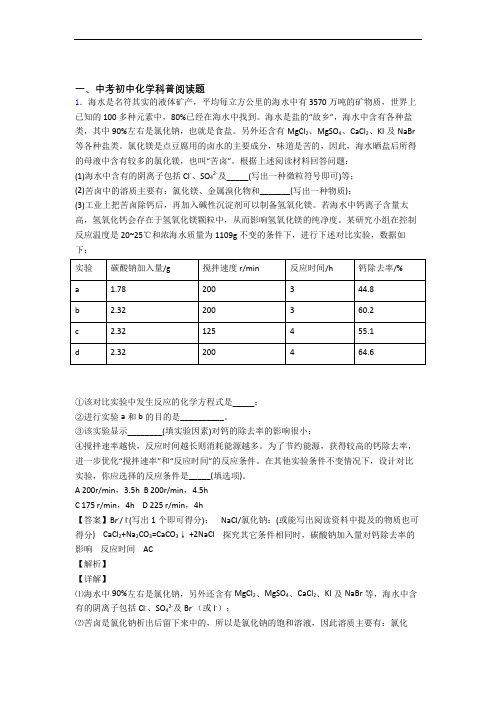
一、中考初中化学科普阅读题1.海水是名符其实的液体矿产,平均每立方公里的海水中有3570万吨的矿物质,世界上已知的 100 多种元素中,80%已经在海水中找到。
海水是盐的“故乡”,海水中含有各种盐类,其中90%左右是氯化钠,也就是食盐。
另外还含有MgCl2、MgSO4、CaCl2、KI及NaBr 等各种盐类。
氯化镁是点豆腐用的卤水的主要成分,味道是苦的,因此,海水晒盐后所得的母液中含有较多的氯化镁,也叫“苦卤”。
根据上述阅读材料回答问题:(1)海水中含有的阴离子包括Cl-、SO42-及_____(写出一种微粒符号即可)等;(2)苦卤中的溶质主要有:氯化镁、金属溴化物和_______(写出一种物质);(3)工业上把苦卤除钙后,再加入碱性沉淀剂可以制备氢氧化镁。
若海水中钙离子含量太高,氢氧化钙会存在于氢氧化镁颗粒中,从而影响氢氧化镁的纯净度。
某研究小组在控制反应温度是20~25℃和浓海水质量为1109g不变的条件下,进行下述对比实验,数据如下:①该对比实验中发生反应的化学方程式是_____;②进行实验a和b的目的是__________。
③该实验显示________(填实验因素)对钙的除去率的影响很小;④搅拌速率越快,反应时间越长则消耗能源越多。
为了节约能源,获得较高的钙除去率,进一步优化“搅拌速率”和“反应时间”的反应条件。
在其他实验条件不变情况下,设计对比实验,你应选择的反应条件是_____(填选项)。
A 200r/min,3.5hB 200r/min,4.5hC 175 r/min,4hD 225 r/min,4h【答案】Br-/ I-(写出1个即可得分); NaCl/氯化钠;(或能写出阅读资料中提及的物质也可得分) CaCl2+Na2CO3=CaCO3↓ +2NaCl 探究其它条件相同时,碳酸钠加入量对钙除去率的影响反应时间 AC【解析】【详解】⑴海水中90%左右是氯化钠,另外还含有MgCl2、MgSO4、CaCl2、KI及NaBr等,海水中含有的阴离子包括Cl-、SO42-及Br-(或 I-);⑵苦卤是氯化钠析出后留下来中的,所以是氯化钠的饱和溶液,因此溶质主要有:氯化镁、金属溴化物和NaCl;⑶①该对比实验中发生反应的化学方程式是:CaCl2+Na2CO3=CaCO3↓ +2NaCl;②实验a和b,搅拌速度和反应时间都相同,加入碳酸钠的质量不同,故进行实验a和b的目的是探究其它条件相同时,碳酸钠加入量对钙除去率的影响;③对比b和d,实验显示反应时间对钙的除去率的影响很小;④搅拌速率越快,反应时间越长则消耗能源越多。

一、中考初中化学科普阅读题1.“铁锅炒菜能补铁”在民间流传已久,央视《是真的吗》节目组对此进行了实验和调查。
实验过程:将西红柿切碎,分成两等份,分别用铁锅和铝合金锅进行清炒;清炒5分钟,将炒好的西红柿分别放入两个碗中,做好标记;对其铁含量进行检测。
检测结果:用铝合金锅炒的西红柿,铁含量为1.5mg/kg,用铁锅炒的西红柿,铁含量为23.5 mg/kg,约是铝合金锅的15倍。
可见,使用铁锅烹调确实能增加人体铁的摄入量,但是摄入的铁,又有多少能被人体吸收利用呢?食物中的铁主要分为血红素铁和非血红素铁。
血红素铁,是与血红蛋白及肌红蛋白中的卟啉结合的铁,而除此之外的食物中的铁都被称为非血红素铁。
食物中的血红素铁以卟啉铁的形式直接被肠粘膜上皮细胞吸收,吸收利用率高,不受其他食物中抑制因素的影响。
血红素铁主要存在于动物性食品中,动物肝脏、动物全血、畜禽肉类、鱼类等都是补铁的良好来源,鸡蛋也属于动物性食品,但是鸡蛋中的铁与蛋黄中的卵黄磷蛋白结合对铁的吸收具有干扰作用,所以鸡蛋中的铁吸收率仅有3%,不是补铁的良好来源。
食物中的非血红素铁主要是三价铁,需转化成二价铁才能被人体吸收。
非血红素铁主要存在于植物性食品中,其吸收常受到膳食因素的影响,如粮食和蔬菜中的植酸盐、草酸盐以及茶叶和咖啡中的多酚类物质均可影响非血红素铁的吸收,以下是几种饮品对铁元素吸收率的影响数值:血红素铁和非血红素铁都受体内储存铁量的影响,如果体内铁的储存量充足,铁的吸收率就低,如果缺铁的时候,铁的吸收率就会大大增加。
在食物匮乏年代,即使用铁锅烹饪,还是会缺铁。
而随着生活水平的提高,人们增加了动物性食品的供给,保证了血红素铁的摄入,同时摄入新鲜果蔬中的维生素C能促进非血红素铁的吸收,使我国居民贫血率大大下降。
依据文章内容回答下列问题。
(1)本文中用到铝锅和铁锅炒菜,若用实验验证铝和铁的活动性,应选择的试剂是________________(填1种试剂即可)。

一、中考初中化学科普阅读题1.阅读下面科普短文。
钠是一种活泼金属,其原子的结构示意图为。
钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。
钠还能与水反应,生成氢氧化钠和氢气。
目前,世界上多数采用电解熔融氯化钠的方法来制得金属钠。
氯化钠的熔点为801℃,将氯化钠和氯化钙按质量比2:3混合共熔,可得到熔融温度约为580℃的共熔物,降低了电解所需的温度。
电解时,正极放出氯气,负极产生的金属钠和金属钙同时浮在共熔物,从管道溢出。
把熔融的金属混合物冷却到105~110℃,金属钙结晶析出,通过过滤可以分离出金属钠。
金属钠的应用非常广泛,可以用于制造过氧化钠(Na 2O 2)等化合物。
还能用于生产更加昂贵的金属钾,以钠和氯化钾为原料,在高温条件下,生成钾和氯化钠,生成的钾能以蒸汽的形式分离出来。
依据文章内容,回答下列问题:(1)在钠的原子结构中,与钠元素化学性质密切相关的是__________。
(2)钠具有的物理性质有__________。
(3)金属钠通常保存在石蜡油中,目的是隔绝__________。
(4)钠能与水反应,化学方程式为__________。
(5)写出用钠制取钾的化学方程式__________。
【答案】最外层电子数 银白色固体(有金属光泽、质地软) 隔绝水和氧气222Na+2H O=2NaOH+H ↑ Na+KClNaCl+K 高温【解析】【分析】【详解】 (1)最外层电子数决定元素化学性质,故在钠的原子结构中,与钠元素化学性质密切相关的是最外层电子数(2)钠的物理性质有:有金属光泽,银白色;(3)金属钠通常保存在石蜡油中,目的是隔绝水和氧气;(4)根据题目信息可知,钠与水反应,生成氢氧化钠和氢气,反应的化学方程式为222Na+2H O=2NaOH+H ↑。
(5)钠与氯化钾在高温条件下生成氯化钠和钾,反应的化学方程式为Na+KCl NaCl+K 高温。
考点:元素化学性质,物质性质,灭火原理。

一、中考初中化学科普阅读题1.阅读下面科普短文。
(资料1)融雪剂按组成分为有机融雪剂和无机融雪剂。
有机融雪剂的主要成分为醋酸钾,一般用于机场等重要场所。
无机融雪剂以氯化钠、氯化钙等为主要成分,其融雪原理与相同条件下,不同浓度的食盐水的凝固点有关(见下表)。
(资料2)钛(Ti )是一种银白色的金属。
它具有良好的耐高温、耐低温、抗酸碱以及高强度、低密度的特点,广泛用于航空工业;它无毒且具有优良的生物相容性,是非常理想的医用金属材料,可用来制造人造骨等。
金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧。
在稀有气体和高温条件下,用四氯化钛和镁发生置换反应可制备金属钛。
依据资料,回答下列问题:(1)若飞机场使用融雪剂,应选择融雪剂的类别是___________。
(2)从无机融雪剂的融雪原理得出:100g 溶剂中,溶质质量和凝固点的关系是_______________。
(3)钛金属广泛应用于航空工业的原因是____________________(答出2条即可)。
(4)金属钛着火时___________(填“能”或“不能”)用二氧化碳灭火。
(5)四氯化钛制备金属钛的化学方程式是__________________________________。
【答案】有机融雪剂 溶质的质量越大,溶液的凝固点越低 高强度、低密度 不能TiCl 4+2Mg=稀有气体高温2MgCl 2+Ti【解析】(1)有题意可知,若飞机场使用融雪剂,应选择融雪剂的类型是有机融雪剂;(2)由无机融雪剂组成与凝固点的关系,从无机融雪剂的融雪原理得出:100g 溶剂中,溶质质量和凝固点的关系是溶质的质量越大,溶液的凝固点越低;(3)钛金属广泛应用于航空工业的原因是高强度、低密度等;(4)由于金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧,所以,金属钛着火时不能用二氧化碳灭火;(5)四氯化钛制备金属钛的化学方程式是:TiCl 4+2Mg =稀有气体高温2MgCl 2+Ti 。

一、中考初中化学科普阅读题1.二氧化碳是著名的温室气体,它能让太阳光顺利通过,却会阻止地表热量的散失.在地球形成的初期,太阳的辐射强度只有现在的四分之一,为什么那时的地球没有被冻成冰球呢?最新的理论认为,液态的水(比如降雨)能够溶解空气中的二氧化碳,再把它变为碳酸盐,沉积到岩石层中.同时,地球的内部很热,沉积在地壳中的碳经常会随着火山喷发而重新变为二氧化碳释放到大气中,这就形成了一个碳循环.经过几亿年的时间,这个碳循环逐渐达到了某种平衡,使大气中的二氧化碳保持一定的含量.正是由于这些二氧化碳产生的温室效应,使得地球的温度不至于太冷.生命的诞生促成了另一个碳循环.众所周知,生命的基础是光合作用,就是利用太阳提供的能量,把二氧化碳中的碳元素提取出来,连接成一条长短不一的碳链.这样的碳链被称为“有机碳”,因为它既能作为生命的“建筑材料”,搭建成生命所需的各种有机分子(碳水化合物、蛋白质和氨基酸等),又能“燃烧自己”,产生能量供生命使用.有机碳的燃烧过程又可以称之为“氧化反应”,其产物就是二氧化碳和水.南极冰钻的结果证明,地球大气中的二氧化碳浓度在过去的1万年里基本保持稳定.但自工业化以来,由于化石燃料的大量使用,二氧化碳浓度开始逐年上升,同时段内地球大气层的平均温度也发生了变化.(见表一和表二)目前燃烧化石能源而产生的二氧化碳,大气中的实际含量比理论计算值少一倍.有证据显示,大气中二氧化碳浓度的提高加快了森林的生长速度,促进了土壤对二氧化碳的吸收,这说明大自然正在努力地试图平衡人类带来的影响.但是,大自然的平衡能力是有限的,面对突然多出来的这些“碳”,大自然一时也应付不过来了,所以人类必须自己想办法.上图是当前人类为降低大气中的二氧化碳浓度所采取的措施.(有删改)依据文章内容,回答下列问题.(1)在地球形成的初期,地球没有被冻成冰球的原因是_____.(2)人类使用化石燃料使大气中二氧化碳浓度逐年上升.除了CO2,,下列物质中,属于温室气体的是_____(填字母序号,下同).A甲烷(CH4) B氢气(H2) C一氧化碳(CO) D臭氧(O3)(3)观察表一和表二后,小德认为二氧化碳排放量的持续增加导致地球大气层平均温度持续升高,但小威却不同意他的观点.下列不同年份间数据变化的总趋势能支持小威说法的是_____.A1900~1910 B1910~1940 C1940~1980 D1980以后(4)人类为降低大气中二氧化碳浓度采取的措施有:开发新能源、植树造林、_____(写出一条即可)等.(5)关于碳循环,下列说法正确的是_____.A二氧化碳是温室气体,对人类的生活有害无利B保持自然界的碳循环处于平衡状态是至关重要的C人类过多的工业活动产生大量的二氧化碳,打破了碳循环的平衡D当碳循环的平衡状态被破坏时,大自然完全具有自我修复的能力.【答案】由于二氧化碳产生的温室效应,使地球的温度不至于太冷 AC AC 将碳封存起来 BC【解析】【分析】二氧化碳是造成温室效应的气体,化石燃料:煤、石油、天然气。

一、中考初中化学科普阅读题1.化学用语是化学学科的专用语言,也是学习化学的重要工具。
⑴请从氧气、二氧化碳、氯化钠、盐酸、硫酸、氢氧化钙中选择合适的物质,将其化学式填写在下列横线上。
①可供给呼吸的气体单质_____②参与光合作用的氧化物_____③一种不易挥发的无机酸_____④常用于食品调味的盐_____⑵铁缺乏被认为是全球三大“隐性饥饿”之首(微量营养元素缺乏),全球约有1/5的人患缺铁性贫血。
食物铁强化是目前国际公认的最经济、有效和可持续的给人群补铁的方法。
中国疾控中心研制的新型铁强化剂(EDTA钠铁)在人体内的铁吸收、利用率高于其他铁剂,是传统补铁剂硫酸亚铁的2倍至3倍。
它在酱油中的溶解性较好,不影响食品口感,不改变酱油的原有口味。
此外,EDTA钠铁在食品加工和储存过程中性质稳定,它在酱油中可稳定保持两年以上。
研究表明,应用铁强化酱油补铁效果显著。
EDTA钠铁的化学式为C10H12FeN2NaO8,它是一种淡土黄色结晶性粉末,易溶于水,性质稳定,不易被氧化,其水溶液pH在3.5~5.5之间。
根据上述信息,请回答下列问题:①EDTA钠铁属于_____。
(选填“混合物”、“有机物”、“无机物”或“氧化物”之一)②EDTA钠铁中,碳、氧原子个数比为_____(填最简整数比)。
③EDTA钠铁中,元素质量分数最小的是_____元素。
④EDTA钠铁的化学性质有_____(至少答一条)。
⑤若经常使用铁锅炒菜做饭,也能有效预防缺铁性贫血,其反应原理的化学方程式为:(已知胃液中含有盐酸)_____。
【答案】O2 CO2 H2SO4 NaCl 有机物 5:4 H 不易被氧化,其水溶液显酸性Fe+2HCl=FeCl+H22【解析】【分析】【详解】(1)①可供给呼吸的气体是氧气,化学式为O2;②参与光合作用的氧化物是二氧化碳,化学式为CO2;③盐酸有挥发性,硫酸没有挥发性,故填H2SO4;④常用于食品调味的是氯化钠,化学式为NaCl;(2)①EDTA钠铁的化学式为C10H12FeN2NaO8,EDTA钠铁属于有机物;②EDTA钠铁的化学式为C10H12FeN2NaO8,EDTA钠铁中,碳、氧原子个数比为10:8=5:4。

一、中考初中化学科普阅读题1.食醋中一般含有3%-5%的醋酸,醋酸的化学名称叫乙酸(CH3COOH),是无色、有刺激性气味的液体,能溶于水。
食醋可以除去水壶内的水垢,水垢的主要成分是碳酸钙。
除水垢时,可在水壶中加入水,倒人适量醋,浸泡一段时间,不溶于水的碳酸钙会转变成可溶于水的醋酸钙而被除掉,化学方程式为CaCO3+2CH3COOH=(CH3COO)2Ca+H2O+CO2↑。
在熬制骨头汤时,常常在汤中加入少量食醋,因为骨头中含有不溶于水的磷酸钙,当磷酸钙与醋酸作用时生成可溶于水的磷酸二氢钙,能够增加汤内的含钙量,促进人体对钙、磷的吸收和利用。
食醋不仅在厨房中大显身手,还是一种杀菌剂,冬天在屋子里熬醋可以杀灭细菌,对抗感冒有很大作用。
饮酒过量的人可以用食醋来解酒,因为乙酸能跟乙醇发生酯化反应生成乙酸乙酯(CH3COOC2H5)和水,从而达到解酒的目的。
家用铝制品不能用来盛放食醋,以免铝被腐蚀。
根据文章内容,回答下列问题:(1)乙酸属于_________(填“有机物”或“无机物”)。
(2)食醋能用来解酒的原因是_________________________。
(3)用铁锅炒菜时,放一点食醋能补铁,用化学方程式解释原因___________。
(4)用食醋除去水壶内的水垢,该反应属于基本反应类型中的_________。
【答案】有机物乙酸能跟乙醇发生酯化反应生成乙酸乙酯和水,从而达到解酒的目的2CH3COOH+Fe=(CH3COO)2Fe+H2↑复分解反应【解析】【详解】(1)乙酸是含有碳元素的化合物,是有机物;(2)食醋能用来解酒的原因是乙酸能跟乙醇发生酯化反应生成乙酸乙酯和水;(3)用铁锅炒菜时放一点食醋能补铁,是因为铁能和醋酸反应生成醋酸亚铁和氢气,反应的化学方程式为:Fe+2CH3COOH=(CH3COO)2Fe+H2↑;(4)用食醋除去水壶内的水垢,醋酸与碳酸钙反应生成醋酸钙和水和二氧化碳,该反应属于基本反应类型中的复分解反应。

一、中考初中化学科普阅读题1.阅读短文并回答问题。
白炽灯泡白炽灯泡的灯丝是由金属钨制作的,其灯丝发光时温度可达2000℃左右,为防止灯丝在高温下氧化,在制作灯泡时要抽真空,在制作大功率灯泡时,还要把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华。
白炽灯泡工作时,电能转化为光能的效率较低,因此逐渐被节能灯和LED灯所替代。
(1)由于钨的_____较高,所以用钨制作灯丝;(2)灯泡内充入稀有气体氦等,主要是为了_____;(3)白炽灯泡逐渐退出市场,是由于_____。
【答案】熔点做保护气,使灯泡耐用白炽灯泡工作时,电能转化为光能的效率较低,浪费能源【解析】【详解】(1)金属钨的熔点高,所以可以用来制灯丝;故填:熔点;(2)稀有气体化学性质稳定,可以用作保护气,使灯泡耐用,题干信息中把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华故填:做保护气,使灯泡耐用;(3)白炽灯泡工作时,电能转化为光能的效率较低,浪费能源,因此逐渐被节能灯和LED 灯所替代;故填:白炽灯泡工作时,电能转化为光能的效率较低,浪费能源。
故答案为(1)熔点;(2)做保护气,使灯泡耐用;(3)白炽灯泡工作时,电能转化为光能的效率较低,浪费能源。
2.氯化钠是重要的调味品。
如图分别表示生成氯化钠的不同化学反应,请根据图示回答相关问题:①图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,元素的化学性质与________(填字母序号)密切相关。
A最外层电子数 B质子数 C电子层数②图2描述了氢氧化钠溶液与盐酸反应的微观实质,图中A 、B 、C 三处中B 处应填入的化学符号是________。
③图3所示物质NaClO 2中氯元素的化合价是______,该反应的化学方程式是_________。
【答案】A H + +3 222Cl 2NaClO =2ClO 2NaCl ++【解析】【分析】【详解】元素的化学性质与元素原子最外层电子数密切相关;故填:A②氢氧化钠和盐酸反应的实质是氢离子和氢氧根离子结合生成了水分子,B 处是盐酸电离出来的氢离子;故填:H +③在NaClO 2中,钠元素是+1价,氧元素是-2价,设氯元素的化合价是x ,则有(+1)+x +(-2)×2=0,x =+3;据图可以看出,该反应是 Cl 2和NaClO 2反应生成了ClO 2和NaCl ,故填:+3,222Cl 2NaClO =2ClO 2NaCl ++。

一、中考初中化学科普阅读题1.阅读下面科普短文。
钠是一种活泼金属,其原子的结构示意图为。
钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。
钠还能与水反应,生成氢氧化钠和氢气。
目前,世界上多数采用电解熔融氯化钠的方法来制得金属钠。
氯化钠的熔点为801℃,将氯化钠和氯化钙按质量比2:3混合共熔,可得到熔融温度约为580℃的共熔物,降低了电解所需的温度。
电解时,正极放出氯气,负极产生的金属钠和金属钙同时浮在共熔物,从管道溢出。
把熔融的金属混合物冷却到105~110℃,金属钙结晶析出,通过过滤可以分离出金属钠。
金属钠的应用非常广泛,可以用于制造过氧化钠(Na 2O 2)等化合物。
还能用于生产更加昂贵的金属钾,以钠和氯化钾为原料,在高温条件下,生成钾和氯化钠,生成的钾能以蒸汽的形式分离出来。
依据文章内容,回答下列问题:(1)在钠的原子结构中,与钠元素化学性质密切相关的是__________。
(2)钠具有的物理性质有__________。
(3)金属钠通常保存在石蜡油中,目的是隔绝__________。
(4)钠能与水反应,化学方程式为__________。
(5)写出用钠制取钾的化学方程式__________。
【答案】最外层电子数 银白色固体(有金属光泽、质地软) 隔绝水和氧气222Na+2H O=2NaOH+H ↑ Na+KClNaCl+K 高温【解析】【分析】【详解】 (1)最外层电子数决定元素化学性质,故在钠的原子结构中,与钠元素化学性质密切相关的是最外层电子数(2)钠的物理性质有:有金属光泽,银白色;(3)金属钠通常保存在石蜡油中,目的是隔绝水和氧气;(4)根据题目信息可知,钠与水反应,生成氢氧化钠和氢气,反应的化学方程式为222Na+2H O=2NaOH+H ↑。
(5)钠与氯化钾在高温条件下生成氯化钠和钾,反应的化学方程式为Na+KCl NaCl+K 高温。
考点:元素化学性质,物质性质,灭火原理。

一、中考初中化学科普阅读题1.阅读下面科普短文。
钠是一种活泼金属,其原子的结构示意图为。
钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。
钠还能与水反应,生成氢氧化钠和氢气。
目前,世界上多数采用电解熔融氯化钠的方法来制得金属钠。
氯化钠的熔点为801℃,将氯化钠和氯化钙按质量比2:3混合共熔,可得到熔融温度约为580℃的共熔物,降低了电解所需的温度。
电解时,正极放出氯气,负极产生的金属钠和金属钙同时浮在共熔物,从管道溢出。
把熔融的金属混合物冷却到105~110℃,金属钙结晶析出,通过过滤可以分离出金属钠。
金属钠的应用非常广泛,可以用于制造过氧化钠(Na 2O 2)等化合物。
还能用于生产更加昂贵的金属钾,以钠和氯化钾为原料,在高温条件下,生成钾和氯化钠,生成的钾能以蒸汽的形式分离出来。
依据文章内容,回答下列问题:(1)在钠的原子结构中,与钠元素化学性质密切相关的是__________。
(2)钠具有的物理性质有__________。
(3)金属钠通常保存在石蜡油中,目的是隔绝__________。
(4)钠能与水反应,化学方程式为__________。
(5)写出用钠制取钾的化学方程式__________。
【答案】最外层电子数 银白色固体(有金属光泽、质地软) 隔绝水和氧气222Na+2H O=2NaOH+H ↑ Na+KClNaCl+K 高温【解析】【分析】【详解】 (1)最外层电子数决定元素化学性质,故在钠的原子结构中,与钠元素化学性质密切相关的是最外层电子数(2)钠的物理性质有:有金属光泽,银白色;(3)金属钠通常保存在石蜡油中,目的是隔绝水和氧气;(4)根据题目信息可知,钠与水反应,生成氢氧化钠和氢气,反应的化学方程式为222Na+2H O=2NaOH+H ↑。
(5)钠与氯化钾在高温条件下生成氯化钠和钾,反应的化学方程式为Na+KCl NaCl+K 高温。
考点:元素化学性质,物质性质,灭火原理。
一、中考初中化学科普阅读题1.海水是名符其实的液体矿产,平均每立方公里的海水中有3570万吨的矿物质,世界上已知的 100 多种元素中,80%已经在海水中找到。
海水是盐的“故乡”,海水中含有各种盐类,其中90%左右是氯化钠,也就是食盐。
另外还含有MgCl2、MgSO4、CaCl2、KI及NaBr 等各种盐类。
氯化镁是点豆腐用的卤水的主要成分,味道是苦的,因此,海水晒盐后所得的母液中含有较多的氯化镁,也叫“苦卤”。
根据上述阅读材料回答问题:(1)海水中含有的阴离子包括Cl-、SO42-及_____(写出一种微粒符号即可)等;(2)苦卤中的溶质主要有:氯化镁、金属溴化物和_______(写出一种物质);(3)工业上把苦卤除钙后,再加入碱性沉淀剂可以制备氢氧化镁。
若海水中钙离子含量太高,氢氧化钙会存在于氢氧化镁颗粒中,从而影响氢氧化镁的纯净度。
某研究小组在控制反应温度是20~25℃和浓海水质量为1109g不变的条件下,进行下述对比实验,数据如下:①该对比实验中发生反应的化学方程式是_____;②进行实验a和b的目的是__________。
③该实验显示________(填实验因素)对钙的除去率的影响很小;④搅拌速率越快,反应时间越长则消耗能源越多。
为了节约能源,获得较高的钙除去率,进一步优化“搅拌速率”和“反应时间”的反应条件。
在其他实验条件不变情况下,设计对比实验,你应选择的反应条件是_____(填选项)。
A 200r/min,3.5hB 200r/min,4.5hC 175 r/min,4hD 225 r/min,4h【答案】Br-/ I-(写出1个即可得分); NaCl/氯化钠;(或能写出阅读资料中提及的物质也可得分) CaCl2+Na2CO3=CaCO3↓ +2NaCl 探究其它条件相同时,碳酸钠加入量对钙除去率的影响反应时间 AC【解析】【详解】⑴海水中90%左右是氯化钠,另外还含有MgCl2、MgSO4、CaCl2、KI及NaBr等,海水中含有的阴离子包括Cl-、SO42-及Br-(或 I-);⑵苦卤是氯化钠析出后留下来中的,所以是氯化钠的饱和溶液,因此溶质主要有:氯化镁、金属溴化物和NaCl;⑶①该对比实验中发生反应的化学方程式是:CaCl2+Na2CO3=CaCO3↓ +2NaCl;②实验a和b,搅拌速度和反应时间都相同,加入碳酸钠的质量不同,故进行实验a和b的目的是探究其它条件相同时,碳酸钠加入量对钙除去率的影响;③对比b和d,实验显示反应时间对钙的除去率的影响很小;④搅拌速率越快,反应时间越长则消耗能源越多。

一、中考初中化学科普阅读题1.阅读短文并回答问题。
白炽灯泡白炽灯泡的灯丝是由金属钨制作的,其灯丝发光时温度可达2000℃左右,为防止灯丝在高温下氧化,在制作灯泡时要抽真空,在制作大功率灯泡时,还要把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华。
白炽灯泡工作时,电能转化为光能的效率较低,因此逐渐被节能灯和LED灯所替代。
(1)由于钨的_____较高,所以用钨制作灯丝;(2)灯泡内充入稀有气体氦等,主要是为了_____;(3)白炽灯泡逐渐退出市场,是由于_____。
【答案】熔点做保护气,使灯泡耐用白炽灯泡工作时,电能转化为光能的效率较低,浪费能源【解析】【详解】(1)金属钨的熔点高,所以可以用来制灯丝;故填:熔点;(2)稀有气体化学性质稳定,可以用作保护气,使灯泡耐用,题干信息中把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华故填:做保护气,使灯泡耐用;(3)白炽灯泡工作时,电能转化为光能的效率较低,浪费能源,因此逐渐被节能灯和LED 灯所替代;故填:白炽灯泡工作时,电能转化为光能的效率较低,浪费能源。
故答案为(1)熔点;(2)做保护气,使灯泡耐用;(3)白炽灯泡工作时,电能转化为光能的效率较低,浪费能源。
2.氯化钠是重要的调味品。
如图分别表示生成氯化钠的不同化学反应,请根据图示回答相关问题:①图1是金属钠与氯气反应生成氯化钠的微观示意图.由图1可知,元素的化学性质与________(填字母序号)密切相关。
A最外层电子数 B质子数 C电子层数②图2描述了氢氧化钠溶液与盐酸反应的微观实质,图中A 、B 、C 三处中B 处应填入的化学符号是________。
③图3所示物质NaClO 2中氯元素的化合价是______,该反应的化学方程式是_________。
【答案】A H + +3 222Cl 2NaClO =2ClO 2NaCl ++【解析】【分析】【详解】元素的化学性质与元素原子最外层电子数密切相关;故填:A②氢氧化钠和盐酸反应的实质是氢离子和氢氧根离子结合生成了水分子,B 处是盐酸电离出来的氢离子;故填:H +③在NaClO 2中,钠元素是+1价,氧元素是-2价,设氯元素的化合价是x ,则有(+1)+x +(-2)×2=0,x =+3;据图可以看出,该反应是 Cl 2和NaClO 2反应生成了ClO 2和NaCl ,故填:+3,222Cl 2NaClO =2ClO 2NaCl ++。

一、中考初中化学科普阅读题1.中科院大连化学物理研究所研究出天然气转化利用的新技术:通过新型高效的催化剂,成功实现了甲烷(CH 4)在无氧条件下一步高效生产氢气、乙烯和苯等高值化学品,没有产生二氧化碳。
相关的物质转化示意图如下:(1)甲烷中碳元素的质量分数为________。
(2)根据催化剂的特性可知,催化剂在甲烷转化的反应前后,其质量和________不变。
(3)甲烷在无氧条件下通过催化剂转化成为A 和B 两种物质的化学方程式为 ________。
(4)物质C 的化学式是________ 。
(5)该新技术的优点是________(写一点)。
【答案】75 % 化学性质 2CH 4催化剂C 2H 4 + 2H 2 C 6H 6 有利于减缓温室效应(或其他合理答案)【解析】【分析】【详解】(1)甲烷中碳元素的质量分数为12100%12+14⨯⨯=75%;故填:75%; (2)催化剂的质量与化学性质在化学反应前后保持不变;故填:化学性质;(3)通过新型高效的催化剂,成功实现了甲烷(CH 4)在无氧条件下一步高效生产乙烯和氢气;故填:42422CH C H +2H 催化剂;(4)由分子结构模型可知,每个C 分子是由6个碳原子和6个氢原子构成的,其化学式为C 6H 6;故填:C 6H 6;(5)通过新型高效的催化剂,成功实现了甲烷(CH 4)在无氧条件下一步高效生产氢气、乙烯和苯等高值化学品,没有产生二氧化碳,所以该技术有利于减缓温室效应;故填:有利于减缓温室效应。
2.海水是名符其实的液体矿产,平均每立方公里的海水中有3570万吨的矿物质,世界上已知的 100 多种元素中,80%已经在海水中找到。
海水是盐的“故乡”,海水中含有各种盐类,其中90%左右是氯化钠,也就是食盐。
另外还含有MgCl 2、MgSO 4、CaCl 2、KI 及NaBr 等各种盐类。
氯化镁是点豆腐用的卤水的主要成分,味道是苦的,因此,海水晒盐后所得的母液中含有较多的氯化镁,也叫“苦卤”。

一、中考初中化学科普阅读题1.二氧化氯(ClO2)是一种环保型杀菌消毒剂。
在生活中主要用于饮用水的消毒和食品保鲜。
用二氧化氯消毒后的水可以直接饮用。
二氧化氯是一种黄绿色、有刺激性气味的有毒气体,密度比空气大,其熔点为-59℃,沸点为11.0℃,易溶于水,且与水反应得到酸性溶液。
该气体具有强烈的腐蚀性,吸入高浓度二氧化氯气体会引起咳嗽和呼吸道粘膜的损伤。
二氧化氯极其不稳定,受热或见光易发生爆炸性分解,直接造成氯气泄漏而污染环境,所以只有依靠现场制备。
工业上用稍潮湿的氯酸钾(KClO3)和草酸(H2C2O4)在60℃时反应制得。
由于制取二氧化氯需要使用的氯酸钾是易爆危险品,所以制备和运输成本很高,因此我国目前还未广泛用其消毒自来水。
请依据文章回答下列问题:(1)本文介绍了二氧化氯的性质、制法和______________等方面内容。
(2)二氧化氯的化学性质有①_____________;②__________________。
(3)请将制备二氧化氯反应的化学方程式填写完全:2KClO3+ 2H2C2O460℃2ClO2↑+ 2CO2↑ + K2C2O4+_______(4)发生二氧化氯泄漏时,紧急处理方法是______________________。
【答案】用途能与水发生化学反应腐蚀性、不稳定性等 2H2O 喷水吸收【解析】【详解】(1)由资料可知,本文介绍了二氧化氯的性质、制法和用途等方面的内容;(2)物质在化学变化中表现出来的性质属化学性质。
根据资料可知二氧化氯的化学性质有:能与水反应,二氧化氯极其不稳定,受热或见光易发生爆炸性分解;(3)根据质量守恒定律化学反应前后原子的种类和数目不变,反应前K:2,Cl:2,O:14,H:4,C:4,反应后K:2,Cl:2,O:12,H:0,C:4 ,故还生成了2个水分子;(4)二氧化氯易溶于水,故发生二氧化氯泄漏时,最简单的紧急处理方法是喷水吸收。
2.阅读下面科普短文。

一、中考初中化学科普阅读题1.阅读下面科普短文。
(资料1)融雪剂按组成分为有机融雪剂和无机融雪剂。
有机融雪剂的主要成分为醋酸钾,一般用于机场等重要场所。
无机融雪剂以氯化钠、氯化钙等为主要成分,其融雪原理与相同条件下,不同浓度的食盐水的凝固点有关(见下表)。
(资料2)钛(Ti )是一种银白色的金属。
它具有良好的耐高温、耐低温、抗酸碱以及高强度、低密度的特点,广泛用于航空工业;它无毒且具有优良的生物相容性,是非常理想的医用金属材料,可用来制造人造骨等。
金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧。
在稀有气体和高温条件下,用四氯化钛和镁发生置换反应可制备金属钛。
依据资料,回答下列问题:(1)若飞机场使用融雪剂,应选择融雪剂的类别是___________。
(2)从无机融雪剂的融雪原理得出:100g 溶剂中,溶质质量和凝固点的关系是_______________。
(3)钛金属广泛应用于航空工业的原因是____________________(答出2条即可)。
(4)金属钛着火时___________(填“能”或“不能”)用二氧化碳灭火。
(5)四氯化钛制备金属钛的化学方程式是__________________________________。
【答案】有机融雪剂 溶质的质量越大,溶液的凝固点越低 高强度、低密度 不能 TiCl 4+2Mg=稀有气体高温2MgCl 2+Ti【解析】(1)有题意可知,若飞机场使用融雪剂,应选择融雪剂的类型是有机融雪剂;(2)由无机融雪剂组成与凝固点的关系,从无机融雪剂的融雪原理得出:100g 溶剂中,溶质质量和凝固点的关系是溶质的质量越大,溶液的凝固点越低;(3)钛金属广泛应用于航空工业的原因是高强度、低密度等;(4)由于金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧,所以,金属钛着火时不能用二氧化碳灭火;(5)四氯化钛制备金属钛的化学方程式是:TiCl 4+2Mg =稀有气体高温2MgCl 2+Ti 。

一、中考初中化学科普阅读题1.中科院大连化学物理研究所研究出天然气转化利用的新技术:通过新型高效的催化剂,成功实现了甲烷(CH 4)在无氧条件下一步高效生产氢气、乙烯和苯等高值化学品,没有产生二氧化碳。
相关的物质转化示意图如下:(1)甲烷中碳元素的质量分数为________。
(2)根据催化剂的特性可知,催化剂在甲烷转化的反应前后,其质量和________不变。
(3)甲烷在无氧条件下通过催化剂转化成为A 和B 两种物质的化学方程式为 ________。
(4)物质C 的化学式是________ 。
(5)该新技术的优点是________(写一点)。
【答案】75 % 化学性质 2CH 4催化剂C 2H 4 + 2H 2 C 6H 6 有利于减缓温室效应(或其他合理答案)【解析】【分析】【详解】(1)甲烷中碳元素的质量分数为12100%12+14⨯⨯=75%;故填:75%; (2)催化剂的质量与化学性质在化学反应前后保持不变;故填:化学性质;(3)通过新型高效的催化剂,成功实现了甲烷(CH 4)在无氧条件下一步高效生产乙烯和氢气;故填:42422CH C H +2H 催化剂;(4)由分子结构模型可知,每个C 分子是由6个碳原子和6个氢原子构成的,其化学式为C 6H 6;故填:C 6H 6;(5)通过新型高效的催化剂,成功实现了甲烷(CH 4)在无氧条件下一步高效生产氢气、乙烯和苯等高值化学品,没有产生二氧化碳,所以该技术有利于减缓温室效应;故填:有利于减缓温室效应。
2.阅读短文并回答问题。
白炽灯泡白炽灯泡的灯丝是由金属钨制作的,其灯丝发光时温度可达2000℃左右,为防止灯丝在高温下氧化,在制作灯泡时要抽真空,在制作大功率灯泡时,还要把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华。
白炽灯泡工作时,电能转化为光能的效率较低,因此逐渐被节能灯和LED灯所替代。
(1)由于钨的_____较高,所以用钨制作灯丝;(2)灯泡内充入稀有气体氦等,主要是为了_____;(3)白炽灯泡逐渐退出市场,是由于_____。

一、中考初中化学科普阅读题1.阅读下面科普短文。
(资料1)融雪剂按组成分为有机融雪剂和无机融雪剂。
有机融雪剂的主要成分为醋酸钾,一般用于机场等重要场所。
无机融雪剂以氯化钠、氯化钙等为主要成分,其融雪原理与相同条件下,不同浓度的食盐水的凝固点有关(见下表)。
(资料2)钛(Ti )是一种银白色的金属。
它具有良好的耐高温、耐低温、抗酸碱以及高强度、低密度的特点,广泛用于航空工业;它无毒且具有优良的生物相容性,是非常理想的医用金属材料,可用来制造人造骨等。
金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧。
在稀有气体和高温条件下,用四氯化钛和镁发生置换反应可制备金属钛。
依据资料,回答下列问题:(1)若飞机场使用融雪剂,应选择融雪剂的类别是___________。
(2)从无机融雪剂的融雪原理得出:100g 溶剂中,溶质质量和凝固点的关系是_______________。
(3)钛金属广泛应用于航空工业的原因是____________________(答出2条即可)。
(4)金属钛着火时___________(填“能”或“不能”)用二氧化碳灭火。
(5)四氯化钛制备金属钛的化学方程式是__________________________________。
【答案】有机融雪剂 溶质的质量越大,溶液的凝固点越低 高强度、低密度 不能 TiCl 4+2Mg=稀有气体高温2MgCl 2+Ti【解析】(1)有题意可知,若飞机场使用融雪剂,应选择融雪剂的类型是有机融雪剂;(2)由无机融雪剂组成与凝固点的关系,从无机融雪剂的融雪原理得出:100g 溶剂中,溶质质量和凝固点的关系是溶质的质量越大,溶液的凝固点越低;(3)钛金属广泛应用于航空工业的原因是高强度、低密度等;(4)由于金属钛不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧,所以,金属钛着火时不能用二氧化碳灭火;(5)四氯化钛制备金属钛的化学方程式是:TiCl 4+2Mg =稀有气体高温2MgCl 2+Ti 。

一、中考初中化学科普阅读题1.阅读短文并回答问题。
白炽灯泡白炽灯泡的灯丝是由金属钨制作的,其灯丝发光时温度可达2000℃左右,为防止灯丝在高温下氧化,在制作灯泡时要抽真空,在制作大功率灯泡时,还要把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华。
白炽灯泡工作时,电能转化为光能的效率较低,因此逐渐被节能灯和LED灯所替代。
(1)由于钨的_____较高,所以用钨制作灯丝;(2)灯泡内充入稀有气体氦等,主要是为了_____;(3)白炽灯泡逐渐退出市场,是由于_____。
【答案】熔点做保护气,使灯泡耐用白炽灯泡工作时,电能转化为光能的效率较低,浪费能源【解析】【详解】(1)金属钨的熔点高,所以可以用来制灯丝;故填:熔点;(2)稀有气体化学性质稳定,可以用作保护气,使灯泡耐用,题干信息中把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华故填:做保护气,使灯泡耐用;(3)白炽灯泡工作时,电能转化为光能的效率较低,浪费能源,因此逐渐被节能灯和LED 灯所替代;故填:白炽灯泡工作时,电能转化为光能的效率较低,浪费能源。
故答案为(1)熔点;(2)做保护气,使灯泡耐用;(3)白炽灯泡工作时,电能转化为光能的效率较低,浪费能源。
2.阅读资料并回答问题钠(Na)是一种银白色金属,质软而轻,可用小刀切割,密度比水小,为 0.97g/cm3,熔点97.81℃,沸点 882.9℃。
钠刚切开时,新切面有银白色光泽,但在空气中马上氧化转变为暗灰色。
钠能与水发生剧烈反应生成氢氧化钠和氢气,量大时发生爆炸。
钠还能在二氧化碳中燃烧,生成纯碱和一种气体氧化物。
金属钠往往浸放于液体石蜡、矿物油和苯系物中密封保存。
(1)贮存金属钠时,用液体石蜡包裹的作用是______;(2)金属钠在二氧化碳中燃烧的反应方程式是_______。
铷(Rb)是一种银白色蜡状金属,化学性质与金属钠很相似,但比金属钠更活泼,遇水即在表面发生剧烈的反应并发生爆炸,该反应可表达为:(3)推测溶液A中可能含有一种我们非常熱悉的离子____(填微粒符号),并设计3个不同的实验方案对此猜想进行验证。