(第八章)第九章植物原生质体培养与体细胞杂交
- 格式:ppt
- 大小:95.50 KB
- 文档页数:56





原生质体的培养1. 原生质体的分离与纯化原生质体培养的意义(1)再生植株由原生质体再生生成植株,不论在进行有关细胞生物学或生物合成和代谢的实验研究上,还是在组织培养实践中,都有一定的优点:①可利用均一的分化细胞群体;②因无细胞壁,试剂对细胞作用更为直接,其反应能直接测量,以使反应产物能较快的分离出来;③在理论和实践中,可极大节省空间,如在一个三角瓶就能培养210个细胞,但在大田种植需要4亩地;④可缩短实验周期,如悬浮培养时仅需1~2个小时。
原生质体培养可在遗传学方面进行基因互补,不亲和性,连锁群和基因鉴定,分析基因的激活和失活水平的研究。
在研究分化问题时,用一个均一的原生质体群体可以筛选数以千计的不同。
营养和激素条件,探索诱导单细胞的分化条件等。
(2)用于远缘体细胞融合,进行体细胞杂交。
这是一种新的远缘杂交方法,为人们提供新的育种方法。
两个亲缘关系较远的植株用一般杂交方法是不容易成功的,而用细胞融合的方法却成为可能。
首先,两个原生质体融合形成异核体,异核体再再生细胞壁,进行有丝分裂,发生核融合,产生杂种细胞,由此可培养新的杂种。
一、原生质体(protoplast)的分离(一)材料来源原生质体是通过质壁分离与细胞壁分开的部分,是能存活的植物细胞的最小单位。
自从1960年用酶法制备大量植物原生质体首次获得成功以来,原生质体培养成为生物技术最重要的进展之一。
通过大量的试验表明,没有细胞壁的原生质体仍然具有"全能性",可以经过离体培养得到再生植株。
原生质体的分离研究较早,1892年Klereker首先用机械的方法分离得到了原生质体,但数量少且易受损伤。
1960年,英国植物生理学家Cocking首先用酶解法从番茄幼苗的根分离原生质体获得成功。
他使用一种由疣孢漆斑菌培养物制备的高浓度的纤维素酶溶液降解细胞壁。
然而,直至1960年纤维素酶和离析酶成为商品酶投入市场以后,植物原生质体研究才成为一个热门的领域。

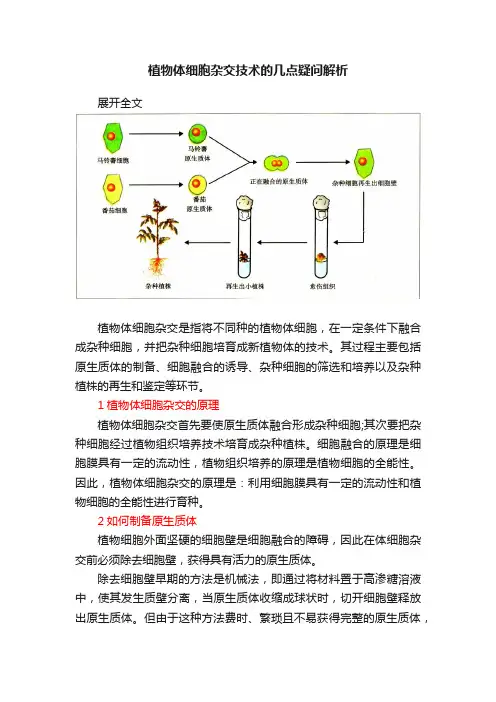
植物体细胞杂交技术的几点疑问解析展开全文植物体细胞杂交是指将不同种的植物体细胞,在一定条件下融合成杂种细胞,并把杂种细胞培育成新植物体的技术。
其过程主要包括原生质体的制备、细胞融合的诱导、杂种细胞的筛选和培养以及杂种植株的再生和鉴定等环节。
1植物体细胞杂交的原理植物体细胞杂交首先要使原生质体融合形成杂种细胞;其次要把杂种细胞经过植物组织培养技术培育成杂种植株。
细胞融合的原理是细胞膜具有一定的流动性,植物组织培养的原理是植物细胞的全能性。
因此,植物体细胞杂交的原理是:利用细胞膜具有一定的流动性和植物细胞的全能性进行育种。
2如何制备原生质体植物细胞外面坚硬的细胞壁是细胞融合的障碍,因此在体细胞杂交前必须除去细胞壁,获得具有活力的原生质体。
除去细胞壁早期的方法是机械法,即通过将材料置于高渗糖溶液中,使其发生质壁分离,当原生质体收缩成球状时,切开细胞壁释放出原生质体。
但由于这种方法费时、繁琐且不易获得完整的原生质体,目前已基本上被酶解法取代。
酶解法是用不同种类和浓度的酶处理植物细胞,将细胞壁解离,以获得原生质体的方法。
由于植物细胞壁的主要成分为纤维素、半纤维素、果胶等,所以酶解法去壁常用的酶主要有纤维素酶、半纤维素酶和果胶酶等。
正常状态下,细胞壁对原生质体具有保护和支持作用。
但在制备原生质体时将细胞壁去除后,裸露的原生质体很可能由于其内外渗透压的不同而发生吸水胀破或失水皱缩。
因此,在酶液中必须加渗透稳定剂以保护原生质体的活力和质膜的稳定性。
此外,酶液的浓度为使细胞发生轻度的质壁分离为宜1。
3如何诱导原生质体融合诱导原生质体融合的方法有化学诱导和物理诱导两种。
化学法又可分为离子诱导融合法、高钙-高pH法、PEG(聚乙二醇)法等。
离子诱导融合法常用的盐类离子有硝酸钠、硝酸钾、硝酸钙、氯化钙等。
由于PEG法对原生质体毒性小、易操作、成本低、不需特殊设备,融合子产生的异核率较高,且融合过程不受物种限制。
因此,该方法在植物体细胞杂交中被广泛使用。




植物细胞原生质体的制备与融合。
1、相关概念:(1)原生质体:是指那些已去除全部细胞壁的细胞。
细胞外仅由细胞膜包裹,呈圆形,要在高渗液中才能维持细胞的相对稳定。
此外,在酶解过程中残存少量细胞壁的原生质体称为原生质球或球状体。
(2)原生质体融合:即体细胞杂交。
用人工的方法,把分离的不同品种或不同种的原生质体诱导成融合细胞,再经离体培养诱导分化和再生完整植株的整个过程。
若取材为体细胞,则成为体细胞杂交。
2、原生质体的制备:在植物组织里,原生质体被坚硬的细胞壁包裹着,而且由于果胶质等使细胞相互紧紧粘连在一起。
在愈伤组织中,这种粘连相对松些;在细胞悬浮培养物中,只有存在细胞团的情况下,有轻度的粘连。
如果破除这种粘连作用,即可使细胞分离开来,进一步去除细胞壁,就能使裸露的原生质体游离出来。
游离效率的高低主要与植物材料和酶混合浓的组成有关。
基本程序如下:取材→除菌→酶解(加酶、渗透压稳定剂)→原生质体的收集与纯化→洗涤→原生质体活力的测定。
(1)取材与除菌:原则上植物任何部位的外植体都可成为制备原生质体的材料。
但人们往往对活跃生长的器官和组织更感兴趣。
因为,由此制得的原生质体一般都生活力较强,再生与分生比例较高。
常用的外植体包括:种子根、子叶、下胚轴、胚细胞、花粉母细胞、悬浮培养细胞和嫩叶。
对外植体的除菌要因材而异,悬浮培养细胞一般无需除菌。
对较脏的外植体往往要先用肥皂水清洗再以清水洗2-3次,然后浸入70%酒精消毒后,再放进3%次氯酸钠处理。
最后用无菌水漂洗数次,并用无菌滤纸吸干。
(2)酶解:现以叶片为例说明如何制备植物原生质体。
①配制酶解反应液:反应液应是一种pH值在5.5-5.8的缓冲液,内含纤维素酶0.3%-3.0%以及渗透压稳定剂,细胞膜保护剂和表面活性剂等。
③酶解:除菌绿。
反应液转绿是酶解成功的一项重要指标,说明已有不少原生质体游离在反应液中。
经镜检确认后应及时终止反应,避免脆弱的原生质体受到更多的损害。