实验7硅酸盐矿物的晶体结构
- 格式:doc
- 大小:1.13 MB
- 文档页数:4







硅酸盐晶体的结构特点
硅酸盐晶体是由硅、氧和金属元素构成的化合物,其结构特点包括:
1. 硅氧四面体:硅酸盐的基本结构单元是硅氧四面体,其中硅原子居中心,与四个氧原子形成化学键,而氧原子位于顶角。
2. 晶体结构:硅酸盐晶体多数具有金属阳离子与硅、氧离子结合的空间结构,形成了规则的晶体结构。
不同的阳离子会诱导不同的晶体结构,产生特定的光学和电学性能。
3. 多种硅氧比:在硅酸盐中,硅与氧的原子个数比(硅氧比)可以变化很大,这导致晶体结构的变化,从而影响其物理化学性质。
4. 复杂的连接方式:硅酸盐晶体中,硅氧四面体可以通过顶角共享的方式连接成复杂的网络。
不同连接方式会形成不同的晶体结构,进一步影响其物理化学性质。
5. 离子性:硅酸盐晶体的离子性较强,这与其结构中存在的离子键有关。


硅酸盐晶体结构的基本特点嘿,大家好啊!今天咱来聊聊这个听起来有点高大上的“硅酸盐晶体结构的基本特点”。
你们想想哈,这硅酸盐晶体结构啊,就像是一个超级有组织、有纪律的大家庭。
每个成员都有自己特定的位置和作用呢!这些小家伙们排列得那叫一个整齐有序,就跟阅兵式上的士兵似的。
先说说它的一个特点——四面体结构。
哎呀呀,这就像是搭积木一样,硅原子和氧原子凑在一起,就组成了一个个四面体形状。
这四面体啊,稳定又可靠,就像家里的顶梁柱一样。
还有哦,它们还喜欢玩“抱团”游戏呢!这些四面体可以通过共用顶点呀、边呀啥的连接起来,组成各种复杂又奇妙的结构。
就好比大家手牵手,形成了一个团结友爱的大集体。
这硅酸盐晶体结构还有个特点,就是它的多样性。
哇,那真的是让人眼花缭乱呀!就像一个大杂烩,什么样的结构都有。
有的像钻石一样闪亮,有的像棉花糖一样柔软,真是无奇不有。
而且啊,它们还特别“固执”呢!一旦形成了某种结构,就不太容易改变。
就像有些人的脾气,一旦拗起来,九头牛都拉不回来。
不过这也说明它们很稳定嘛,可靠着呢!我跟你们说,了解了这些硅酸盐晶体结构的特点,就感觉像是打开了一个新世界的大门。
以前看到那些奇奇怪怪的矿物质,都不知道从哪儿下手去理解它们。
现在好了,知道了它们的结构特点,就好像找到了一把钥匙,能解开这些矿物质的秘密。
咱在生活中不也经常会遇到各种结构嘛,想想那些高楼大厦,不也是由各种材料按照一定的结构搭建起来的嘛。
所以说啊,这硅酸盐晶体结构的基本特点,不仅仅是在科学领域有用,在咱日常生活里也能找到影子呢!总之,这硅酸盐晶体结构的特点啊,真是有趣又神奇。
让我这个好奇宝宝越研究越觉得有意思呢!你们觉得呢?是不是也对这个神秘的领域充满了好奇呀!。
岛状硅酸盐矿物的结构特征最近又仔细研究了下岛状硅酸盐矿物的结构特征,发现了一些挺有意思的地方呢。
先说这个硅氧四面体吧,这可是岛状硅酸盐矿物结构里很重要的部分。
让我想想这个硅氧四面体的特点,它呢就像是一个中心有一个硅原子,然后被四个氧原子包围着的小团体。
这四个氧原子可不是随随便便在那的,它们就像紧紧抱在一起的小伙伴,而且这种结构相对独立,就好像是每个硅氧四面体都自己自成一家,在岛状硅酸盐矿物里,就像是一个个孤岛一样,这或许就是岛状这个名字的由来吧。
我在观察的时候呀,就发现这些硅氧四面体之间的连接方式还挺复杂的。
有时候它们是通过其他的离子键去连接起来的。
这里的离子键就像一种小钩子,把这些一个个的“孤岛”给拉在一起。
比如说镁离子啊,钙离子之类的,就像是传递连接信号的小邮差一样,它们穿插在这些硅氧四面体中间,靠这种离子间的吸引力,让整个矿物结构稳定下来。
不过在这里我也有个小困惑,就是这个硅氧四面体的大小是不是固定不变的呢?我感觉大概是一定的,毕竟硅原子和氧原子的大小不会有太多变化,但是在不同的矿物里吧,又好像看着有点大小上的差别。
我也可能是看错了或者没有测量准确,毕竟这得很精确地去看才行。
还得提到一个特征,就是岛状硅酸盐矿物里的对称性质。
这在观察结构的时候是个挺明显的点。
我看的时候就觉得有些矿物结构像是很规整的几何图形一样,左右两边好像照着镜子。
就比如说橄榄石这种岛状硅酸盐矿物,它的晶体结构就像是经过精心排列的一样,每个部分都有一定的对称关系。
这对称关系呀,就像是设计师精心规划的布局似的,非常讲究。
我还试图拿小模型去模拟呢,我就搞了几个小球代表原子,然后拿小棍来代表化学键,尝试着拼凑出这种岛状硅酸盐矿物的结构。
在这个过程里呀,我更加清楚地看到了各个部分是怎么组合在一起的。
这硅氧四面体怎么和其他的离子相互作用,离子在整个结构里的分布。
从空间结构上来看,岛状硅酸盐矿物里原子和离子的排列还挺有层次感的。
你看啊,硅氧四面体像是打底的基础建筑,其他的离子就像住在这个建筑里或者围绕着建筑活动的小居民一样。
第5章硅酸盐矿物的结构特征内容提要:本章重点介绍硅酸盐矿物的结构特征以及由此决定的硅酸盐矿物的物理性质。
学习目标:掌握五种硅酸盐结构类型,重点是层状和架状硅酸盐的结构特征;学会利用结构模型来预测矿物的性质。
学习建议:1、硅酸盐结构类型的划分是依据硅氧骨干的类型来划分的,所以必须掌握五种硅氧骨干的类型。
2、注意了解铝在硅酸盐中的双重作用3、硅酸盐结构对硅酸盐矿物的形态和物理性质有决定性作用,注意掌握它们之间的相互关系。
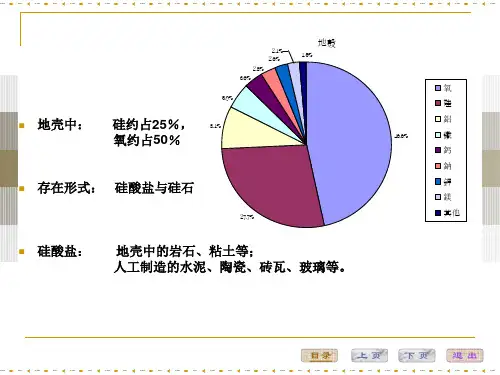
4、本章建议学时:2-3学时硅和氧是地壳中分布最广、平均含量最高的元素,其克拉克值分别为27.72%市46.6%。
硅和氧除结合形成SiO2矿物外,主要形成络阴离子与其他阳离子结合形成大量的硅酸盐。
硅酸盐矿物是三大类岩石(岩浆岩、变质岩、沉积岩)的主要造岩矿物,同时也是工业上所需要的多种金属和非金属的矿物资源。
§5-1 晶体化学特点1 化学成分组成硅酸盐矿物的主要元素如表所示。
由表格可以看出,组成硅酸盐矿物的主要是惰气型离子和部分过渡型离子,而铜型离子则很少见。
作为阴离子,除去主要由Si和O组成的络阴离子外,还可以出现附加阴离子O2-、OH-、F-、Cl-,以及S2-、[CO3]2-、[SO4]2-等。
此外,还可以有H2O分子参加。
2 硅氧骨干在硅酸盐结构中,每个Si一般为四个O所包围,构成[SiO4]四面体(如图),它是硅酸盐的基本构造单位。
目前所发现的硅氧骨干形式已有数十种,主要类型举例有六种:2.1 岛状硅氧骨干本类硅氧骨干被其它阳离子所隔开,彼此分离犹如孤岛。
包括孤立的[SiO4]单四面体及[Si2O7]双四面体。
前者如橄榄石(Mg,Fe)2[SiO4],后者如异极矿Zn4[Si2O7] (OH)2。
2.2 环状硅氧骨干[SiO4]四面体以角顶联结形成封闭的环,根据[SiO4]四面体环节的数目可以有:三环[Si3O9]-如硅酸钡钛矿BaTi[Si3O9]四环[Si4O12]-如包头矿Ba4(Ti,Nb,Fe)8O16[Si4O12] C1六环[Si6O18]-如绿柱石Be3Al2[Si6O18]等多种环还可以重叠起来形成双坏,如六方双环[Si12O30] (如整柱石KCa2AlBe2[Si12O30]·1/2H2O)等。
实验7 硅酸盐矿物的晶体结构
一、实验目的:
巩固硅酸盐矿物的晶体结构知识。
二、硅酸盐晶体结构概述
硅酸盐晶体按结构中硅氧四面体的连接方式,可以分为岛状、组群状、链状、层状和架状五种。
1. 岛状结构
岛状结构硅酸盐晶体中硅氧四面体以孤立形式存在,硅氧四面体之间没有共用的氧。
典型的矿物是镁橄榄石,其结构如图7-1所示。
镁橄榄石(Mg2SiO4)的晶体结构属正交晶系Pbmm空间群,a0=0.476nm,b0=1.021nm,c0=0.598nm,Z=4。
镁橄榄石的结构中O2-近似于六方紧密堆积,Si4+充填在四面体空隙,Mg2+充填于八面体空隙,硅氧四面体之间由Mg2+按镁氧八面体的方式相连。
图7-1 镁橄榄石晶体理想结构图7-2 绿宝石的晶体结构
2. 组群状结构
组群状结构是指硅氧四面体以两个、三个、四个或六个,通过共用氧连成硅氧四面体群体,群体之间由其它阳离子按一定的配位形式将它们连接在一起。
典型的矿物是绿宝石,其晶体结构如图7-2所示。
绿宝石(Be3Al2[Si6O18])的晶体结构属于六方晶系P6/mcc空间群,a0=0.921nm,c0=0.917nm,Z=2。
绿宝石的基本结构单元是六个硅氧四面体形成的六节环,六节环之间由Al3+和Be2+相连。
六节环中的四面体有两个氧是共同的,它们与硅氧四面体中的Si4+处于同一高度。
图7-2中示出了八个这样的六节环,上面四个和下面四个错开30 排列,上下叠置的六节环内形成了一个巨大的通道,可以存在一些如K+、Cs+等大的阳离子以及H2O分子。
Al3+的配位数为6,形成Al-O八面体,Be2+的配位数为4,构成Be-O四面体。
3. 链状结构
硅氧四面体可以由共用氧离子相连,在一维方向延伸成链状,链与链之间再通过其它阳离子按一定的配位关系连接而形成链状结构。
透辉石(CaMg[Si2O6])是具有链状结构的硅酸盐矿物之一,其晶体结构属于单斜晶系C2/c空间群,a0=0.9746nm,b0=0.8899nm,c0=0.5250nm,β=105︒37’,Z=4。
透辉石结构中以沿c轴方向延伸的单链为基本结构单元,链交叉排列,链与链之间由Ca2+和Mg2+相连(如图7-3),Ca2+的配位数为8,Mg2+的配位数为6。
图7-3 透辉石的晶体结构
4. 层状结构
层状结构是硅氧四面体在二维平面内通过三个共用氧连接而延伸成一个硅氧四面体层,硅氧层中(图7-4),处于同一平面的三个氧离子都被硅离子共用而形成一个无限延伸的六节环层,这三个氧为桥氧。
另一个顶角向上的氧(自由氧),与硅氧层以外的阳离子如Al3+、Mg2+、Fe2+、Fe3+等相连,形成Al-O、Mg-O等八面体。
自由氧在空间排列形成六边形网络,因此Al-O、Mg-O八面体也连成六边形网络。
八面体之间以共棱方式相连,当八面体中的O2-只被两个阳离子共用时,形成二八面体,当八面体中的O2-被三个阳离子共用时,则形成三八面体。
但不论是二八面体还是三八面体,在形成六边形网络时总有一些O2-离子不能被Si4+离子所共用,O2-离子多余的一价由H+离子来平衡,这就是在层状硅酸盐晶体的化学组成中为什么都有(OH)-离子存在的原因。
由此可知,层状硅酸盐晶体结构中的基本单元是硅氧四面体层和含有氢氧的铝氧和镁氧八面体层。
硅氧四面体层和铝氧或镁氧八面体层的连接方式有两种,一种是1:1型层状结构,即由一层四面体层和一层八面体层相连,另一种是2:1型层状结构,即由两层四面体层夹一层八面体层,(图7-5)。
层与层之间以微弱的分子键或OH-离子产生的氢键来联系,所以层之间可以有水分子存在,某些阳离子也可以以水化阳离子的形式进入层间。
图7-6和图7-7中示出了高岭石和蒙脱石的晶体结构。
高岭石(Al4[Si4O10](OH)8)的晶体结构属于三斜晶系C1空间群,a0=0.5139nm,b0=0.8932nm,c0=0.7371nm,α=91︒36’,β=104︒48’, γ=89︒54’,Z=1,是1:1型层状结构,层之间的联系主要是氢键,结构单位层间不易进入水分子,可以交换的阳离子容量也小。
蒙脱石((M x nH2O)(Al2-x Mg x)[Si4O10](OH)2)的晶体结构属于单斜晶系C2/m空间群,a0≈0.523nm,b0≈0.906nm,c0值可变,当结构单位层之间无水时c0≈0.960nm,如果结构单位层之间有水分子存在,则c0值将随水分子的多少以及层间可交换的阳离子不同而不同,Z=2,为2:1型层状结构。
在铝氧八面体层中,大约有1/3的Al3+离子被Mg2+离子取代,为了平衡多余的负电价,结构单位层之间有其它阳离子进入,如Na+、Ca2+等离子以水化阳离子的形式进入结构,但水化阳离子和硅氧四面体中O2-离子的作用力较弱,在一定的条件下这些水化阳离子容易被交换出来,因此,c轴可以膨胀以及阳离子交换容量大是蒙脱石的结构特征。
图7-4 硅氧四面体层结构图7-5 层状结构中硅氧四面体层和铝氧或镁氧八面体层的
连接方式(A) 1:1型(B) 2:1型
5. 架状结构
架状结构中每个硅氧四面体的四个角顶都与相邻的硅氧四面体共顶而排列成具有三维空间的“架”。
除了在实验六中讨论的石英外,长石族晶体结构就属于架状结构,图7-8是透长石的晶体结构示意图。
透长石(K[AlSi3O8])的晶体结构属于单斜晶系C2/m空间群,a0=0.856nm,b0=1.303nm,c0=0.718nm,α=90︒,β=115︒59’, γ=90︒,Z=4。
透长石结构中的基本单位是四个四面体(硅氧或铝氧四面体)相互共顶形成一个四联环,其中两个四面体的尖顶朝上,另两个尖顶向下。
这样,它们又可以分别与上下的四联环共顶相连,成为曲轴状的链,其方向平行于a轴(图7-9),链与链之间又以氧桥连接,构成三维架状结构。
图7-6 高岭石的晶体结构图7-7 蒙脱石的晶体结构
图7-8 透长石的晶体结构图7-9 长石结构中的四联环和曲轴状链
(A) 理想的曲轴状链(B) 四联环(C) 实际的曲轴状链
三、实验内容
1. 观察下列硅酸盐晶体结构,了解各晶体所属结构类型及其结构中正负离子的配位关系。
橄榄石,绿宝石,高岭石,蒙脱石,a-方石英,透长石
2. 试作一种硅酸盐结构模型
四、思考题
1.硅酸盐晶体结构有哪5中结构形式?
2.高岭石和蒙脱石的晶体结构有何异同?
什么是架状结构?请说出有代表性的矿物名称和其晶体结构特征。