硅酸盐晶体结构
- 格式:ppt
- 大小:677.00 KB
- 文档页数:50


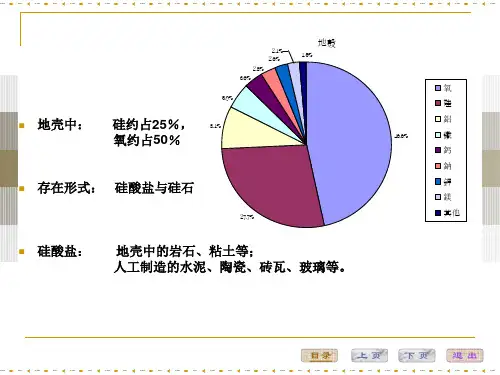


晶体结构硅酸盐晶体结构晶体结构是指晶体中原子、离子或分子的排列方式。
硅酸盐晶体是指以硅酸根为基础的晶体,其中硅离子(SiO_4^4-)与其他阳离子形成网络结构。
硅酸盐晶体结构的研究对于了解晶体的物理性质以及在材料科学中的应用具有重要意义。
硅酸盐晶体结构可以分为四类:随机硅酸盐、连续硅酸盐、不连续硅酸盐、氟硅酸盐。
随机硅酸盐晶体结构是指硅酸盐中的硅酸根离子(SiO_4^4-)和其他离子随机排列的结构。
这类结构的特点是硅酸根离子之间没有明确的排列规律,并且硅酸根离子与其他离子之间的距离也比较随机。
随机硅酸盐晶体结构可以用来制备玻璃等非晶态材料。
连续硅酸盐晶体结构是指硅酸盐中的硅酸根离子(SiO_4^4-)按照一定的排列规律形成的结构。
这类结构的特点是硅酸根离子之间有明确的连接方式,形成一维、二维或三维的网络结构。
连续硅酸盐晶体结构具有较高的晶体度和结晶度,可以用来制备陶瓷等工程材料。
不连续硅酸盐晶体结构是指硅酸盐中的硅酸根离子(SiO_4^4-)与其他离子之间有插入不连续的阳离子,形成硅酸盐层状结构。
这类结构的特点是硅酸根离子之间有明确的排列规律,但是硅酸根离子与其他离子之间的距离不均匀。
不连续硅酸盐晶体结构可以用来制备硅酸钙等复合功能材料。
氟硅酸盐晶体结构是指硅酸盐中的硅酸根离子(SiO_4^4-)的一部分或全部被氟离子(F^-)取代的结构。
这类结构的特点是硅酸根离子与氟离子之间有明确的排列规律,并且形成独特的晶体结构。
氟硅酸盐晶体结构具有特殊的光学、电学和热学性质,可以用来制备光学器件、电子器件和热障涂层等材料。
总之,硅酸盐晶体结构的研究对于深入了解晶体的性质、设计新型材料以及开发新的应用具有重要意义。
随着材料科学的进步和技术的发展,我们对硅酸盐晶体结构的理解将进一步深化,为新材料的开发和应用提供更多的可能性。



硅酸盐晶体的结构特点
硅酸盐晶体是由硅、氧和金属元素构成的化合物,其结构特点包括:
1. 硅氧四面体:硅酸盐的基本结构单元是硅氧四面体,其中硅原子居中心,与四个氧原子形成化学键,而氧原子位于顶角。
2. 晶体结构:硅酸盐晶体多数具有金属阳离子与硅、氧离子结合的空间结构,形成了规则的晶体结构。
不同的阳离子会诱导不同的晶体结构,产生特定的光学和电学性能。
3. 多种硅氧比:在硅酸盐中,硅与氧的原子个数比(硅氧比)可以变化很大,这导致晶体结构的变化,从而影响其物理化学性质。
4. 复杂的连接方式:硅酸盐晶体中,硅氧四面体可以通过顶角共享的方式连接成复杂的网络。
不同连接方式会形成不同的晶体结构,进一步影响其物理化学性质。
5. 离子性:硅酸盐晶体的离子性较强,这与其结构中存在的离子键有关。

硅酸盐物理化学篇一:硅酸盐物理化学是一门研究硅酸盐及其相关物质的物理、化学和热力学行为的学科,涵盖了硅酸盐的晶体结构、性质、制备和加工,以及硅酸盐在材料科学、能源利用和环境保护等领域中的应用。
正文:1. 硅酸盐的晶体结构硅酸盐晶体是一种特殊的晶体结构,由硅、氧、氢、钙、镁、铝等元素组成。
在硅酸盐晶体中,硅和氧原子以共价键结合,形成六边形晶胞。
同时,钙、镁、铝等元素也以共价键或离子键与硅和氧原子结合,形成不同形态的晶体结构,如离子硅酸盐、晶系硅酸盐等。
2. 硅酸盐的性质硅酸盐具有许多独特的物理和化学性质,使其成为重要的材料和应用。
以下是一些硅酸盐的常见性质:- 热稳定性:硅酸盐在高温下仍然保持稳定的性质,不易被氧化或分解。
- 电绝缘性:硅酸盐是良好的电绝缘体,能够有效地防止电流的流失和干扰。
- 强度:硅酸盐具有强大的强度和硬度,可以用于制造高强度和高温的结构材料。
- 透明度:硅酸盐的晶体结构使其具有透明度,可以用于制造透明材料。
- 化学稳定性:硅酸盐在酸碱和其他化学物质的环境中保持稳定的性质。
3. 硅酸盐的制备和加工硅酸盐的制备和加工是硅酸盐物理化学研究的重要方向。
以下是一些硅酸盐的制备和加工方法:- 熔融法:熔融法是制备硅酸盐的主要方法之一,可以将硅、氧和其他元素在高温下熔融,并通过过滤、结晶等方法得到硅酸盐晶体。
- 蒸发法:蒸发法可以制备离子型硅酸盐,该方法将硅、氧和其他元素蒸发在高温高压条件下,形成硅酸盐晶体。
- 结晶法:结晶法可以将熔融的硅酸盐通过结晶的方法得到晶体。
该方法通常需要对硅酸盐熔体进行冷却和结晶,以得到不同形态的硅酸盐晶体。
篇二:硅酸盐物理化学是一门研究硅酸盐类化合物的结构和性质的综合性化学学科。
该学科涵盖了硅酸盐的晶体结构、物理性质和化学性质,以及相关的制备、合成、表征和应用等方面。
硅酸盐晶体是一种具有独特结构的无机化合物,由硅、氧、氢和少量的钙、镁、铝等元素组成。
硅酸盐晶体的构造和性质对于其应用具有重要意义,例如,在玻璃工业中,硅酸盐是生产玻璃的主要成分;在建筑材料中,硅酸盐用作陶瓷原料;在半导体工业中,硅酸盐是生产硅电子器件的原料;在化学和生物学领域中,硅酸盐的研究对于理解物质的结构和性质具有重要意义。
