金刚石石墨碳六十
- 格式:ppt
- 大小:4.60 MB
- 文档页数:1

金刚石化学成分:C。
常含有Cr、Mn、Ti、Mg、Al、Ca、Si、N、B等。
颜色:常见的为浅黄色、浅黄褐色、浅黄绿色、褐色,无色(浅黄白、白、优白)占有一定数量,玫瑰色、粉红色、浅蓝色、绿色、黑色、茶色十分稀少。
透明度:无色及浅色金刚石均成透明状,在无色中的白、优白金刚石测定透过率达95%以上,深色金刚石及具毛玻璃蚀象的透明度减弱呈现半透明状,当金刚石中包体含量增加亦影响透明度。
硬度:摩氏硬度10,新摩氏硬度15,显微硬度10000kg/mm2,显微硬度比石英高1000倍,比刚玉高150倍。
金刚石硬度具有方向性,八面体晶面硬度大于菱形十二面体晶面硬度,菱形十二面体晶面硬度大于六面体晶面硬度。
密度:金刚石密度与金刚石晶体中的包含物密切相关,无色透明质纯的金刚石密度为3.52g/cm3,当具有包含物时密度为3.44~3.53g/cm3。
导电性:绝大多数金刚石是电介质,电阻率:5×104Ω.cm,Ⅰ型及Ⅱ型(Ⅱa)金刚石为绝缘体,比电阻>1016Ω.cm,I型(H b)金刚石为P型半导体,比电阻10~103Ω.cm,温度上升到600℃或下降到-150℃时,电阻提高。
刚度、强度:金刚石具有极大的弹性模量,是自然界最高的磨削材料,弹性模量达90000kg/mm。
摩擦系数小,有极高的抗磨能力,因此在金刚石选矿中利用这一特性,采用球磨机、锥形磨矿机来分离金刚石。
但金刚石极脆,不能承受正向的外力撞击。
熔点:金刚石熔点达4000℃,在空气中燃烧温度为850~1000℃,在纯氧中720~800℃燃烧,金刚石发出浅蓝色火焰,并转化成二氧化碳。
化学稳定性:化学性质非常稳定,在酸、碱中均不分解,在熔融的硝酸钠、硝酸钾、碳酸钠中溶解用途:金刚石现在的主要用处却不再是用来做宝石,由于它是人们已发现的一种最坚硬的物质,已被用来作为制作切割、钻孔、研磨等工具的非常重要的工业材料。
碳单质有定型碳和无定型碳两类。
金刚石、石墨是重要的定型碳.1.利用金刚石硬度大、耐高温可做钻探机的钻头;利用硬度大,可做玻璃刀;由于金刚石对光有优异的折射作用,可做装饰品。

金刚石、石墨和C60一、碳的单质金刚石、石墨和C60都是由碳元素组成的单质,但三种单质中碳原子的排列方式不同,导致他们的物理性质和用途上存在比较大的差异。
即:结构决定性质,性质决定用途。
1.金刚石纯净的金刚石是无色透明、正八面体形状的固体。
金刚石是天然存在的最硬的物质。
右图是金刚石的微观结构图,每一个小球代表一个碳原子,每个碳原子位于一个正四面体的中心,周围四个碳原子位于四个顶点上,在空间构成连续的、坚固的骨架结构。
这样的结构决定了金刚石的性质的稳定性。
世界上最著名的金刚石产地在南部非洲。
这个地区的金刚石常常存在死火山的喷井中。
人们认为它们是在极高的温度和压强下慢慢地形成的。
开采出来的金刚石并没有宝石的外形和光彩,通过切割和磨光等工艺才给它们以光耀的外形。
习惯上人们常将加工过的称为钻石,而未加工过的称为金刚石。
金刚石是最好的热导体。
完整的金刚石单晶的导热性是银和铜的导热性的5倍(银和铜是最好的金属导体)。
它的不导电性结合着它的优良的导热性使金刚石在半导体装置方面很有用。
金刚石在普通溶剂中是不溶解的。
人造金刚石与天然金刚石在化学上是完全等同的,但它们是在实验室中生产出来的。
它们是在对石墨以及作为溶剂和催化剂的金属施以极高的压强(5500大气压)和高温(2000℃)约一天的时间后制得的。
金刚石的硬度很大。
它是碳的最密集的形式,密度大约是水的3.5倍。
它的硬度(抗磨性)和密度都可以用它的结构来解释。
由于它极高的硬度,金刚石被用于切割、钻孔和研磨。
金刚石常被用来作为经久耐用的唱机针头。
2.石墨石墨是深灰色的有金属光泽而不透明的细鳞片状固体。
质地很软,有滑腻感,在隔绝空气的条件下,其熔点在3000℃以上,是最耐高温的矿物之一。
右图是石墨的微观结构示意图。
石墨晶体是层状结构。
在每一层内,每个碳原子都和相邻的三个碳原子相连,六个碳原子排成正六边形,一个个六边形排列成平面的网状结构。
层与层之间作用力较微弱,因此石墨的润滑性很好。

课题1金刚石、石墨和C60一、教学内容金刚石、石墨和C60二、考点清单1、了解金刚石和石墨的物理性质和主要用途。
2、知道碳单质的化学性质。
3、知道C60分子的结构特点和潜在应用前景。
三、全面突破考点1 碳的单质1、金刚石(C)是自然界中最硬的物质,无色透明,正八面体。
可用于制钻石;刻划玻璃、钻探机的钻头(体现了它的硬度大)等。
2、石墨(C)是最软的矿物之一,深灰色,具有金属光泽,是细鳞片状的固体,有优良的导电性,润滑性。
可用于制铅笔芯(体现了它呈深灰色、质软)、干电池的电极(体现了它的导电性)、电车的电刷(体现了它的导电性,滑腻感、常温下化学性质稳定)、作润滑剂(体现它具有滑腻感)等。
金刚石和石墨的物理性质有很大差异的原因是:碳原子的排列不同。
3、无定形碳:由石墨的微小晶体和少量杂质构成.主要有:焦炭,木炭,活性炭,炭黑等。
活性炭、木炭具有强烈的吸附性(因为具有疏松多孔的结构),木炭可用于食品、工业产品中除去色素、异味等,活性炭可用于防毒面具中除去毒气、制糖业中脱色以制白糖;焦炭用于冶铁,炭黑加到橡胶里能够增加轮胎的耐磨性。
注意:吸附性是活性炭、木炭的物理性质4、C60:C60分子是由60个碳原子构成的分子,形似足球,结构稳定。
【典型例题】例1:下列有关碳的物质的用途说法错误的是A. 金刚石中混有杂质就呈现不同颜色B. 铅粉和少量石墨粉制作铅笔芯C. 长期未用而难开启的锁,可在锁孔中加入少量铅笔芯粉末来作润滑剂D. 活性炭可作冰箱的去味剂【解析】本题主要利用碳的单质的物理性质及对应的用途。
如:金刚石经过仔细雕琢,可成为璀璨夺目的装饰品——钻石。
利用石墨质软的性质可制成铅笔芯,因为石墨具有滑腻感,可用来作润滑剂。
利用活性炭的吸附性可作冰箱的除味剂。
【答案】B例2:金刚石和石墨的不同点是A. 金刚石是纯净物,石墨是混合物B. 金刚石是单质,石墨是化合物C. 金刚石和石墨中碳原子的排列不同D. 金刚石和石墨中碳原子内部结构不同【解析】金刚石和石墨都是由碳元素组成的,但由于在金刚石和石墨里碳原子的排列方式不同,所以金刚石和石墨是两种不同的单质。

金刚石金刚石晶莹美丽,光彩夺目,是自然界最硬的矿石。
在所有物质中,它的硬度最大。
测定物质硬度的刻画法规定,以金刚石的硬度为10来度量其它物质的硬度。
例如Cr的硬度为9、Fe为4.5、Pb为1.5、钠为0.4等。
在所有单质中,它的熔点最高,达3823K。
金刚石晶体属立方晶系,是典型的原子晶体,每个碳原子都以sp3杂化轨道与另外四个碳原子形成共价键,构成正四面体。
这是金刚石的面心立方晶胞的结构。
由于金刚石晶体中C—C键很强,所有价电子都参与了共价键的形成,晶体中没有自由电子,所以金刚石不仅硬度大,熔点高,而且不导电。
室温下,金刚石对所有的化学试剂都显惰性,但在空气中加热到1100K左右时能燃烧成CO2。
金刚石俗称钻石,除用作装饰品外,主要用于制造钻探用的钻头和磨削工具,是重要的现代工业原料,价格十分昂贵。
石墨石墨乌黑柔软,是世界上最软的矿石。
石墨的密度比金刚石小,熔点比金刚石仅低50K,为3773K。
在石墨晶体中,碳原子以sp2杂化轨道和邻近的三个碳原子形成共价单键,构成六角平面的网状结构,这些网状结构又连成片层结构。
层中每个碳原子均剩余一个未参加sp2杂化的p轨道,其中有一个未成对的p电子,同一层中这种碳原子中的m电子形成一个m 中心m电子的大∏键(键)。
这些离域电子可以在整个儿碳原子平面层中活动,所以石墨具有层向的良好导电导热性质。
石墨的层与层之间是以分子间力结合起来的,因此石墨容易沿着与层平行的方向滑动、裂开。
石墨质软具有润滑性。
由于石墨层中有自由的电子存在,石墨的化学性质比金刚石稍显活泼。
由于石墨能导电,有具有化学惰性,耐高温,易于成型和机械加工,所以石墨被大量用来制作电极、高温热电偶、坩埚、电刷、润滑剂和铅笔芯。
碳六十20世纪80年代中期,人们发现了碳元素的第三种同素异形体——C60。
碳六十的发现和结构特点1996年10月7日,瑞典皇家科学院决定把1996年诺贝尔化学奖授予Robert FCurl,Jr(美国)、Harold WKroto(英国)和Richard ESmalley(美国),以表彰他们发现C60。


中考化学知识点:金刚石、石墨和C60
金刚石、石墨和C60
一、碳的几种单质(金刚石、石墨、C60)
1、金刚石(C)是自然界中最硬的物质,无色透明,正八面体。
可
用于制钻石;刻划玻璃、钻探机的钻头(体现了它的硬度大)等。
2、石墨(C)是最软的矿物之一,深灰色,具有金属光泽,细鳞片
状的固体,有优良的导电性,润滑性。
可用于制铅笔芯(体现它深灰色、质软)、干电池的电极(体现了它的导电性)、电车的电刷(体现了它的
导电性,滑腻感、常温下化学性质稳定)、做润滑剂(体现它具有滑腻感)等
金刚石和石墨的物理性质有很大差异的原因是:碳原子的排列不同。
3、无定形碳:由石墨的微小晶体和少量杂质构成.主要有:焦炭,木炭,活性炭,炭黑等.
活性炭、木炭具有强烈的吸附性(因为具有疏松多孔的结构),木
炭可用于食品、工业产品中除去色素、异味等,活性炭可用于防毒面
具中除去毒气、制糖业中脱色以制白糖;焦炭用于冶铁,炭黑加到橡胶
里能够增加轮胎的耐磨性。
注意:吸附性是活性炭、木炭的物理性质
4、C60:C60分子由60个碳原子构成的分子,形似足球,结构稳定。
二、.单质碳的化学性质:
单质碳的物理性质各异,而各种单质碳的化学性质却完全相同!
1、常温下的化学性质比较稳定。
所以古代用墨书写、绘画的字画保存时间很久,仍不变色。
2、可燃性:。


课题1 金刚石、石墨和C60知识导航课前引入“钻石恒久远,一颗永流传”。
钻石对得起它昂贵的价格吗?知识精讲金刚石、石墨和C60等都是由碳元素组成的不同单质。
由于碳原子的排列方式不同,即结构不同,导致它们的性质尤其是物理性质有很大差异。
一、金刚石1.外观:无色透明、正八面体状晶体(网状结构)2. 光泽:加工后璀璨夺目3. 硬度:天然存在的最硬的物质4. 导电性:不导电5. 导热性:良好6. 用途:装饰品——钻石;切割玻璃、大理石、做钻探机的钻头等。
二、石墨1.外观:深灰色、细鳞片状固体(层状结构)2. 光泽:有金属光泽3. 硬度:质地软,有滑腻感4. 导电性:良好5. 导热性:良好6. 用途:电极、铅笔芯、润滑剂等三、C601. 每个C60分子是由60个碳原子构成的。
2. C60分子形似足球,这种足球结构的C60分子(又叫足球烯)很稳定。
3. C60的独特结构决定了它具有一些特殊的物理和化学性质,有可能广泛应用于超导、催化、材料、医学及生物等领域。
总结归纳加工后璀璨夺目有金属光泽四、其他碳单质1. 木炭、焦炭、活性炭、炭黑等均是无定形碳,主要是由石墨的微小晶体和少量杂质构成的。
2. 活性炭、木炭具有疏松多孔的结构,可以吸附异味、色素等,具有吸附作用。
3. 焦炭常用于冶炼金属,炭黑用于制造黑色染料、油墨等。
4. 一些新形态的碳单质相继被发现,如碳纳米管、石墨烯等。
注意(1)只含一种元素的物质不一定是单质,也可能是几种单质组成的混合物。
(2)“碳”是元素名称,在书写含碳元素的物质的名称时使用,如二氧化碳;而“炭”表示物质,如“活性炭”。
对点训练题型一:同种元素组成的单质【例1】由同种元素组成的不同单质,可以互为“同素异形体”。
下列属于同素异形体的一组物质是A.氢气与液氢B.水银与银C.干冰与冰D.氧气与臭氧【答案】D【分析】由同种元素组成的不同单质,可以互为“同素异形体”,这里包含两个条件:一是不同的单质;二是由同一种元素组成,即组成元素相同。

九年级化学金刚石石墨和C60知识点九年级化学知识点:金刚石、石墨和C60金刚石、石墨和C60,这是在九年级化学课程中经常提到的三个重要的碳元素形式。
它们都是由碳元素构成的,但是它们在结构和性质上却完全不同。
本文将会分别介绍金刚石、石墨和C60的特点和应用,让我们更深入地了解这些化学物质。
1. 金刚石金刚石是自然界中最硬的材料之一,它的硬度在克诺斯硬度等级中为10,是所有材料中最高等级。
金刚石是由碳元素通过共价键连接而成的,每个碳原子与四个相邻碳原子形成四面体结构,并排列成紧密的晶格结构。
由于结构的稳定性和精确性,使得金刚石具有极高的硬度和抗磨损性,因此被广泛应用于切割工具、钻石饰品等领域。
虽然金刚石的硬度很高,但它的热稳定性却很低。
在高温下,金刚石会逐渐转变为石墨相。
这主要是因为金刚石的晶格结构过于紧密,不利于热运动,从而导致结构的不稳定性。
2. 石墨与金刚石相比,石墨的硬度要低得多。
石墨是由均匀相互平行排列的碳层构成,在每一层中碳原子通过共价键连接,而层与层之间的键是相互弱的范德华力。
由于碳层之间的键弱,因此石墨具有很好的层间滑移性,使得石墨具有良好的润滑性和导电性。
石墨还有一个特殊的性质,即热稳定性。
由于石墨中的碳层与层之间的键弱,因此石墨可以抵抗高温下的结构转变,保持稳定。
这也是为什么石墨可以用来制造铅笔芯的原因,因为在摩擦过程中碳层之间会发生剥离和滑移,从而形成细小的黑色颗粒。
除了润滑和导电性方面的应用外,石墨还被广泛应用于电池、气体处理和高温材料等领域。
例如,石墨电极在电池中起着储存和释放电荷的重要作用,而石墨在高温条件下具有良好的耐蚀性和热传导性能,因此可以用来制造高温容器和导热材料。
3. C60富勒烯C60富勒烯是由60个碳原子组成的球状分子,由于它的结构形状类似于足球,因此被称为“碳纳米足球”。
C60富勒烯具有许多独特的物理和化学性质,因此在材料科学和医学领域具有广泛的应用前景。
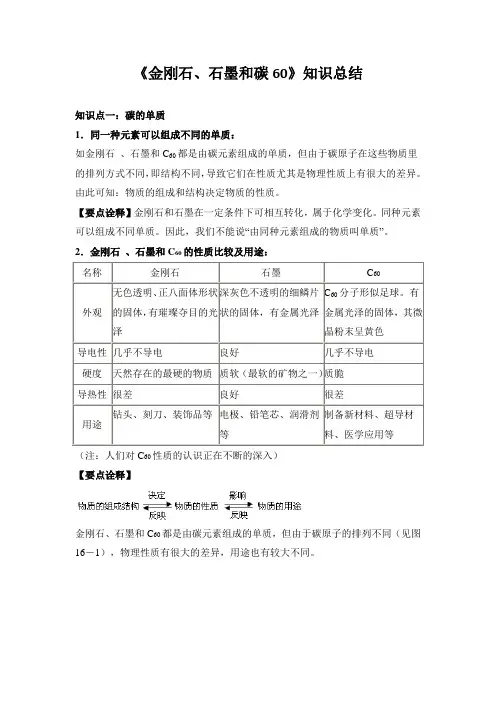
《金刚石、石墨和碳60》知识总结知识点一:碳的单质1.同一种元素可以组成不同的单质:如金刚石、石墨和C60都是由碳元素组成的单质,但由于碳原子在这些物质里的排列方式不同,即结构不同,导致它们在性质尤其是物理性质上有很大的差异。
由此可知:物质的组成和结构决定物质的性质。
【要点诠释】金刚石和石墨在一定条件下可相互转化,属于化学变化。
同种元素可以组成不同单质。
因此,我们不能说“由同种元素组成的物质叫单质”。
2.金刚石、石墨和C60的性质比较及用途:名称金刚石石墨C60外观无色透明、正八面体形状的固体,有璀璨夺目的光泽深灰色不透明的细鳞片状的固体,有金属光泽C60分子形似足球。
有金属光泽的固体,其微晶粉末呈黄色导电性几乎不导电良好几乎不导电硬度天然存在的最硬的物质质软(最软的矿物之一)质脆导热性很差良好很差用途钻头、刻刀、装饰品等电极、铅笔芯、润滑剂等制备新材料、超导材料、医学应用等(注:人们对C60性质的认识正在不断的深入)【要点诠释】金刚石、石墨和C60都是由碳元素组成的单质,但由于碳原子的排列不同(见图16-1),物理性质有很大的差异,用途也有较大不同。
3.木炭、活性炭的吸附性:木炭、活性炭、焦炭、炭黑等物质都是由石墨的微小晶粒和少量杂质构成的,由于木炭和活性炭均具有疏松多孔的结构,因此它们具有较强的吸附能力,可以吸附毒气、色素以及有异味的物质等。
据此,木炭和活性炭在制糖工业、食品工业、防毒面具制作等方面有重要的应用。
【要点诠释】1.吸附是物理现象,与吸收具有不同的含义。
由于木炭疏松多孔,有很大的表面积,因此它具有吸附性,活性炭的吸附性比木炭更强。
吸附作用是将气体或溶液里的微小粒子吸附在固体表面,没有生成新物质,属于物理变化。
吸收一般为化学变化,如:CO2气体被氢氧化钠溶液吸收的过程中生成了碳酸钠或碳酸氢钠等物质,就是化学变化。
2.“碳”和“炭”的区别:“碳”是元素的名称,是核电荷数为6的一类原子的总称。

金刚石石墨和c60碳原子排列方式金刚石、石墨和C60碳原子是具有不同排列方式和结构的碳材料。
下面将分别对这三种碳材料进行介绍。
一、金刚石金刚石是一种由碳原子构成的同质多晶体,也是最硬的自然物质之一。
金刚石的碳原子是通过共价键相连而形成的。
具体而言,每个碳原子与四个周围的碳原子形成四个共价键,形成了一个具有六个面的立方体结构。
这种排列方式使金刚石具有非常高的硬度和稳定性,可以在极高温和压力下存在。
金刚石的晶格结构为面心立方(FCC),意味着每个碳原子周围都有四个相邻的碳原子。
金刚石晶格的稳定性来自于碳原子之间强大的共价键,这种共价键非常紧密,使得金刚石具有极高的硬度和优异的导热性。
二、石墨石墨是一种由碳原子构成的异质大分子结构,是一种非金属的固体材料。
石墨的碳原子按照层状结构排列,形成了六边形网格。
具体而言,每个碳原子仅与三个周围的碳原子形成共价键,呈现出六个边的结构。
石墨的晶格结构为平面六角形(hexagonal),碳原子之间的结合方式是弱的范德华力。
这种弱的结合方式使得石墨在平面方向上具有很高的层间滑动性,因此石墨具有良好的润滑性和导电性。
三、C60碳原子C60碳原子是一种被称为富勒烯的碳化合物,具有球状的分子结构。
C60分子由60个碳原子组成,形成了一个由20个六边形和12个五边形构成的球体,类似于足球的结构。
每个碳原子与三个相邻的碳原子形成共价键,球体中的每个碳原子都与其他五个碳原子相邻。
C60碳原子具有特殊的电子结构和化学性质,是一种非常稳定的分子。
它不仅具有良好的光学和电学性能,还具有很高的抗氧化性和生物相容性,因此在许多领域具有广泛的应用潜力。
总结:金刚石是一种具有立方晶格结构的碳材料,具有极高的硬度和稳定性;石墨是一种具有平面六角形晶格结构的碳材料,具有良好的润滑性和导电性;C60碳原子是一种具有球状结构的碳化合物,具有特殊的电子结构和化学性质。
三者在结构和性质上有着明显的差异,但都展现出了碳原子的独特魅力和广泛应用的潜力。
金刚石、石墨和C60本课题包括两部分。
第一部分介绍碳单质,主要介绍了金刚石、石墨的重要物理性质和C60分子的结构特点。
在介绍石墨的同时又穿插介绍了木炭、活性炭的吸附性及其用途,使学生树立性质决定用途,用途体现结构的观点。
第二部分通过学生回顾复习引出碳的一个重要化学性质——在加热条件下与氧气反应,又通过活动探究理解了碳能与某些氧化物反应,并能根据实验现象书写化学方程式,分析化学反应的特点后又总结出了还原反应的概念。
教学目标1.知识与技能(1)了解金刚石和石墨的物理性质和用途。
(2)知道碳单质的化学性质。
(3)知道不同元素可以组成不同的物质,同一种元素也可以组成不同的物质。
2.过程与方法(1)会对展示或演示的资料分析、归纳。
(2)能认真观察实验现象,并会对现象分析归纳,总结出重要的知识点。
3.情感态度与价值观(1)以发展的观点看待碳的单质。
(2)树立物质的性质决定用途的观点。
教学重点:碳单质的化学性质。
教学难点:碳跟某些氧化物的反应。
教学过程[板书]课题1 金刚石、石墨和C60[引言]我们知道不同元素可以组成不同物质,那么,同种元素可以组成不同物质吗?[介绍]金刚石、石墨、C60都是由碳元素组成的单质。
[教师]你能得到什么结论?[学生总结]同种元素可以组成不同的物质。
[引导]观察金刚石样品,试描述有关物理性质。
[学生观察、讨论、总结]无色透明、正八面体形状。
[展示]玻璃刀[介绍]刀头上镶有金刚石,用它来裁玻璃。
[设问]你想到了什么?[学生发言]金刚石很硬,所以可用来裁玻璃。
[板书]一、碳的单质1.金属石很硬,可用来切割玻璃。
[介绍]金刚石经仔细琢磨后,可以成为璀璨夺目的装饰品——钻石,它的价格比金刚石还高,现在带钻戒的人越来越多,说明人们的生活水平越来越高。
[引导]观察石墨样品,试描述有关物理性质。
[学生观察描述]深灰色、有金属光泽、不透明、细鳞片状固体。
[引导]用手触摸一下石墨,有何感觉?[学生]石墨很软、有滑腻感。
金刚石、石墨、60C 讲义
一、碳的几种单质:金刚石、石墨、60C
1、金刚石⎪⎩
⎪⎨⎧不导电不导热天然最硬正八面体无色透明导电导热性:硬度:状态:, 构成:由原子直接构成,不存在分子。
2、石墨⎪⎩
⎪⎨⎧导电性导热性良好质地柔软深灰色令片状固体导电导热性:硬度:状态: 构成:由原子直接构成,不存在分子。
3、碳60C :由分子构成,一个60C 分子由60个碳原子构成。
注意:金刚石、石墨、60C 都是碳元素组成的单质,但性质差异很大,原因是构成它们的原
子的排列方式不一样。
同素异形体:像金刚石、石墨、60C 这样由同种元素组成的不同种单质互为同素异形体。
二、物质性质和用途的关系:物质的性质决定物质的用途,物质的用途体现物质的性质。
三、单质碳的化学性质:
1、在常温下,碳的化学性质不活泼(碳原子的最外层电子数为4个,既不大于4个也不
小于4个)
2、与氧气的反应(1)氧气充足时:22CO O C −−→
−+点燃
(2)氧气不足时: CO O C 222−−
→−+点燃 3、碳与氧化铜的反应: ↑+−−
→−+222CO Cu CuO C 高温](氧化还原反应) 4、碳与氧化铁的反应: ↑+−−→−+2323423CO Fe O Fe C 高温(氧化还原反应) 5、碳与二氧化碳的反应: CO CO C 22−−
→−+高温
(氧化还原反应) 6、碳与氢气的反应: 22H CO O H C +−−
→−+高温(氧化还原反应) 四、氧化还原反应:氧化反应:物质与氧发生的反应,还原反应:含氧化合物中的氧被夺
去的反应,提供氧的物质叫氧化剂,具有氧化性,得到氧的物质叫做还原剂,具有还原性。
《金刚石、石墨和 C60》讲义一、引言碳是一种非常神奇的元素,它可以形成多种不同的单质,其中最著名的当属金刚石、石墨和 C60。
这三种物质虽然都是由碳元素组成,但它们的性质和用途却大不相同。
接下来,让我们一起深入了解一下它们。
二、金刚石1、结构特点金刚石的结构可以说是非常独特且稳定。
它是由碳原子以正四面体的形式排列而成,每个碳原子都与另外四个碳原子以共价键相连,形成了一个巨大的网状结构。
这种结构使得金刚石具有极高的硬度,是自然界中最硬的物质之一。
2、物理性质金刚石的外观通常呈现出无色透明的晶体,但也有少量呈现出黄色、棕色等颜色。
它具有极高的折射率,使得其在光线的照射下能够闪烁出耀眼的光芒,这也是金刚石成为珍贵宝石的重要原因之一。
此外,金刚石的导热性能极佳,是良好的热导体。
3、用途由于金刚石的硬度极高,所以它被广泛应用于工业领域。
例如,在地质勘探中,金刚石钻头可以轻松地钻穿坚硬的岩石;在机械加工中,金刚石刀具能够加工出高精度的零件。
同时,金刚石的美丽外观也使其成为了珠宝界的宠儿,被用于制作各种高档首饰。
三、石墨1、结构特点与金刚石不同,石墨中的碳原子是以层状结构排列的。
每一层中的碳原子呈六边形排列,层与层之间的结合力较弱,容易发生相对滑动。
2、物理性质石墨是一种黑色的固体,具有良好的导电性和润滑性。
这是因为在石墨的结构中,每个碳原子只与三个相邻的碳原子以共价键相连,剩余的一个价电子可以自由移动,从而使得石墨能够导电。
而层与层之间的弱结合力使得石墨在受到外力作用时,层与层能够相对滑动,从而表现出良好的润滑性能。
3、用途石墨在工业上有着广泛的用途。
由于其良好的导电性,石墨常被用作电极材料;其润滑性能则使其在机械领域中被用作润滑剂。
此外,石墨还可以用于制作铅笔芯、耐火材料等。
四、C601、结构特点C60 是一种由 60 个碳原子组成的球状分子,形似足球,因此也被称为“足球烯”。
它的结构中,每个碳原子都与相邻的三个碳原子以共价键相连,形成了一系列的五元环和六元环。