高二化学甲烷和乙烯空间构型
- 格式:ppt
- 大小:166.50 KB
- 文档页数:4


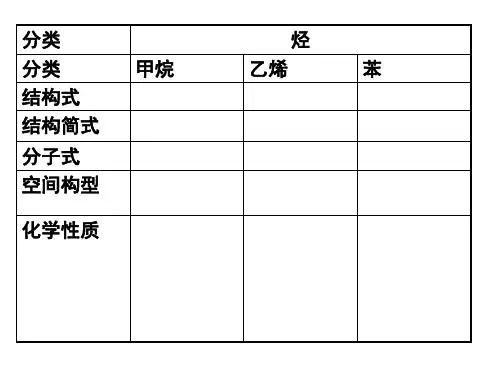

1.甲烷的定义及其化学性质是什么?实验室是怎样制取甲烷的?(1)甲烷分子是正四面体空间构型,分子式为CH4。
是最简单的有机化合物。
甲烷是没有颜色、没有气味的气体,沸点-161.4℃,比空气轻,它是极难溶于水的可燃性气体。
甲烷和空气成适当比例的混合物,遇火花会发生爆炸。
甲烷在自然界分布很广,是天然气、沼气、坑气及煤气的主要成分之一。
它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及甲醛等物质的原料。
化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO4)等一般不起反应。
在适当条件下会发生氧化、取代及加热分解等反应。
(2)甲烷的实验室制法[原理]无水醋酸钠和NaOH混合共热时发生脱羧反应,即-COOH被H原子取代生成甲烷。
甲烷难溶于水且密度比空气小,可用排水法收集,也可用瓶口向下的排空气集气法收集。
[用品]无水醋酸钠、碱石灰、试管、酒精灯、水槽、铁架台。
[操作]a.把无水醋酸钠放在瓷蒸发皿里用酒精灯加热,同时用玻璃棒不断搅拌,除去其中的水分后,研细,装入干燥的试剂瓶中密封待用。
b.把碱石灰研细,也在蒸发皿中加热除去水分,放入试剂瓶中密封待用。
c.把无水醋酸钠与碱石灰按3∶2的质量比混合均匀,迅速放入试管中,装上带导管的胶塞,固定在铁架台上。
d.用酒精灯加热并用排水法收集。
若用排空气集气法收集时,只能根据产气速率和集气瓶容积的大小,凭经验估计是否集满。
[备注]a.醋酸钠的脱羧反应须在无水条件下才能顺利进行,故在临使用前对无水醋酸钠和碱石灰均应经过煅烧、烘干处理。
b.制取甲烷时,碱石灰中的生石灰并不参加反应,生石灰除起吸湿作用外,还可减少固体NaOH在高温时对玻璃的腐蚀作用。
c.加热时应由试管口向后逐渐移动。
如先加热试管底部,产生的甲烷气可能会把前面的细粉末冲散,引起导管口堵塞。
d.加热温度不可过高,以免发生副反应,而使产生的甲烷中混入丙酮等气体。
e.在导管口点燃甲烷前,应先检验纯度。
2.从哪些方面学习烷烃?(1)常见烷烃烷烃即饱和烃,是只有碳碳单键和碳氢键的链烃,是最简单的一类有机化合物。

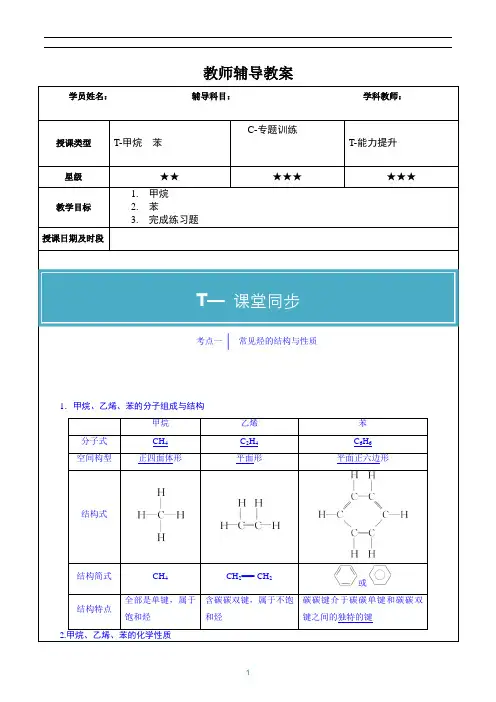
教师辅导教案学员姓名:辅导科目:学科教师:授课类型T-甲烷苯C-专题训练T-能力提升星级★★★★★★★★教学目标1.甲烷2.苯3.完成练习题授课日期及时段考点一| 常见烃的结构与性质1.甲烷、乙烯、苯的分子组成与结构甲烷乙烯苯分子式CH4C2H4C6H6空间构型正四面体形平面形平面正六边形结构式结构简式CH4CH2=== CH2或结构特点全部是单键,属于饱和烃含碳碳双键,属于不饱和烃碳碳键介于碳碳单键和碳碳双键之间的独特的键2.甲烷、乙烯、苯的化学性质T—课堂同步(1)甲烷①稳定性:与强酸、强碱和强氧化剂等一般不发生化学反应。
②燃烧反应的化学方程式:CH 4+2O 2――→点燃CO 2+2H 2O 。
③取代反应:在光照条件下与Cl 2反应生成一氯甲烷的化学方程式:CH 4+Cl 2――→光照CH 3Cl +HCl ,进一步取代又生成了二氯甲烷、三氯甲烷和四氯化碳。
(2)乙烯①燃烧反应的化学方程式: C 2H 4+3O 2――→点燃2CO 2+2H 2O ; 现象:火焰明亮且伴有黑烟。
②氧化反应:通入酸性KMnO 4溶液中,现象为溶液紫红色褪去。
③加成反应:通入溴的四氯化碳溶液中,反应的化学方程式: CH 2=== CH 2+Br 2―→CH 2BrCH 2Br , 现象:溶液颜色褪去。
与H 2反应的化学方程式: CH 2=== CH 2+H 2――→催化剂△CH 3CH 3。
与HCl 反应的化学方程式: CH 2=== CH 2+HCl ―→CH 3CH 2Cl 。
与H 2O 反应的化学方程式:CH 2=== CH 2+H 2O ――→一定条件CH 3CH 2OH 。
④加聚反应的化学方程式: n CH 2=== CH 2――→引发剂CH 2—CH 2。
(3)苯①稳定性:不能与酸性KMnO 4溶液反应,也不与溴水(或溴的四氯化碳溶液)反应。
②取代反应:a .卤代反应:苯与液溴发生溴代反应的化学方程式为+Br 2――→FeBr 3—Br +HBr 。

有机化合物高考第一轮复习主题1 几种常见的烃1.三种烃的结构、物理性质比较考点一 甲烷、乙烯、苯的结构与性质甲烷乙烯苯分子式CH4C2H4C6H6结构式结构简式CH4CH2 CH2结构特点只含单键的饱和烃含碳碳双键的不饱和烃碳碳键是介于单键和双键之间的特殊共价键空间构型正四面体平面结构平面正六边形物质性质无色气体,难溶于水无色、有特殊气味的液体2.三种烃的化学性质(1)甲烷(CH4)CH4+2O2 CO2+2H2OCH4+Cl2 CH3Cl+HCl(2)乙烯(CH 2 CH2)(3)苯(C6H6)3.烷烃(1)烷烃的结构与性质通式C n H2n+2(n≥1)结构链状(可带支链)分子中碳原子呈锯齿状排列;碳原子间以单键相连,其余价键均被氢原子饱和特点一个碳原子与相邻四个原子构成四面体结构;1 mol C n H2n+2含共价键的数目是(3n+1)N A物理性质密度:随着分子中碳原子数的增加而增大,但都小于水的密度;熔、沸点:随分子中碳原子数的增加而升高;状态:气态→液态→固态,一般来说,碳原子数小于5的烷烃,常温下呈气态化学性质取代反应;氧化反应(燃烧);分解反应(高温裂解)(2)烷烃的习惯命名法①当碳原子数n≤10时,用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示;当n>10时,用汉字数字表示。
②当碳原子数n相同时,用正、异、新来区别。
如CH3CH2CH2CH2CH3称为正戊烷,(CH3)2CHCH2CH3称为异戊烷,C(CH3)4称为新戊烷。
1.正误判断(正确的打“√”,错误的打“×”)。
(1)甲烷的化学性质很稳定,不能与氧气、酸性KMnO4溶液、强酸、强碱等反应。
( )(2)1 mol甲烷和1 mol氯气发生取代反应生成的有机产物只有CH3Cl。
( )(3)甲烷和氯气生成一氯甲烷的反应类型与苯和硝酸生成硝基苯的反应类型相同。
( )(4)用酸性KMnO4溶液既可以鉴别CH4和 ,又可以除去CH4中的。



乙烯分子构型乙烯是一种非常重要的有机化合物,也是最简单的烯烃之一。
它由两个碳原子和四个氢原子组成,化学式为C2H4。
乙烯分子的构型非常特殊,具有一定的空间结构,这使得它在许多化学反应中表现出独特的性质和活性。
乙烯分子的构型可以用空间模型来描述。
在空间模型中,乙烯分子呈平面构型,两个碳原子位于同一平面上,而氢原子则位于碳原子的周围。
乙烯分子的平面构型使得它具有了一些特殊的性质。
乙烯分子的平面构型使得它具有了π键的存在。
π键是由两个p轨道上的电子相互叠加形成的,它比σ键更容易被攻击和断裂。
这使得乙烯分子在许多有机反应中具有较高的反应活性,可以发生加成、取代、聚合等多种反应。
乙烯分子的平面构型还使得它具有了共轭体系的特性。
共轭体系是指多个连续的π键在一个平面上相互作用形成的一种特殊结构。
乙烯分子由于具有两个相邻的π键,因此可以形成一个共轭体系。
共轭体系具有一系列特殊的性质,如共轭体系中的π电子可以自由移动,使得乙烯分子具有良好的导电性和光学性质。
乙烯分子的平面构型还使得它具有了空间取向性。
由于乙烯分子的平面构型,碳原子上的两个π电子云形成了一个平面,而氢原子则位于这个平面的两侧。
这种空间取向性使得乙烯分子在一些化学反应中具有特殊的立体选择性,可以选择性地发生一些特定的反应。
乙烯分子的构型不仅在化学反应中起到了重要的作用,也对乙烯分子的性质和用途产生了很大影响。
例如,由于乙烯分子的构型,它具有较高的反应活性和导电性,因此被广泛应用于化学合成、材料科学、能源领域等。
乙烯分子还可以通过聚合反应形成聚乙烯,聚乙烯是一种重要的塑料材料,广泛应用于包装、建筑、电子等领域。
乙烯分子的构型是其独特性质和活性的基础。
乙烯分子的平面构型使得它具有了较高的反应活性、良好的导电性和光学性质,可以发生多种化学反应和应用于多个领域。
乙烯分子的构型对于理解和应用乙烯具有重要意义,对于有机化学和材料科学的发展也具有重要影响。

烃类知识点背诵记忆内容一、烷烃1.甲烷的电子式与结构式:【答案】;2.甲烷燃烧的化学方程式及现象:【答案】CH4 + 2O2点燃→CO2+2H2O;火焰明亮呈蓝色3.烷烃的物理性质通性:【答案】烷烃均为分子晶体,其物理性质随着分子中碳原子数的递增呈规律性变化:熔沸点:随着碳原子数的增多,相对分子质量递增,熔沸点逐渐升高。
(支链越多,熔沸点越低)密度:相对密度均小于1溶解性:难溶于水,易溶于苯、乙醚等有机溶剂状态:常温下的存在状态由气态逐渐过渡到液态、固态C≤4为气态(新戊烷也为气态);5-16为液态;≥17为固态4.链状烷烃的通式与结构:【答案】C n H2n+2;锯齿形而非直线形5.烷烃的化学性质(有通式写出通式)【答案】(1)氧化反应:烷烃能够燃烧生成CO2和H2O,但不能与强酸、强碱、强氧化剂【KMnO4(aq)】反应。
(2)取代反应(3)分解反应:烷烃在高温条件下能够发生裂化或裂解。
6.烷烃取代反应的特点:【答案】①在光照条件下②与纯卤素反应②1mol卤素单质只能取代1molH②连锁反应,有多种产物(卤代烃和卤化氢气体)7.习惯命名法中十个碳原子以下的名称为:【答案】甲、乙、丙、丁、戊、己、庚、辛、壬、癸8.丙烷失去一个氢原子后的烃基有几种,写出结构简式?【答案】2种,正丙基(—CH2CH2CH3)和异丙基[—CH(CH3)2]9.丁烷丁烷失去一个氢原子后的烃基有几种,写出结构简式?【答案】4种,正丁基(—CH2CH2CH2CH3)、仲丁基[—CH(CH3)CH2CH3]、异丁基[—CH2CH(CH3)2]、叔丁基[—C(CH3)3]10.系统命名法的步骤及原则:【答案】(1)选主链:碳链最长、支链最多;(2)编序号:“近”、“简”、“小”—①近:从离支链最近的一端开始编号;②“简”:支链同近时,从较简单的一端编号;②“小”:同近同简时,考虑支链编号之和最小(3)写名称:先简后繁,相同合并,位号指明二、烯烃1.乙烯的电子式、结构式与结构简式:【答案】;;CH2=CH22.乙烯的物理性质:【答案】无色、稍有气味的气体、密度略小于空气,难溶于水,易溶于CCl4等有机溶剂。
甲烷的立体结构甲烷,化学式CH4,是一种无色、无臭的气体,也是天然气的主要成分之一。
甲烷分子由一个碳原子和四个氢原子组成,其立体结构对于理解甲烷的性质和反应至关重要。
甲烷的立体结构可以用VSEPR理论(分子的价电子对排斥理论)来解释。
根据这个理论,甲烷的碳原子周围有四个价电子对,它们排列成一个正四面体的形状。
碳原子位于正四面体的中心,四个氢原子均位于四个顶点上。
这种立体结构使得甲烷分子呈现出非极性的特性。
由于四个氢原子均相同,且位于甲烷分子的四个角上,甲烷分子的电负性分布均匀,没有电荷偏移,因此甲烷是一个非极性分子。
甲烷的非极性使其具有一些特殊的性质。
首先,它是一种很稳定的化合物,不容易与其他物质发生反应。
这是因为甲烷分子中的碳-氢键非常强大,需要大量能量才能打破这些键。
此外,由于甲烷是非极性的,它在溶解性和挥发性方面与极性分子有所不同。
甲烷在自然界中广泛存在,特别是在沉积岩层中。
它是一种主要的温室气体,对地球的气候变化有重要影响。
然而,甲烷也是一种重要的能源资源,被广泛用于燃料和化工工业。
甲烷的立体结构对于理解其反应机理也至关重要。
由于甲烷的碳-氢键强度很高,它在常温下不容易发生反应。
但在高温和高压条件下,甲烷可以与氧气反应生成二氧化碳和水,释放出大量的能量。
这是燃烧过程中常见的反应,也是甲烷作为能源的重要特性之一。
甲烷还可以通过一系列的化学反应转化为其他化合物。
例如,它可以与氯气反应生成氯代甲烷,也可以与溴反应生成溴代甲烷。
这些反应都涉及到碳-氢键的断裂和新键的形成,进而改变甲烷分子的立体结构。
甲烷的立体结构对于理解其性质和反应机理至关重要。
通过VSEPR 理论,我们可以知道甲烷分子呈现出正四面体的形状,使其成为一个非极性分子。
这种立体结构决定了甲烷的稳定性、溶解性、挥发性以及与其他物质的反应性。
深入理解甲烷的立体结构,有助于我们更好地应用和探索这一重要的化合物。
专题4 分子空间结构与物质性质第一单元分子构型与物质的性质4.1.1 杂化轨道理论与分子的空间构型(1)【学习目标】1.了解杂化轨道理论的基本内容。
2.了解3种杂化轨道类型与分子空间构型的关系。
2.了解碳原子的杂化轨道。
【核心知识点】1.杂化轨道理论。
2.常见分子的杂化轨道类型。
【基础知识梳理】一、杂化轨道理论1.杂化轨道理论的来由为了解释_______等分子的空间构型,美国化学家________于1931年提出的。
2.杂化与杂化轨道在形成多原子分子的过程中,中心原子的若干________的原子轨道重新组合,形成一组_______相等、______相同的新轨道,这种轨道重新组合的过程叫做杂化,所形成的新轨道就称为杂化轨道。
3.杂化轨道理论的要点(1)在形成分子时,某些不同类型、能量________的原子轨道重新组合成一组新的轨道。
(2)杂化轨道是不同于原来的轨道的一组新的轨道,新的轨道_______相等、______相同,且有一定的______取向。
(3)杂化轨道与其他原子轨道的形成_______键。
二、用杂化轨道理论3种典型分子的空间构型1.CH4分子的空间构型(1)杂化轨道的形成碳原子2s轨道上的1个电子进入2p空轨道,____个2s轨道和_____个2p轨道“混合”,形成____________、____________的4个sp3杂化轨道。
基态原子轨道激发态原子轨道杂化轨道sp3杂化轨道的空间构型4个sp3杂化轨道在空间呈___________,轨道之间的夹角为_________。
(2)共价键的形成与CH4分子的空间构型碳原子的4个_______轨道分别与4个氢原子的_____轨道重叠,形成4个相同的_____键。
CH4分子为空间构型为_________,分子中C—H键之间的夹角为__________。
2.BF3分子的空间构型(1)杂化轨道的形成B原子的2s轨道上的1个电子进入2p空轨道,____个2s轨道和_____个2p轨道“混合”,形成____________、____________的3个sp2杂化轨道。
第2节共价键与分子的空间构型(第一课时)【教学目标】1、通过分析甲烷、乙烯、乙炔、苯、氨分子的空间结构,了解杂化轨道理论和价电子对互斥理论,建立分子空间结构模型的推导方法,发展证据推理与模型认知化学学科核心素养;2、通过阅读教材,了解分子的对称性、分子的极性及分子极性与分子空间结构、分子性质的联系,了解手性分子在生命科学等方面的应用,形成理论联系实际的观念。
【教学重难点】重点:杂化轨道理论、价电子对互斥理论难点:分子的空间结构【教学用具】学案、PPT【教学过程】【新课引入】早期用于减轻妇女妊娠反应的药物沙利度胺,曾导致许多胎儿畸形。
科学家们对沙利度胺进行了深入的研究,发现沙利度胺有两种对映异构体,其中右旋异构体没有副作用,而左旋异构体则与致畸有关。
那么什么样的分子存在对映异构体呢?【课中讲解】一.分子空间结构的理论分析1.杂化轨道理论(1)杂化轨道的定义在外界条件影响下,原子内部能量相近的原子轨道重新组合形成新的原子轨道的过程叫作原子轨道的杂化,组合后形成的一组新的原子轨道叫作杂化原子轨道,简称杂化轨道。
特点:同一组杂化轨道的能量、形状、成分完全。
(2)杂化轨道理论的要点相同,杂化轨道的空间取向一定能量相近原子在成键时,同一原子内能量相近的原子轨道重新组合形成新的、能量相同的原子轨道数目不变参与杂化的原子轨道数等于形成的杂化轨道数成键能力增强杂化改变了原有原子轨道的能量、形状和空间取向,使原子的成键能力增强排斥力最小杂化轨道的能量相同,为使相互间的排斥力最小,故在空间取最大夹角分布,不同的杂化轨道空间取向不同,夹角也不同2. 用杂化轨道理论解释分子的空间结构(1)sp³杂化与甲烷(CH₄)分子的空间结构sp³杂化轨道1个ns轨道与3 个np轨道的杂化称为sp³ 杂化,所形成的四个杂化轨道称为sp³杂化轨道。
四个sp³杂化轨道在空间中均匀分布,轨道间夹角为109°2 8',其空间结构为正四面体形CH₄中碳原子的杂化过程示意图与成键过程CH ₄中的碳原子的四个杂化轨道分别与四个氢原子的1s 轨道重叠形成四个共价键。