BM—cycline 去除支原体
- 格式:docx
- 大小:24.47 KB
- 文档页数:3

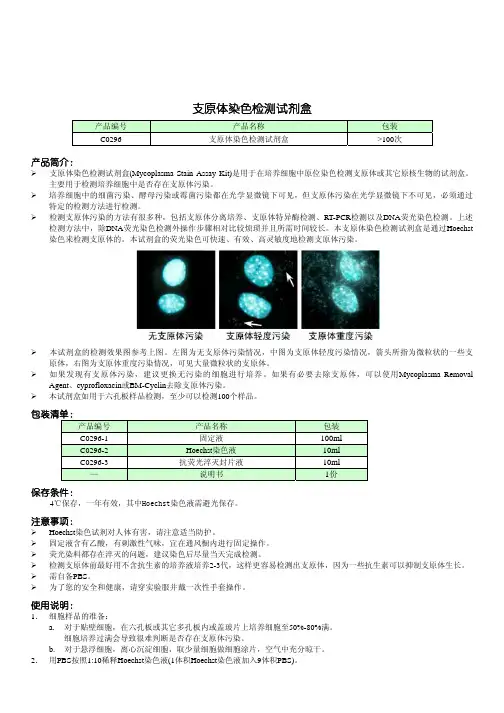
支原体清除实验支原体污染是细胞培养过程中的常见现象。
细胞被支原体污染之后,在显微镜下无法直接观察到,生长状态可能发生或不发生改变,因此一般不易被察觉。
但是支原体会改变细胞的很多生长参数,因而极易对后续实验造成影响,所以对支原体污染的检测和清除非常重要。
以下为一次支原体检测和清除的实例。
材料:细胞系:SH-SY5Y支原体PCR检测试剂盒:Myco-P-20 (上海炎熙生物 )支原体清除剂:Myco-E-1 (上海炎熙生物 )方法与结果:1,将已检测出有支原体污染的SH-SY5Y细胞以正常传代密度铺到6孔板中,一个孔加清除剂,作为测试孔,另一孔不加清除剂,作为阴性对照孔。
两孔之间间隔一个孔,以免互相污染。
2,在清除支原体的过程中细胞以常规方法传代培养,并使细胞在培养过程中一直处于清除剂的作用下。
在加清除剂后第4、8、9、11天各取1毫升培养上清。
每份上清与细胞已共培养48小时,除第9天的上清只共培养了24小时。
3,将这些培养上清在16000g离心5分钟,小心去除离心上清,将沉淀用无菌PBS洗三次,每次以16000g离心5分钟。
最后获得的沉淀用100微升纯水重悬,在100℃水浴中孵育5分钟,然后用于PCR反应。
4,按照支原体检测试剂盒Myco-P-20的说明书进行PCR检测操作,结果如下:4.1,与对照样品共同反应,用这种方式可以判断是否出现了假阴性结果。
在加清除剂后第4天的样品中仍可见到支原体阳性条带(约440bp),在第8、9、11天的样品中,已看不到支原体阳性条带。
4.2,不加对照样品,检测样品单独反应,用这种方式可以提高测试灵敏度。
可见在第8天和第9天的样品中,支原体阳性条带仍然出现,但是弱于第4天的样品。
在第11天的样品中,有明显的200bp以下的非特异的条带,且亮度高于阳性条带,所以判断此时的PCR产物是非特异反应的产物,样品中已没有支原体DNA。
注释:由于PCR是一种非常灵敏的检测方法,所以很容易出现假阳性条带。


解脲支原体MB蛋白金标检测试剂盒(胶体金法)
解脲支原体MB蛋白金标检测试剂盒(胶体金法)按2005版《医疗器械分类目录》,属临床医学检验辅助设备(6840)。
管理类别为Ⅱ类。
产品简介如下:
1结构组成
1.1产品结构
解脲支原体MB蛋白金标检测试剂盒由检测卡、检测条、样品稀释液、阳性对照液、阴性对照液等组成。
1.2检测卡
由检测条和聚苯乙烯塑料外壳制成。
1.3检测条
由已包被了检测线和对照线的硝酸纤维素膜、化学偶合物膜、样品吸收膜,胶纸等部分经层压而成,再分切成固定宽度的条状。
1.4样品稀释液
分为A液和B液、均为无色透明液体。
1.5阳性对照液
为含灭活支原体的无色透明液体。
1.6阴性对照液
为含一定浓度人尿蛋白的无色透明液体。
2主要原材料
解脲支原体单克隆抗体:为两株纯化的高亲和力的抗解脲支原体单克隆抗体,一株用于胶体金标记,另一株用于包被硝酸纤维素膜。
金标检测条:由S1—S7部分构成:
S1选用亲和性高分子纤维素膜,经预先处理后制备成反应膜用来显示整体系统的反应结果;
S2、S3选用可使液体爬行速度较快,吸附力较强的粗纤维吸水纸或无纺布,其作用在于被粘贴在反应体的不同部位吸收待检样品标本;
S4同样选取吸附力较强的无纺布,作为金标记抗体的固相吸附材料;
S5为不同规格的双面胶,用于固定各种反应膜和吸水材料于S7上;
S6塑料基板,作为测试条反应体的支撑物;。



支原体清除剂说明书货号:CA1090规格:200μL保存:-20℃,一年(避免反复冻融,建议分装保存。
)注意:1.请在收到货后,将试剂管瞬时离心。
2.产品出现沉淀属正常现象,在分装或使用前须在室温下震荡溶解至澄清透明状,不影响产品的使用效果。
产品说明:支原体是一种大小仅为0.2~0.3μm,无细胞壁,可透过一般过滤膜(0.22~0.45μm)的原核生物,在细胞培养过程中,支原体感染发生率达到63%,因而细胞培养过程中被支原体污染是一个世界性的难题。
多篇文献研究表明:当细胞(特别是传代细胞)被支原体污染后,细胞内的DNA、RNA及蛋白表达发生改变,而细胞的生长率一般并未发生显著的影响,因而细胞被支原体污染一般难以察觉。
支原体清除剂用于解决因支原体污染而导致细胞污染或状态下降的问题,同时其对于常见的革兰氏阴性和阳性菌也有一定的清除作用,从而确保研究人员的研究结果真实、可信。
使用说明:1.建议现配现用,并保持细胞密度在50~60%。
2.推荐稀释比例为1:1000。
例如10mL的培养基加入10μL支原体清除剂混匀。
3.弃去旧的培养基,用PBS将细胞清洗干净,再加入含有支原体清除剂的新鲜培养基,1天1次,连续处理3天;或者2天1次,连续处理5~6天。
若细胞污染非常严重时,需延长处理时间。
4.若细胞对支原体清除剂敏感,或生长明显被抑制时,可调整稀释比例,如:1:2000或1:30005.处理完毕后,加入新鲜培养基,培养基中可添加支原体预防剂预防支原体再次污染。
6.因支原体清除剂本身具有广谱抑菌性,为了降低对细胞的影响,强烈建议不要和其它抗生素同时使用。
产品优势:1.特异性清除培养基中的支原体;2.只需要处理3天左右,便可以有效清除支原体;3.活性成分为多肽类,不会产生耐药性;4.对细胞几乎无毒性,在100多种细胞上进行过验证,包括但不限于HEK293、Hela、MCF-7、MRC-5、NIH-3T3、CCC-ESF、CHO-S、CHO-K1、CHO-DG44、H295R、HL-60、K562、MDA-MB-231、SP2/0、T47D、BM和BV2等;5.广谱性,可替代双抗,可以清除常见的革兰氏阴性和阳性菌;6.可直接加入血清、培养基中,用于清除支原体污染;。

细胞培养过程中支原体污染的防治与检测方法邢龙彬;刘长政;焦晓磊;刘彤;杜智;高英堂【期刊名称】《世界华人消化杂志》【年(卷),期】2016(0)10【摘要】目的:为高效便捷地去除细胞培养过程中支原体污染,采用多种抗生素和检测方法对污染细胞进行处理和检测.方法:分别采用Plasmocin、BM-Cyclin、MRA3种药物对污染细胞进行处理,以CLARK的一步法试剂、Biotool的快速检测试剂和自行研制的聚合酶链式反应(polymerase chain reaction,PCR)等3种方法进行检测.结果:一步法试剂检测显示Plasmocin处理14d后支原体消除,快速检测试剂检测显示BM-Cyclin处理21d彻底消灭支原体,而MRA经PCR检测发现彻底消除支原体需要14d;另外,3种药物交替使用清除支原体的效果更加显著.结论:通过使用3种抗生素和3种支原体检测方法,使细胞培养过程中的支原体污染得到有效控制,为更好地开展细胞研究奠定基础.【总页数】8页(P1557-1564)【关键词】支原体;细胞培养;防治;检测【作者】邢龙彬;刘长政;焦晓磊;刘彤;杜智;高英堂【作者单位】天津医科大学第三中心临床学院,天津市300070;天津市人工细胞重点实验室天津市肝胆疾病研究所天津市第三中心医院,天津市300170【正文语种】中文【中图分类】R378.3【相关文献】1.细胞培养过程中支原体污染的检测及预防 [J], 桂馨;钱洁;许洁;邢丽波2.动物细胞培养中支原体污染的检测方法比较研究 [J], 刘谋渊;刘岚;赵娇;余红3.细胞培养过程中支原体污染的检测和去除研究 [J], 陈琳4.用巢式多聚酶链反应检测细胞培养中污染支原体方法的建立 [J], 王正森;吴建新;赵小元;孙宝岭;郭章溉;李敏5.一种高度敏感的检测细胞培养中污染支原体的方法 [J], 黄传书;金伯泉;汪美先;张建平;孙凯;陈常庆;顾文琴;喻缨因版权原因,仅展示原文概要,查看原文内容请购买。

细胞支原体污染的影响、检测方法及清除方法支原体简介支原体(mycoplasma):又称霉形体,为目前发现的最小的最简单的原核生物。
支原体细胞中唯一可见的细胞器是核糖体(支原体是原核细胞,原核细胞的细胞器只有核糖体)。
支原体是在1898年发现的,又称人形支原体,是一种简单的原核生物。
其大小介于细菌和病毒之间。
结构也比较简单,多数呈球形,没有细胞壁,只有三层结构的细胞膜,故具有较大的可变性。
支原体的大小为0.2~0.3um,可通过滤菌器,常给细胞培养工作带来污染的麻烦。
菌落小(直径0.1~1.0mm),在固体培养基表面呈特有的"油煎蛋"状。
无细胞壁,不能维持固定的形态而呈现多形性,对渗透压敏感,对抑制细胞壁合成的抗生素不敏感。
支原体污染的来源包括工作环境的污染、操作者本身的污染(一些支原体在人体是正常菌群)、培养基的污染、污染支原体的细胞造成的交叉污染、实验器材带来的污染和用来制备细胞的原始组织或器官的污染。
支原体污染对细胞的影响1、影响细胞的生长状态及形态支原体可使培液中支持细胞生长的营养物质含量减少,造成细胞生长缓慢甚至停止;细胞状态变差,生长变慢,在显微镜下观察可能会有小黑点,但培养基一般不发生浑浊。
会导致细胞微管解聚,引起细胞一系列病变,表现为细胞收缩、贴壁细胞脱落、裂解等。
细胞传代以后就出现细胞间黑点,细胞空泡化,很多类似凋亡、坏死的细胞,最终细胞漂浮,完全死亡。
2.影响细胞的代谢和功能(1)培液中的精氨酸被支原体大量消耗,引起细胞蛋白质、DNA、rRNA、mRNA的合成障碍;(2)支原体活动使培养基成分发生改变(如发酵型支原体降解糖类产生酸性物质),影响细胞代谢;(3)支原体吸附在细胞表面,破坏细胞膜的完整性,影响细胞信号传递;(4)支原体消耗细胞的核苷库—染色体异常。
3、其他此外,支原体污染还会影响一些病毒在细胞中的产量、使恶性细胞致癌能力下降、影响淋巴细胞分化等。

『支原体清除计划』,为细胞培养保驾护航支原体(mycoplasma)是一类没有细胞壁、高度多形性、能通过滤菌器、可用人工培养基部分培养增殖的,原核细胞型微生物。
支原体也是造成生物学实验室中,细胞污染的“主力选手”之一。
在普通光学显微镜下,几乎看不到支原体的身影,因此如果细胞被支原体污染,前期很难被发现,而支原体污染,又会对细胞实验产生严重的影响,包括但不限于以下几点:1、支原体感染细胞株会导致细胞失去正常生长和功能,影响实验结果的可靠性和准确性。
它可以导致细胞形态的改变、细胞增殖的异常以及细胞功能的异常。
2、支原体在细胞培养中传播非常迅速,很容易通过细胞培养物、细胞悬液、细胞培养用具等途径传播到其他细胞培养中,进一步污染更多的细胞株。
3、支原体感染可能导致实验结果的误解,因为实验结果中的观察结果可能不再是由所研究的细胞本身导致的,而是由支原体感染导致的变化。
因此,要通过有效、安全、高效的手段,预防/清除支原体污染。
关于与支原体的“大战”,我们总结了以下几个关键点,希望本期“支原体清除计划”可以为大家的细胞实验带来帮助。
Round 1:实验室环境的清洁细胞实验,需要在严格无菌的环境下进行。
因此,维持实验室的无菌环境十分重要。
实验环境包括实验空间、实验室内的仪器设备、实验人员。
可采用甲醛高锰酸钾熏蒸消毒的方法对实验室内部空间进行消毒,消毒期间需人员撤离,密闭消毒空间24h以上,该方法虽然能有效对实验空间进行清洁消毒,但甲醛有刺激气味,对人和细胞都有毒性作用。
细胞间1-2周无法使用,因此更推荐用紫外线灯进行照射灭菌。
在每次实验开始前,打开紫外线灯,设置好安全标识,照射实验室内部空间30分钟以上,也能达到不错的灭菌效果。
对于实验室内的仪器设备,可采用消毒液、75%酒精擦拭等方法进行消毒。
该方法中所使用的消毒试剂,多数也都有挥发性,对操作人员有毒性作用,且对部分微生物无效。
因此,推荐使用更为专业的微生物祛除试剂:Mycoplasma-off支原体祛除喷雾剂(即用型),含有支原体杀除剂Mynox®,可在几分钟内迅速杀除支原体。

支原体去除剂原理支原体去除剂是一种专门用于清除细胞、血清、培养基中支原体的试剂。
其原理主要基于抗菌肽(AMPs)和穿膜肽(CPPs)的协同作用。
以下是详细的原理介绍:1. 抗菌肽(AMPs): 支原体清除剂中的AMPs成分具有强大的杀灭支原体和常见细菌的能力。
它们通过破坏细菌细胞膜的完整性,导致细菌死亡。
对于位于细胞外的支原体,AMPs能够迅速发挥作用,将其杀灭。
2. 穿膜肽(CPPs): CPPs在支原体清除剂中发挥着将AMPs携带进入细胞内部的角色。
通过与AMPs的结合,CPPs能够帮助将AMPs导入细胞内,从而杀灭细胞内的支原体。
这一步对于清除细胞内部的支原体至关重要,因为支原体可能会在细胞内繁殖并形成生物膜,从而更难以清除。
3. 协同作用: 通过AMPs和CPPs的协同作用,支原体清除剂实现了对支原体的全方位清除。
在细胞外,AMPs直接杀灭支原体;在细胞内,CPPs将AMPs 带入细胞内,杀灭细胞内的支原体。
这种双重作用机制确保了支原体清除剂的高效性和广谱性。
4. 其他功能: 除了杀灭支原体外,支原体清除剂对常见的细菌也有一定的清除作用。
这意味着它不仅针对支原体,还能在一定程度上对抗其他常见的细菌。
5. 安全性和有效性: 支原体清除剂已被证实对大部分种类的支原体具有清除效果,且对细胞本身无毒性。
已经在多种细胞上进行了验证,包括小鼠胚胎干细胞、人胚胎干细胞等。
这证明了支原体清除剂的安全性和有效性。
使用时,务必按照说明书的指引正确使用支原体去除剂,避免与抗生素混合使用,以确保最佳效果。
同时,由于支原体去除剂是生物活性物质,应避免阳光直射,储存时应分装并现配现用。
总结来说,支原体去除剂通过抗菌肽和穿膜肽的协同作用,实现了对支原体的全方位清除,包括细胞外的支原体和细胞内的支原体。
这种高效、广谱的清除机制确保了其在细胞培养和研究中的广泛应用。
同时,其安全性和有效性已在多种细胞上得到验证,为科研工作者提供了可靠的支原体清除工具。
生物制品中支原体污染及清除方法的研究进展杜金玲,王丹娜,石磊,吕超超,王吉玮,孟姗姗,刘长辉,卢会英,赵亚荣(北京大北农动物医学研究中心,北京100097)[收稿日期]2011-09-23[文献标识码]A [文章编号]1002-1280(2012)02-0057-04[中图分类号]S852.6[摘要]支原体是生物制品污染中较常见的一种微生物,它可以污染细胞、病毒批、血清等制品,给科研及生物制品产业带来危害。
文章简要介绍了支原体污染生物制品后带来的危害,并对清除支原体方法的研究进展进行了综述。
[关键词]支原体污染;危害;清除作者简介:杜金玲,硕士,从事动物传染病疫苗研究。
E -mail :dujinling@163.comResearch Progress on Mycoplasma Contamination ofBioproducts and the Elimination MethodsDU Jin -ling ,WANG Dan -na ,SHI Lei ,LV Chao -chao ,WANG Ji -wei ,MENG Shan -shan ,LIU Chang -hui ,LU Hui -ying ,ZHAO Ya -rong(Veterinary Medicine Research Center of Beijing Da Bei Nong ,Beijing 100097,China )Abstract :Mycoplasmas always contaminate cell lines ,viruses ,serum and other materials for basic research and for manufacturing of bioproducts.It generally considered to be frequent commensals.The article briefly summarized the harm of Mycoplasma contamination in bioproducts ,and reviewed the elimination methods of Mycoplasma contamination.Key words :Mycoplasma contamination ;harm ;elimination 支原体(Mycoplasma )属于柔膜体纲,是介于细菌和病毒间的一类无细胞壁的原核细胞微生物,也是目前所知能在无生命培养基中生长繁殖的最小微生物,大小一般在0.3 0.5μm 之间,呈高度多形性。
bm cyclin说明书一般描述 BM-Cyclin为泰妙菌素和米诺环素两种抗生素的组合,二者均可阻止蛋白质合成。
特异性敏感生物:支原体和细菌·经证BM细胞周期蛋白可有效消除无窝毛孢菌, ·精原支原体, ·猪支原体, ·口头支原体来自受实验污染和慢性感染细胞系。
注意:这些支原体株占动物细胞培养支原体污染的5%。
应用 BM-Cyclin用于清除感染细胞培养物中的支原体,无明显的细胞毒副作用。
包装两类不同的抗生素集外形瓶1(延胡索酸泰妙菌素):复溶后为透明、无色溶液瓶2(二甲胺四环素盐酸盐):复溶后为透明、溶液制备说明工作浓度:10μg/ml平菇菌素衍生物 (BM-cyclin 1),5μg/ml四环素衍生物(BM-cyclin 2)。
注:这些浓度对大部分细胞的生长没有影响。
某些敏感细胞系所用的浓度可能更低。
对于杂交瘤,BM-Cyclin浓度降低低50%。
DAPI工作溶液制备用甲醇稀释储备溶液至终浓度1& 956 g/ml。
工作溶液:储备溶液制备将BM Cyclin 1和BM Cyclin 2溶于10ml灭菌PBS或水中。
注:这些为250x的浓缩储备溶液,可在-15 到 -25°C下储存至少6个月。
DAPI储备溶液制备将DAPI溶于水,使终浓度为1到5mg/ml。
注:不要使用任何缓冲液。
该储备溶液可-15到-25°C储存。
建议合理分装。
储存条件(工作溶液):-15至-25°C复溶后可在-15 to -25°C下稳定保存至少6个月。
其他说明仅用于生命科学研究。
不可用于诊断。
支原体酶检验支原体原理
支原体酶检验是一种用于检测支原体感染的实验室检测方法。
支原体是一种细菌,可以引起多种疾病,包括肺炎、生殖道感染和眼部疾病等。
支原体酶检验的原理是通过检测患者体液中的支原体特异性抗体水平来确定是否存在支原体感染。
在进行支原体酶检验时,通常会采集患者的血液样本。
这些样本中的抗体会与支原体的特定抗原结合,形成抗原-抗体复合物。
然后,实验室会使用特定的酶标记技术来检测这些复合物的存在,通常是通过酶联免疫吸附试验(ELISA)或荧光抗体技术(IFA)。
在ELISA中,如果支原体抗体存在于患者的血液中,它们将与固相上的支原体抗原结合。
随后,酶标记的抗人球蛋白抗体会与形成的复合物结合,形成底物-酶-抗体三者结合复合物。
当底物加入后,酶会催化底物的分解,产生可测量的颜色变化。
颜色的强度与抗体的浓度成正比,从而可以确定是否存在支原体感染。
在IFA中,支原体抗体会与支原体抗原结合,形成复合物。
然后,实验室会使用荧光染料标记的抗人球蛋白抗体来检测这些复合物。
通过荧光显微镜观察样本中的荧光强度,可以确定是否存在支
原体抗体。
总的来说,支原体酶检验的原理是通过检测支原体特异性抗体来确定是否存在支原体感染。
这种检验方法灵敏度高,特异性好,能够帮助医生进行支原体感染的诊断和治疗。
一种快速的支原体细胞污染检测方法作为一个基础医学科研狗,最头疼的莫过于细胞污染,真菌、细菌污染还好说操作得当就可以避免,而且显微镜下容易观察到,最恶心的要数支原体污染,污染之后细胞还能生长,观察不出什么异样,但是实验数据往往无法重复,严重影响实验结果。
现在市场上有一些可以清除支原体的试剂,说实话我是不会用的,清除彻不彻底不说,对实验有啥影响也不好说。
检测到污染的细胞,一个字——扔。
检测支原体污染也是一道繁琐的工序,试想每批细胞都得检测一次,检测一次花一天功夫。
后来网上查到一种革命性的细胞污染支原体检测试剂盒,每次检测只需半个小时,给我减少了很多工作量,这么好用的东西当然要分享安利一波。
这种支原体检测试剂盒是由我国苏州先达基因公司研发的,其原理是基于该公司自主开发的实时荧光恒温核酸检测技术(ERA),可以在恒定的低温下(25℃-42℃)对痕量的支原体种内保守性DNA片段进行特异性的扩增,扩增反应可以在20min内完成,该试剂盒检测范围涵盖130种支原体。
ERA核酸扩增技术的核心是一套等温核酸扩增组合酶制剂。
通过酶工程改造,将来源于细菌和病毒的特定工具酶进行改造突变并筛选其功能,通过不同的DNA扩增反应体系进行优化组合,从而获得8种酶蛋白为核心的等温扩增体系。
配好的反应体系在各种实时荧光定量仪或者该公司自主研发的简易恒温荧光检测仪中,可实现恒温扩增与荧光信号检测于一体,通过实时荧光扩增曲线在20min内就可通过检测仪的显示屏读出检测结果,检测过程无需开盖,避免气溶胶的产生,结果可靠性大幅度提高。
ERA结合该公司提供的一步法提取DNA的试剂,进一步简化了支原体检测操作,5min完成细胞液的DNA提取,20min完成支原体DNA分子检测,整个过程只需30min。
细胞培养是生命科学研究、生物制药、临床细胞治疗等领域最核心的环节,但是细胞在培养过程中极易受到污染,其中支原体污染是最普遍的污染源,污染细胞的平均比例为30-60%,有些国家甚至高达80-90%。
用Ciprofloxacin和BMcyclin清除培养细胞的支原体污染米力;陈志南
【期刊名称】《第四军医大学学报》
【年(卷),期】1994(015)002
【摘要】防治支原体污染是细胞培养中难以解决的问题,我们用CIP和BMcyclin联合治疗清除了杂交瘤细胞HAb18,A10,骨髓细胞SP2/0和人白血病细胞K562中的支原体污染。
方法:3株小鼠细胞系(HAb18,A10,SP2/0)用含有10μg/mlCIP培养液治疗12d后根除了污染的支原体。
人细胞株(K562)用CIP加BMcyclin联合治疗26d后清除了支原体的污染。
结果:清除支原体后,细胞的增
【总页数】3页(P89-91)
【作者】米力;陈志南
【作者单位】不详;不详
【正文语种】中文
【中图分类】Q2-33
【相关文献】
1.培养细胞污染支原体的PCR检测方法的建立及应用 [J], 甘一迪;王银银;任芳丽;张旭;田硕;张诚
2.细胞支原体污染清除方法比较及清除后的应用 [J], 钱锦
3.应用电镜技术快速检测培养细胞中的支原体污染 [J], 李六金;姜焕宏;李成;刘建荣;马伟辉;李宏
4.用Ciprofloxacin去除传代细胞株中的支原体污染的研究 [J], 陈如颖;喻峰
5.一种新的抗生素联合用药方案清除细胞支原体污染的研究 [J], 黎少;梁永康;冯思桦;彭青;高毅
因版权原因,仅展示原文概要,查看原文内容请购买。
细胞培养中支原体污染的检测和去除
陈琳
【期刊名称】《国外医学:微生物学分册》
【年(卷),期】1999(022)002
【摘要】细胞培养过程中的支原体污染相当普遍。
如何快速,简便地检测支原体,并且采取有效措施去除支原体一直是细胞工作者们亟待解决的难题。
支原体检测方法有培养法,DNA荧光染色法,单克隆抗体免疫荧光法。
生化法,DNA探针杂交法,PCR法,支原体去除方法有药物法。
免疫法,稀释法,加热法。
本文就近年来有关支原体的检测及去除作一综述。
【总页数】4页(P28-31)
【作者】陈琳
【作者单位】北京军事医学科学院野战输血研究所
【正文语种】中文
【中图分类】Q2-33
【相关文献】
1.细胞培养中支原体污染的检测和去除 [J], 胡锦跃
2.细胞培养中支原体污染的去除 [J], 郭永军
3.细胞培养过程中支原体污染的检测和去除研究 [J], 陈琳
4.吕梁黑山羊成纤维细胞培养过程中支原体污染的快速发现及去除 [J], 吴苏君;李希;王曦
5.细胞培养过程中支原体污染的防治与检测方法 [J], 邢龙彬;刘长政;焦晓磊;刘彤;杜智;高英堂
因版权原因,仅展示原文概要,查看原文内容请购买。
BM-cycline消除支原体
支原体最突出的结构特征是没有细胞壁,一般来讲,对作用于细胞壁生物合成的抗生素,如 -内酰胺类、万古霉素等完全不敏感;对多粘菌素、利福平、磺胺药物普遍耐药。
对支原体最有抑制活性及常用于支原体感染治疗的抗生素是四环素类、大环内酯类及一些氟喹诺酮;其他类抗生素如氨基糖苷类、氯霉素对支原体有较小抑制作用,所以常不用来作为支原体感染的化学治疗剂。
去除支原体常用方法有抗生素处理、抗血清处理、抗生素加抗血清和补体联合处理。
一、 BM-cycline 的成分和原理
BM-cycline包括泰妙菌素(泰妙霉素 Tiamulin 或pleuromulin即BM-cyclineⅠ)和二甲胺四环素(米诺环素Minocycline 即BM-cyclineⅡ)。
抑制支原体及细菌生长,高效去除培养细胞中已感染的支原体。
适用于多种培养细胞,无明显副作用,又不影响细胞本身的代谢,而且处理过的细胞不会重新感染支原体。
泰妙菌素抑菌原理:泰妙菌素与细菌核糖体的肽基转移酶中心结合,导致多肽链起始复合物不能正确地装配,生理性地失活,易分解,并且不能进入多肽链延长期,从而导致细菌无法合成自身蛋白质。
二甲胺四环素抑菌原理:是与核糖体30S亚基的A位置结合,阻止肽链的延长,从而抑制细菌或其他病原微生物的蛋白质合成。
二、BM-cycline消除支原体的方法
1.抗生素制备
用PBS将BM-cyclineⅠ和Ⅱ配成250×浓缩液,即2500ug/mL和1250 ug/mL,-20℃保存备用,终浓度BM-cyclineⅠ为10 ug/mL、 BM-cyclineⅡ为5 ug/mL,使用浓度参考《组织培养和分子细胞学技术》117页表6-2。
2. 实验步骤
贴壁细胞:
贴壁细胞传代的同时加入BM-cyclineⅠ10 ug/mL,37℃培养3天,胰蛋白酶消化传代,加入BM-cyclineⅡ5 ug/mL,37℃培养3天,继续传代培养,追加BM-cyclineⅡ5 ug/mL培养2-4天后弃药液D-Hank’ s液洗2次,胰蛋白酶消化传代进行常规培养。
悬浮细胞:
取受支原体污染的细胞,吸除培养液,加入含BM-cyclineⅠ的培养液培养3天后,悬
浮离心,吸除培养液,再加入含BM-cyclineⅡ的培养液培养4天,如此3-4个循环,每个循环末均用用Hoechst33258(二苯并咪唑,用PBS配制工作浓度为0.05ug/mL)荧光染色镜检。
消除支原体的细胞再不加抗生素的培养液中传代3-4次即可获得纯净的无支原体污染的细胞。
如清除不彻底可再进行处理至纯净为止(一般3个轮回即能被完全消除,也有只进行一个BM-cyclineⅠ和BM-cyclineⅡ循环,就能去除支原体的)。
BM-cyclineⅠ和BM-cycline Ⅱ与CIP(4-氟,2-羟基喹啉)联合应用亦可,即先用含CIP的培养液培养12天后,再按上述方法处理。
(DNA荧光染色法:荧光染色用能与DNA特异性结合的荧光染料Hoechst 33258,可使支原体内含有的DNA着色,染色后用荧光显微镜观察。
具体方法如下:首先将细胞接种盖玻片上,在细胞未长满前取出玻片,用不合酚红的Hanks液漂洗一下,用l: 3醋酸甲酵固定10Min,然后用生理盐水漂洗.置于用生理盐水配浓度为50pg/ml的Hoechst 33258中染色10min。
染色后用蒸溜水洗1—2min.向细胞面滴加pH5.5磷酸缓冲液数滴,然后置荧光显微镜下观察。
镜下支原体为散在于细胞同围或附于细胞膜表面的亮绿色小点。
)商品:
Roche 货号:10799050001 品名 BM-Cycline 每包装(37.5mg) 可用于2 X 2.5升培养基。
三、扩展内容
1、造成支原体高污染率的原因为:
▪支原体size 0.1-0.8 um,无细胞壁,可透过一般过滤膜(0.22-0.45 um)
▪支原体污染时,没有明显的肉眼或一般光学显微镜可观察到的特征变化
▪缺乏简单、快速且可靠的检测方式
▪细胞流通间缺乏品管,造成实验室间的相互污染
▪研究或操作人员忽略污染问题
2、支原体污染了来源:
▪已受污染的细胞
▪操作人员的疏失
▪已受污染的培养基、血清
▪操作环境不良、实验器具不洁等
由于支原体为人体口腔中之正常菌丛,实验室之操作人员的污染亦可能为污染源,须十
分注意。
而万一细胞已受支原体污染时,最佳的处理原则为将细胞高压灭菌后丢弃,以免污染其它洁净的细胞株。
3、支原体的检测方法:
检测方法:1、相差显微镜检测;2、低张处理地衣红染色观察;3、 DNA荧光染色法;4、电镜检测;5、 3-H胸腺嘧啶掺入法;6、聚合酶链反映法;7、免疫学方法;8、支原体的培养。
还查到一种快速检测支原体感染的方法——瓜氨酸检测法,当细胞培养被支原体污染时,培养基中精氨酸量明显下降,同时有瓜氨酸出现;当支原体被消除后,瓜氨酸即消失。
用HPLC检测细胞培养中瓜氨酸的含量。
4、去除支原体的方法
抗生素法:BM-cyclin(Roche),MRA(mycoplasma removal agent, ICN),Ciprofloxcin (Bayer),Enrofloxacin(Bayer)
共培养法:与巨噬细胞共培养。
重新克隆法:抗生素处理后,将细胞稀释后传代,每周换2次含抗生素的新鲜培养液,4-5周后,重复克隆2次。
过滤法:0.22µm孔径滤膜正压过滤,去除效果不好。
5、预防与控制方面可从以下各点加强注意:
设备方面:
1、使用已作支原体测试后的细胞株
2、于另一隔离之区域操作未知是否有支原体污染之细胞
3、使用不添加抗生素的培养基培养细胞
检测方面:定期以标准的支原体检测方法检测细胞、培养基、血清、ddH2O有否被支原体污染。
实验操作人员之无菌观念与无菌操作技术之要求。