(教师参考)高中化学 4.2.3 硝酸的性质课件2 苏教版必修1
- 格式:ppt
- 大小:2.05 MB
- 文档页数:15

《硝酸的性质》教学重点:硝酸的不稳定性和强氧化性教学难点:硝酸的强氧化性课前准备:具支试管、分液漏斗、铜片、浓硝酸、稀硝酸、集气瓶(2个)、水槽、铁架台(带铁铗)、水教学过程:(一) 导入新授:盐酸、硫酸、硝酸是中学化学中常见的三大强酸。
它们除了都具有酸的通性外,均各有自身特殊的性质。
今天这节课我们就来学习硝酸的性质。
(二)新授内容:【展示】一瓶棕色试剂瓶装的浓硝酸(用试管取适量样品,便于观察)。
引导学生从颜色、状态、气味等方面观察,再阅读课本物理性质的有关内容,归纳硝酸的物理性质。
【投影归纳】一.硝酸的物理性质:纯硝酸是色、易、有气味的液体,密度为1.5027g/cm3,沸点是83℃,常用浓硝酸的质量分数约为69%,98%以上的硝酸叫发烟硝酸。
【设疑】从硝酸保存在棕色试剂瓶中,引出硝酸的不稳定性,我们学过的还有哪些物质也保存在棕色试剂瓶中的?它们共同的特性是什么?【板书】二.硝酸的化学性质:【板书】 1. 不稳定性:【展示】一瓶装在无色试剂瓶中的浓硝酸,显黄色。
原因分析且与工业盐酸黄色比较。
【师】硝酸在见光或受热时均易分解,而且越浓越易分解。
我们看到装在无色试剂瓶中的浓硝酸变黄色,就是因为硝酸分解产生的NO2又溶于硝酸中的缘故。
【板书】 4HNO3△4NO2↑+ O2↑+2H2O【学生】分析上述反应,氧化剂、还原剂、氧化产物、还原产物。
【问题】硝酸应该如何保存呢?【学生】盛放在瓶里,且放在的地方。
【问题】前面我们刚学过浓硫酸的性质,知道浓硫酸一个重要的特性是具有强氧化性,同学们回忆一下,浓硫酸的强氧化性具体表现在哪些方面。
【学生】常温使等金属钝化;加热时能和等不活泼的金属反应,能和等非金属反应;和等还原性化合物反应。
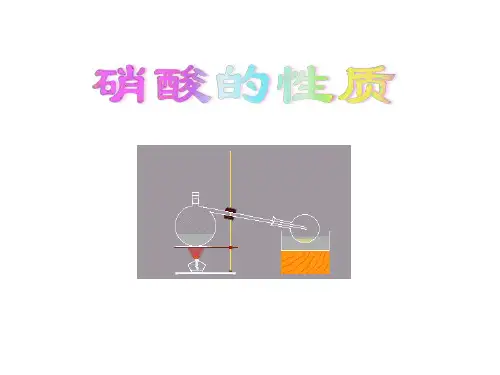
【设问】硝酸能不能和铜反应呢?【实验探究1】铜片与浓硝酸的反应,且用排水法收集产生的气体。
引导学生观察反应的剧烈程度,生成气体的颜色,试管中溶液颜色的变化等。
【实验探究2】在上述装置中,从分液漏斗向试管内加5毫升水,稀释硝酸,继续收集产生的实验现象结论实验1实验2【师】引导学生对实验现象的分析,推断产物,写出反应的化学方程式,且标出电子转移的方向和数目。

![化学必修一 硝酸的性质 PPT-苏教版 [苏教版]PPT教学课件](https://uimg.taocdn.com/9fc39e1776eeaeaad0f33007.webp)





《硝酸的性质》教学重点:硝酸的不稳定性和强氧化性教学难点:硝酸的强氧化性课前准备:具支试管、分液漏斗、铜片、浓硝酸、稀硝酸、集气瓶(2个)、水槽、铁架台(带铁铗)、水教学过程:(一) 导入新授:盐酸、硫酸、硝酸是中学化学中常见的三大强酸。
它们除了都具有酸的通性外,均各有自身特殊的性质。
今天这节课我们就来学习硝酸的性质。
(二)新授内容:【展示】一瓶棕色试剂瓶装的浓硝酸(用试管取适量样品,便于观察)。
引导学生从颜色、状态、气味等方面观察,再阅读课本物理性质的有关内容,归纳硝酸的物理性质。
【投影归纳】一.硝酸的物理性质:纯硝酸是色、易、有气味的液体,密度为1.5027g/cm3,沸点是83℃,常用浓硝酸的质量分数约为69%,98%以上的硝酸叫发烟硝酸。
【设疑】从硝酸保存在棕色试剂瓶中,引出硝酸的不稳定性,我们学过的还有哪些物质也保存在棕色试剂瓶中的?它们共同的特性是什么?【板书】二.硝酸的化学性质:【板书】 1. 不稳定性:【展示】一瓶装在无色试剂瓶中的浓硝酸,显黄色。
原因分析且与工业盐酸黄色比较。
【师】硝酸在见光或受热时均易分解,而且越浓越易分解。
我们看到装在无色试剂瓶中的浓硝酸变黄色,就是因为硝酸分解产生的NO2又溶于硝酸中的缘故。
【板书】 4HNO3△4NO2↑+ O2↑+2H2O【学生】分析上述反应,氧化剂、还原剂、氧化产物、还原产物。
【问题】硝酸应该如何保存呢?【学生】盛放在瓶里,且放在的地方。
【问题】前面我们刚学过浓硫酸的性质,知道浓硫酸一个重要的特性是具有强氧化性,同学们回忆一下,浓硫酸的强氧化性具体表现在哪些方面。
【学生】常温使等金属钝化;加热时能和等不活泼的金属反应,能和等非金属反应;和等还原性化合物反应。
【设问】硝酸能不能和铜反应呢?【实验探究1】铜片与浓硝酸的反应,且用排水法收集产生的气体。
引导学生观察反应的剧烈程度,生成气体的颜色,试管中溶液颜色的变化等。
【实验探究2】在上述装置中,从分液漏斗向试管内加5毫升水,稀释硝酸,继续收集产生的【师】引导学生对实验现象的分析,推断产物,写出反应的化学方程式,且标出电子转移的方向和数目。

