桥脑小脑角区脑膜瘤--The Neurosurgical Atlas系列
- 格式:doc
- 大小:31.00 KB
- 文档页数:11

手术治疗桥小脑角区大型脑膜瘤的研究进展摘要】桥小脑角位置在小脑、脑桥以及颞骨岩之间的不规则位置,该区域位置比较复杂。
发生大型脑膜瘤后可累及脑干、重要颅神经、大脑后动脉以及深静脉系统等,手术治疗难度系数较大。
目前临床对于桥小脑角区大型脑膜瘤手术治疗方法报道较少,一些临床医生在文献参考中难以找到证据,根据以上情况本次笔者收集中国知网、万方等数据库相关文献对手术治疗方式进行总结,综述目前手术治疗桥小脑角区大型脑膜瘤的研究进展。
[关键词]桥小脑角区;大型脑膜瘤;显微技术桥小脑角区肿瘤常见有听神经瘤、三叉神经瘤、脑膜瘤等,患者一般以Ⅴ-Ⅷ组颅神经受累为主要症状。
桥小脑角区脑膜瘤的血供比较丰富,加上肿瘤体积较大,并且与脑干、脑神经以及重要血管相邻,因此手术治疗难度较大。
此外临床对于桥小脑角区大型脑膜瘤治疗报道较少,使得较多的学者在临床治疗中难以找到参考证据,笔者将相关的报道进行统一整理,旨在为后续临床医生使用提供依据。
一、桥小脑角区大型脑膜瘤临床症患者临床表现为头痛、头晕、听力丧失以及眩晕等,由梗阻性脑积水压迫脑干、小脑从而导致政治出现比较晚。
内听道前肿瘤临床表现为三叉神经痛以及面神经和耳蜗神经损伤,该种疾病症状出现比较早,早期比较容易诊断,就诊时肿瘤尺寸比较小。
而内听道后脑膜瘤症状出现比较晚,就诊时体积偏大,患者多表现为小脑症状。
二、桥小脑角区大型脑膜瘤临床分型临床根据肿瘤主要附着的部位和主体所在的位置进行分型,这样有利于手术入路的选型。
Ding根据肿瘤与内听道关系将该肿瘤分为孔前型、孔后型、孔下型以及中央型[1]。
根据肿瘤侵犯方式分类将桥小脑角区脑膜瘤分为:内听孔后脑膜瘤、内听孔前脑膜瘤以及联合型,而联合型肿瘤是指内听孔前后均有肿瘤侵犯。
三、手术治疗手术治疗中重要的是手术的入路选择,而入路的选择取决于肿瘤的位置特征,包括起源位置、肿瘤主体部分位置、肿瘤与神经血管结构关系以及病人术前神经功能情况。
肿瘤底部与面神经、三叉神经等关系密切,孔前型神经与三叉神经、岩静脉、小脑前下动脉和小脑上动脉等关系密切,与面听神经之间有较多的蛛网膜隔离,因此术中可以轻松的对面听神经进行保护。





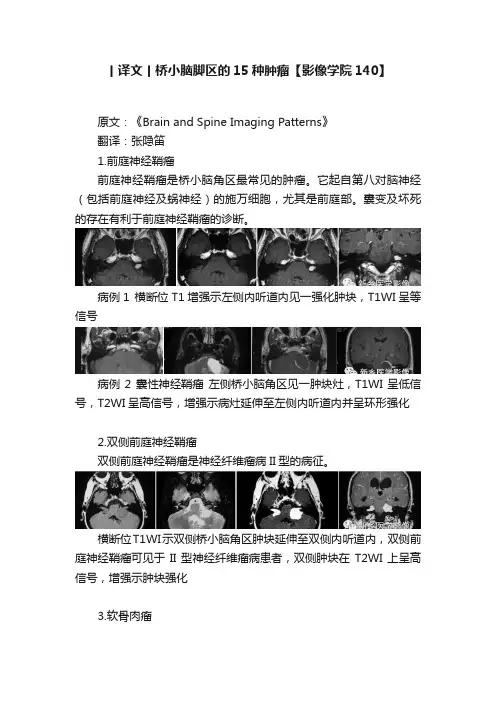
丨译文丨桥小脑脚区的15种肿瘤【影像学院140】原文:《Brain and Spine Imaging Patterns》翻译:张隐笛1.前庭神经鞘瘤前庭神经鞘瘤是桥小脑角区最常见的肿瘤。
它起自第八对脑神经(包括前庭神经及蜗神经)的施万细胞,尤其是前庭部。
囊变及坏死的存在有利于前庭神经鞘瘤的诊断。
病例1 横断位T1增强示左侧内听道内见一强化肿块,T1WI呈等信号病例2 囊性神经鞘瘤左侧桥小脑角区见一肿块灶,T1WI呈低信号,T2WI呈高信号,增强示病灶延伸至左侧内听道内并呈环形强化2.双侧前庭神经鞘瘤双侧前庭神经鞘瘤是神经纤维瘤病II型的病征。
横断位T1WI示双侧桥小脑角区肿块延伸至双侧内听道内,双侧前庭神经鞘瘤可见于II型神经纤维瘤病患者,双侧肿块在T2WI上呈高信号,增强示肿块强化3.软骨肉瘤横断位FLAIR示斜坡右侧、桥小脑角区见一等信号肿块灶,T2WI 呈高信号,增强呈斑片状强化,软骨肉瘤强化较脊索瘤明显4.内淋巴囊瘤颞骨岩部内淋巴囊瘤是非常罕见的神经外胚层肿瘤,肿瘤内可有出血、含铁血黄素沉积、胆固醇结晶及散在炎性巨细胞。
这些侵袭性的乳头状肿瘤实际上是颞骨的低级别乳头状腺瘤,其具有的腺体功能提示它们起源于内淋巴囊。
大部分内淋巴囊瘤是偶发的。
VHL综合征的患者发生内淋巴囊瘤的几率更大。
横断位T1WI示左侧桥小脑角区不规则形高信号肿块,T2WI呈高信号并可见肿块位于第七及第八对脑神经后方,增强肿块见强化,DWI未见确切弥散受限5.面神经鞘瘤面神经鞘瘤发生于沿面神经走行的任何节段,但其最常累及膝状神经节并沿此向近端及远端延伸。
面神经鞘瘤通过岩骨可累及中后颅窝,它通常是穿过岩骨中部,而三叉神经鞘瘤通常穿过岩尖部附近。
冠状位T1WI示右侧桥小脑角区混杂信号肿块,T2WI呈分叶状高信号,FLAIR呈高信号,增强呈多分叶状,其内见囊变区6.三叉神经鞘瘤三叉神经鞘瘤发生在第五对脑神经走行区域内。
肿瘤沿神经走行经环池入Meckel腔及海绵窦。




小脑脑桥角脑膜瘤是怎么回事?
*导读:本文向您详细介绍小脑脑桥角脑膜瘤的病理病因,小脑脑桥角脑膜瘤主要是由什么原因引起的。
*一、小脑脑桥角脑膜瘤病因
*一、发病原因:
1.暂无相关资料。
*二、发病机制:
1.肿瘤的类型以内皮型和纤维型多见,多发生于岩骨后面和内听道内侧的脑膜上,常与岩上、下窦或乙状窦相连。
多数呈球形结节状,少数为扁平状。
肿瘤的血供来自于岩骨后面的硬脑膜,也可来自于小脑前下和小脑后小动脉的分支。
按肿瘤与内听道的关系,常分为内听道前组和内听道后组。
*温馨提示:以上就是对于小脑脑桥角脑膜瘤病因,小脑脑桥角脑膜瘤是由什么原因引起的相关内容叙述,更多有关小脑脑桥角脑膜瘤方面的知识,请继续关注疾病库,或者在站内搜索“小脑脑桥角脑膜瘤”找到更多扩展内容,希望以上内容可以帮助到您!。
桥脑小脑角区脑膜瘤--The Neurosurgical Atlas系列桥小脑角区肿瘤约占全部颅内肿瘤的10%,其中约6%~15%为脑膜瘤。
这些肿瘤通常起源于颞骨岩部外侧到第V颅神经间后表面的硬脑膜。
Cushing和Eisenhardt首先在1938描述其类似于“听神经瘤”。
肿瘤起源部位常使其临近的重要血管解剖结构发生变化扭曲。
因为大部分CPA脑膜瘤源于颅神经后方(Ⅴ、Ⅶ/Ⅷ、Ⅸ和Ⅹ),这些神经被向前推移,与肿瘤间有完整的蛛网膜分隔。
然而,因为这些结构处于术者的视野盲区,在肿瘤切除后期才被辨识,所以易受到手术操作的损伤。
邻近病变向内侧移位的血管包括基底动脉、椎动脉、小脑前下动脉、小脑后下动脉。
依据CPA区脑膜瘤的定义,病变的临床表现、手术的难度及预后不同。
为解决上述异质性的问题,根据肿瘤与内听道(IAC)的位置关系,将CPA脑膜瘤分为内听道前、内听道后及前后联合三类。
内耳道后肿瘤的亚型分类根据肿瘤是否突入内听道。
内听道前型又被细分为向内/上生长的肿瘤(伴或不伴肿瘤扩展到Meckel’s腔、幕上或内听道)以及向内/下生长的肿瘤(伴或不伴肿瘤扩展到颈静脉孔、内听道或枕骨大孔)。
这些分型预示了手术的难度及预后。
肿瘤位置越靠内侧,累及Meckel’s腔、内听道(IAC)、幕上、颈静脉孔或枕骨大孔的,预示着更糟的预后;累及颈静脉孔的肿瘤与手术并发症的发生最密切相关。
正如预期的那样,这些因素提示肿瘤只能次全切除、复发的风险升高。
诊断:CPA脑膜瘤的临床表现同这一区域的其他病变类似。
常见的症状包括听力丧失、眩晕、头痛、面部疼痛/麻木、平衡失调。
少见症状包括偏瘫、脊髓病变、偏身麻木、声音嘶哑、吞咽困难及梗阻性脑积水导致的颅高压症状。
位于内听道前的肿瘤通常早期即有三叉神经损害(面部疼痛/麻木)、轻度面瘫以及听力下降。
内听道后部肿瘤通常长到很大才出现症状,表现为小脑功能障碍。
评估:向下生长的大肿瘤,需要耳鼻喉科对声带和吞咽功能进行评价。
某些CPA脑膜瘤在核磁共振图像上很难同听神经瘤鉴别,因为这两种肿瘤都是均匀强化的。
但是CPA脑膜瘤的中心通常不在内听道(IAC),而是广基底粘附于岩骨脊后方的硬膜或小脑幕。
脑膜瘤很少起源于内听道内,但它们能继发地侵入内听道。
内听道一般不会扩大,并且肿瘤与颞骨岩部的夹角较大。
听神经瘤使内听道增宽,并与颞骨岩部形成锐角,其内可能有囊性成分,被膜后部可能有脑脊液裂隙。
对于脑膜瘤患者,应仔细评估T2加权像以确定是否存在软膜受累或血管被包绕的情况。
脑组织水肿常表明软膜侵犯,如果追求彻底切除,将增加手术并发症的风险。
CT扫描可以指引切除增生的骨质。
钙化的肿瘤手术是一个艰巨的挑战,因为肿瘤与周围组织的粘连,妨碍了肿瘤的手术切除及移动。
即使是大的肿瘤,笔者也不提倡术前栓塞,因为在手术之初沿着颞骨岩部在肿瘤基底部就能轻易地阻断血供。
图1 :左侧颞骨岩部/CPA脑膜瘤(顶行)。
颞骨岩部脑膜瘤的中心常远离ICA,并以宽基底附于颞骨岩部后方的硬膜。
下面一行图片显示右侧颈静脉孔区脑膜瘤,没有明显地突入内听道。
手术适应证脑膜瘤可选择的处理方法包括:连续的影像学观察,手术切除、立体定向放射(Stereotactic Radiosurgery,SRS)治疗或者手术切除联合SRS。
老年患者罹患无症状的小肿瘤或有轻微症状的肿瘤,抑或合并相关医疗禁忌症的,可予连续的影像学观察。
治疗主要针对持续增大的肿瘤。
对于体积小但无占位效应的肿瘤可采取立体定向放射治疗。
对因占位效应继发神经功能障碍的肿瘤应切除,并以全切为目标. 然而,全切肿瘤不应该损害神经功能。
对于复杂的颅底脑膜瘤,次全切除能以保留神经功能,随后对于残余肿瘤进行立体定向放射治疗是一个新兴的模式。
笔者的目标偏好全切肿瘤,但亦接受为保留功能而行次全切除,这些基于术中情况而定。
随后通过连续的影像检查来监测残余肿瘤的情况。
并将SRS备用于治疗影像学随访发现增大的残余肿瘤。
术前注意事项:一旦决定手术切除,术中推荐进行脑干听觉诱发反应(BAERs)及体感诱发电位(SSEP)的监测。
对于侵及内听道及颈静脉孔的肿瘤,建议对患者进行面神经的肌电描记以及后组颅神经的监测。
笔者在手术开始前留置腰大池引流来降低幕下张力。
这样在早期即可对肿瘤进行安全地移动(未对其囊内切除减压前),以便在颞骨岩部肿瘤基底处彻底地阻断其血供。
这一操作能提高肿瘤减压及切除的手术效率。
基于颅底高分辨率CT的术中导航对切除受累骨质是有益的。
手术解剖详细了解后颅窝颅神经的相关解剖,以及小脑前/后下动脉的解剖是必要的。
图2:经左侧乙状窦后入路所示CPA区的颅神经(左图)。
切开小脑幕后,部分切除内听道上结节(右图)。
经乙状窦后入路,通过小脑幕裂孔-内听道上方的通道易于切除突向中颅窝及Meckel′s腔的脑膜瘤(由AL Rhoton,JR供图)。
更多信息请参考岩尖脑膜瘤一章。
大多数CPA脑膜瘤将后组颅神经向下方推移,并使第V-Ⅷ颅神经向前方移位。
图3:后颅窝其他颅神经的解剖如图所示。
CPA 脑膜瘤的切除已有几种不同的颅底入路用于处理CPA脑膜瘤,包括乳突后入路,经迷路入路、迷路后入路、经岩骨入路、远外侧入路及中颅窝通道等。
而最终手术入路选择取决于肿瘤的特征,包括其起源的位置、肿瘤主体的位置及与之相关神经血管结构的位置关系,特别是颅神经以及病人术前的神经功能状态。
对于肿瘤大且无有效听力的患者,可考虑经迷路或其变异入路;不过,有证据支持术前因脑膜瘤所致的第Ⅷ颅神经功能障碍较听神经瘤更可能获得改善。
笔者认为这一入路对切除CPA脑膜瘤作用极小,且常常引起不必要的暴露及延长手术时间。
笔者倾向于将扩大的乳突后入路用于大多数CPA脑膜瘤。
较之其他广泛去除颅底骨质的入路,这一入路提供了对CPA 区的良好视野,且入路相关的并发症发生率较低。
CP区脑膜瘤很少延伸到脑干腹侧及包裹颅神经。
对内听道后的肿瘤尤其如此。
位于内听道前部的肿瘤需要术者在颅神经之间的多个通道内操作;而这种操作空间的局限并不能通过更广泛地去除颞骨岩部的骨质获得改变。
对已延及枕骨大孔的肿瘤,可通过向下扩大乙状窦后入路的骨窗而抵达。
与之类似,对于幕上较大的肿瘤,通过小脑后、小脑上的通道进行切除,作为补充,亦可切开小脑幕将手术空间扩大至中颅窝(参见“经小脑幕入路切除海马旁病变”一章)。
硬膜内的操作在乳突后开颅、硬膜切开并翻开后,开始显微操作。
随后的步骤,按照特定的顺序,可提高脑膜瘤切除的安全性及手术效率(亦称为脑膜瘤的4D原则):1).Dedress(expose) the tumor:显露肿瘤;2).Devascularize the tumor:阻断肿瘤血供;3).Debulk the tumor:囊内切除,缩小肿瘤;4).Dissect the tumor:分块切除肿瘤。
如上所述,在囊内切除肿瘤前,最大程度阻断肿瘤血供可避免失血过多。
这使囊内切除、瘤内减压得以高效地实现;重要的是,在切除过程中,脑干及颅神经间是一个相对没有出血的洁净术野。
以下插图所示对内听道后部肿瘤切除技术的总结。
图4:初始阶段硬膜下暴露的左侧肿瘤。
注意骨切除的范围超过乙状窦,以便缝吊硬膜牵拉使乙状窦远离手术操作区域。
如果未行腰大池引流,可在后组颅神经周围的桥小脑角池释放脑脊液。
切断肿瘤后方包膜与小脑之间粘连的蛛网膜。
图5:如图所示颅神经相对于内听道后部肿瘤前侧包膜的大致分布。
仔细研读术前核磁影像能为术者对占位的病理解剖以及关键结构提供一个三维的理解。
图6:随后,笔者电凝切断肿瘤后部包膜的血供。
注意保护行往小脑的过路血管是非常重要的。
图7:接下来的重要操作包括切断肿瘤附着处的血供,以及在肿瘤囊内切除前沿颞骨岩部外侧阻断其供血动脉。
然后沿着这个平面,最大限度地分离肿瘤,但要特别注意不要损伤沿着肿瘤前部的被膜进入相应孔道的颅神经。
脑脊液引流后允许轻柔的移动肿瘤,而不用牵拉周围结构。
颞骨岩部-小脑幕连接处可作为术中的定位标志。
中等大小的肿瘤,于其下极可见后组颅神经。
图8:随后,使用超声吸引器囊内切除肿瘤。
已无血供的肿瘤极少需要在瘤内逐步地止血,因而可快速切除。
肿瘤前部的被膜应被完整保留,且不要无意间将其损伤。
图9:充分的囊内切除肿瘤可以保证移动柔韧的肿瘤被膜时不会牵拉影响周围结构。
锐性分离后组颅神经与肿瘤包膜下极。
附于颅神经的蛛网膜要慎重处理。
粘连的血管要通过显微外科操作来游离。
图10:然后从小脑幕及三叉神经上游离出肿瘤的上极。
岩上静脉被牺牲掉。
寻找并保护好滑车神经(被一层厚的蛛网膜包被),避免在该神经上直接操作。
要注意保护经过此处的小脑上动脉分支。
图11:用饼状的小棉片将小脑外侧从已游离的肿瘤上“蹭开”,并以棉片标示相应的分离界面。
肿瘤移动/“转动”的最安全方向是自内向外,依此,颅神经在脑干水平其根部附近可被及早地辨识(上图)。
中图为术中照片,图示由内至外的分离操作后确认的第Ⅶ颅神经根出脑干区(箭头所示)。
仔细追踪“肿瘤的供血动脉”至肿瘤包膜,方可舍弃该血管(下图,箭头指示处;第Ⅶ颅神经以“*”标记)。
这一技术确保途径术区的血管能得以保存,包括迷路动脉。
图12:图中清晰可见肿瘤的供血动脉起源于小脑上动脉的分支,追踪其至肿瘤处,然后在此将其离断。
随后从桥脑侧方和三叉神经起始部锐性分离开肿瘤。
保留了桥脑前部表面的软膜静脉。
进一步囊内切除肿瘤减压是必要的,以避免移动肿瘤挤压损伤重要结构。
图13:最后应仔细检查肿瘤的被膜,以确认其所有的附着处均被切断。
然后将其分块切除。
第Ⅴ颅神经可能与肿瘤紧密粘连,需要仔细分离,以免引起三叉神经的损害。
所有覆于脑干的软膜结构都应该保留。
使用罂粟碱浸泡的明胶海绵以缓解脑干及颅神经周围小血管的痉挛。
图14:关颅前,检查所有重要的神经血管结构以确认其解剖保留。
切除或电凝颞骨岩部的硬膜,以降低肿瘤复发的风险;因颅神经已进入相应的孔道,这一操作不会造成颅神经热损伤。
可以磨除受累的岩部骨质。
内听道前部肿瘤的切除应遵循同样的显微手术技巧。
然而颅神经被肿瘤向后推移,因此术者必须在颅神经之间分块切除肿瘤。
第V颅神经对牵拉的耐受度最强,所以要利用好三叉神经上方及下方的空间进行操作。
其他的操作空间位于第Ⅶ/Ⅷ颅神经复合体及后组颅神经之间。
肿瘤常常扩大了神经间的通道。
分离肿瘤的方向应遵循由外而内。
包被于肿瘤内的颅神经及血管结构应予仔细地保留。
为此内听道前部的肿瘤通常会残留一部分,因为颅神经间的操作空间有限常常不能完成肿瘤的全切。
内听道前部或后部的脑膜瘤都可突入内听道。
暴露内听道内的肿瘤需要去除内听道后壁。
骨质磨除的范围取决于肿瘤在内听道内延伸的程度。
小脑外侧脑膜瘤小脑凸面脑膜瘤的切除技术同内听道后部肿瘤相同。
术前MRV确定横窦乙状窦的通畅程度,如若静脉窦已闭塞,应预估全切肿瘤的可行性。