03植物细胞跨膜离子运输 ——【中国农业大学考研资源】
- 格式:docx
- 大小:74.64 KB
- 文档页数:14

物质跨膜运输的方式知识点总结1500字物质跨膜运输是维持细胞内外环境平衡的关键过程之一。
跨膜运输有两种方式:主动运输和被动运输。
主动运输是由细胞消耗能量来推动物质跨越细胞膜,被动运输是通过物质自身的浓度梯度来实现跨越细胞膜。
在主动运输中,有两种重要的机制:主动转运和背景电解质通道。
主动转运是指通过跨膜蛋白质,在逆浓度梯度下将物质从低浓度区域转运到高浓度区域。
这种跨膜蛋白质包括离子泵、载体蛋白和ATP酶。
离子泵是一种利用能量(通常是ATP)来将离子从低浓度区域转运到高浓度区域的蛋白质。
最常见的例子是Na+/K+转运泵,它将三个Na+离子从细胞内转运到细胞外,同时将两个K+离子从细胞外转运到细胞内。
载体蛋白是细胞膜上的蛋白质,它可以通过构象变化将物质从细胞外转运到细胞内或者相反。
ATP酶则是利用ATP分解的能量来进行物质转运的蛋白质。
背景电解质通道是指通过细胞膜上的通道蛋白质,在运动的过程中允许物质自由通过,但不需要额外的能量。
这种通道蛋白质可以分类为离子通道和水通道。
离子通道根据通透性可以分为不选择性通道和选择性通道。
不选择性通道允许各种离子通过,而选择性通道只允许特定类型的离子通过。
水通道则允许水分子通过,最常见的例子是蛋白质水通道(aquaporin)。
被动运输包括扩散和渗透。
扩散是指物质沿着浓度梯度自发地从高浓度区域移动到低浓度区域的过程。
这种运输方式不需要能量,并且是无需外力驱动的。
扩散速率取决于物质在溶液中的浓度差异,以及物质的分子大小和电荷等性质。
渗透是指溶质通过半透膜从低浓度溶液自发地运动到高浓度溶液的现象。
半透膜是一种允许溶剂通过但不允许溶质通过的膜。
在渗透过程中,溶剂(通常是水)会通过半透膜,使得高浓度溶液的浓度降低,低浓度溶液的浓度增加。
这种过程不需要额外能量,但是渗透压差会推动溶剂的移动。
总结起来,物质跨膜运输的方式有主动运输和被动运输两种。
主动运输是通过细胞消耗能量来推动物质跨越细胞膜,包括主动转运和背景电解质通道。
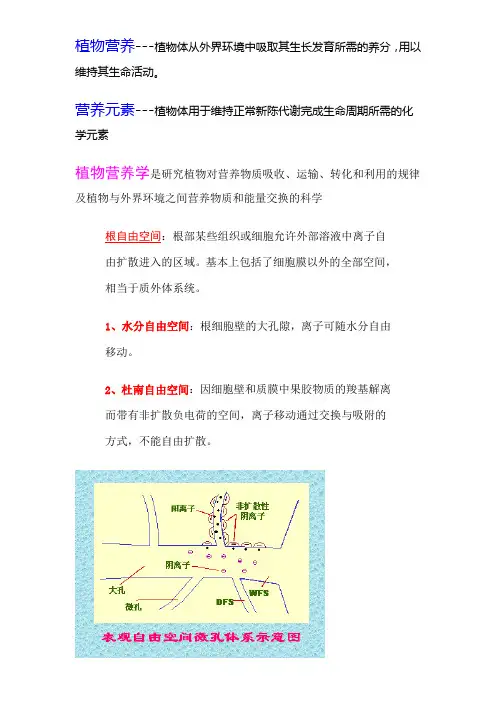
植物营养---植物体从外界环境中吸取其生长发育所需的养分,用以维持其生命活动。
营养元素---植物体用于维持正常新陈代谢完成生命周期所需的化学元素植物营养学是研究植物对营养物质吸收、运输、转化和利用的规律及植物与外界环境之间营养物质和能量交换的科学根自由空间:根部某些组织或细胞允许外部溶液中离子自由扩散进入的区域。
基本上包括了细胞膜以外的全部空间,相当于质外体系统。
1、水分自由空间:根细胞壁的大孔隙,离子可随水分自由移动。
2、杜南自由空间:因细胞壁和质膜中果胶物质的羧基解离而带有非扩散负电荷的空间,离子移动通过交换与吸附的方式,不能自由扩散。
细胞膜上的3种转运蛋白:通道(channel)、载体(carrier)、泵(pump)离子通道(ion channel): 膜上的选择性孔隙。
由它调节的离子运输属被动扩散,速度快,主要用于水和离子,如,水通道、K+通道、Ca2+离子通道。
离子泵 (pump):逆电化学势直接将分子或离子泵出膜内或膜外,与能量供应直接偶联。
也称为初级主动运输。
根据离子运输是否使膜内外产生净电荷而分为致电泵与电中性泵。
致电泵:离子的运输使膜内外产生净电荷,如H+泵,即ATP水解而产生H+,并将其泵出膜外。
[致电泵驱动阳离子跨膜运输的假说模型]电中性泵:离子的运输不使膜内外产生净电荷,如动物中的H+/K+-ATP酶。
植物中只有H+泵和Ca2+泵,泵出的方向为膜外。
载体(carrier): 在膜的一侧与被转运分子或离子结合,再到另一侧释放。
速度慢,运输物质的形式多样。
如NO3-,H2PO4-等。




细胞生物学物质的跨膜运输试题以下是一些关于细胞生物学中跨膜运输的试题:1.请解释什么是细胞膜的跨膜运输?跨膜运输是指物质通过细胞膜从一个细胞内区域或环境进入另一个区域或环境的过程。
这个过程涉及到物质穿越细胞膜的疏水性内层,并与细胞膜上的载体蛋白或通道蛋白相互作用。
2.请列举细胞膜跨膜运输的两种主要机制,并简要描述它们。
-主动转运:主动转运是指物质在细胞膜跨膜运输时需要消耗能量(通常为三磷酸腺苷,ATP)。
这种机制可以使物质在浓度梯度之外被积累,如钠-钾泵。
-被动扩散:被动扩散是指物质在细胞膜跨膜运输时不需要消耗能量,遵循浓度梯度自发地从高浓度区域向低浓度区域移动。
这种机制包括简单扩散和载体介导的扩散。
3.请解释离子通道蛋白的功能以及如何实现离子选择性。
离子通道蛋白是一类跨膜蛋白,它们具有特定的结构域,形成一个通道,使特定类型的离子能够穿过细胞膜。
离子通道蛋白通过开启或关闭来调节离子的通行。
离子选择性是由离子通道蛋白中的氨基酸残基决定的。
通道蛋白的内部有特定位置的氨基酸残基,可以与特定大小、电荷和水合状态的离子相互作用。
这种相互作用使得只有特定类型的离子能够通过通道,其他离子则被阻挡在外。
4.请解释细胞膜上的载体蛋白如何实现物质的跨膜运输?细胞膜上的载体蛋白通过与物质结合并发生构象变化来实现物质的跨膜运输。
这些载体蛋白在细胞膜上形成一个通道或者运输器,物质结合到载体蛋白上后,载体蛋白会发生构象变化,使物质从一个细胞内区域转移到另一个区域。
载体蛋白的跨膜运输可以是被动的,遵循浓度梯度自发地将物质从高浓度区域向低浓度区域转移,也可以是主动的,需要消耗能量才能将物质从低浓度区域向高浓度区域转移。


高等植物钾离子的跨膜运输机制研究进展(资源与环境学院)摘要:钾离子是一种对于植物生长和发育必需的元素,但目前对钾离子跨膜运输机制是如何被调控的还不为所知。
中国农业大学武维华教授等人在2006年6月30日的《细胞》上说蛋白激酶CIPK23在钾离子低浓度情况下可以调控钾离子运输。
这一研究对于某些作物疾病治疗具有指导意义。
近些年对改良植物营养性状的研究十分活跃,特别是随着现代生物科学的快速发展,钾素营养的研究取得了可喜的进展。
随着分子生物学技术的不断发展和广泛应用,有关植物质膜钾离子转运体的研究取得重要进展。
目前已经克隆到多种质膜钾离子转运体基因并对钾离子转运体生化特性以及结构功能进行了广泛研究。
文章分别从结构、功能以及相关基因等三方面综述了关于植物钾离子通道的分子生物学研究进展,并对应用生物工程技术改良植物的钾营养性状进行了讨论。
关键词:钾离子通道;结构;基因自1865年Lucanus及1866年Birner和Lucanus最先提出钾是高等植物生长所必需的元素以来,钾素研究取得了很大进展[5]。
钾是植物生长必需的大量营养元素,有重要的营养和生理作用,同一植物不同品种或不同植物对钾的吸收、分配、转运和利用效率等方面存在着很大的差异。
Fageria NK等对10个不同大豆基因型从产量方面进行了钾效率评价的研究[6]。
姜存仓等在营养液培养条件下对86 个不同棉花基因型苗期进行钾效率筛选,发现不同基因型之间钾效率存在显著差异,在低钾条件下,高效基因型与低效基因型相比,具有明显的生长优势[7]。
George,Melvin Sidikie 等用 2 a 的大田试验研究了84个不同基因型马铃薯的钾吸收和利用效率,不同基因型之间产量有较大的差异[8]。
Hanadi El Dessougi 等对春小麦、大麦和糖用甜菜进行了钾效率的研究,结果表明在钾缺乏条件下,小麦比大麦和甜菜有较高的钾效率,但植物种类的钾效率差异的生理机制还不清楚[9]。

细胞膜运输方式归纳细胞膜是细胞的外部边界,起到保护细胞内部结构和调控物质进出的作用。
细胞膜运输是指通过细胞膜实现物质在细胞内外之间的转运过程。
细胞膜运输方式多种多样,可以总结为主动转运、被动转运和胞吞作用。
一、主动转运主动转运是细胞膜运输中的一种重要方式,它需要消耗细胞内的能量,将物质从低浓度区域转运到高浓度区域。
主动转运主要通过离子泵和载体蛋白实现。
1. 离子泵离子泵是细胞膜上的跨膜蛋白,能够将离子从低浓度区域转运到高浓度区域。
其中最为常见的是钠钾泵。
钠钾泵通过耗费ATP的能量,将细胞内的钠离子排出,同时将细胞外的钾离子吸入,维持了细胞内外钠离子和钾离子的浓度差。
2. 载体蛋白载体蛋白是细胞膜上的一种跨膜蛋白,它能够与特定的物质结合,使物质通过细胞膜转运。
载体蛋白可以分为通道蛋白和载体蛋白两类。
通道蛋白形成一个通道,物质通过蛋白通道直接进出细胞;载体蛋白则通过构象变化将物质从一侧转运到另一侧。
二、被动转运被动转运是细胞膜运输中的一种 passively方式,不需要消耗细胞内的能量,物质沿浓度梯度自然地从高浓度区域转运到低浓度区域。
被动转运主要包括扩散、渗透和载体蛋白介导的转运。
1. 扩散扩散是指物质在浓度梯度作用下自由移动的过程。
物质的扩散速率与浓度梯度成正比,与分子大小和溶剂的温度有关。
细胞膜的磷脂双层具有一定的通透性,小分子物质如氧气、二氧化碳等可以通过扩散进出细胞。
2. 渗透渗透是指溶质通过半透膜从高浓度溶液移动到低浓度溶液的过程。
渗透有两种情况,一种是液体渗透,即水分子通过细胞膜的水通道蛋白(如水蛋白)进出细胞;另一种是溶质渗透,即溶质通过细胞膜的载体蛋白进出细胞。
三、胞吞作用胞吞作用是一种细胞膜运输方式,细胞通过改变细胞膜的形状将大分子物质或其他细胞完整地包围进入细胞内部。
胞吞作用分为胞吞和胞噬两种形式。
1. 胞吞胞吞是指细胞通过细胞膜的变形将固体颗粒或大分子物质包围进入细胞内部。
细胞内的囊泡与细胞膜融合形成胞吞泡,胞吞泡内的物质被逐渐降解消化。

【母题来源】2022全国新课标1卷第2题【母题原题】离子泵是一张具有ATP水解酶活性的载体蛋白,能利用水解ATP释放的能量跨膜运输离子。
下列叙述正确的是A. 离子通过离子泵的跨膜运输属于帮忙集中B. 离子通过离子泵的跨膜运输是顺着浓度阶梯进行的C. 动物一氧化碳中毒会降低离子泵跨膜运输离子的速率D. 加入蛋白质变性剂会提高离子泵跨膜运输离子的速率【答案】C【考点定位】物质跨膜运输【命题意图】本题借助一个新情景——离子泵是一张具有ATP水解酶活性的载体蛋白,能利用水解ATP释放的能量跨膜运输离子考查主动运输的相关学问学问。
【考试方向】物质跨膜运输是高考会经常考到的学问点。
细化考核主动运输的相关学问。
要求同学能结合题中给出的信息,并依据所学的主动运输的相关学问,进行分析并作出精确推断的力量。
【得分要点】解答此题的关键是围绕“离子泵是一张具有ATP水解酶活性的载体蛋白,能利用水解ATP释放的能量跨膜运输离子”这一信息进行发散思维,从中提取出有效信息:通过离子泵的跨膜运输属于主动运输,在此基础上结合主动运输的特点逐一分析各选项,问题就能迎刃而解。
1.(2022-2021学年湖北省荆门市高二下学期期末质量检测)图中Ⅰ~Ⅳ说明白物质和离子通过细胞膜的转运方式,下列叙述中正确的是()A.全部图中均为主动运输B.在图Ⅱ和图Ⅲ中为主动运输,在图Ⅰ和图Ⅳ中为被动运输C.在图Ⅰ、Ⅱ和Ⅳ中为渗透作用D.在图Ⅲ中为主动运输,而在图Ⅰ、Ⅱ、Ⅳ中为被动运输【答案】D2.(2022-2021学年广东省广州市执信中学高二下期末)下图为氨基酸和Na+进出肾小管上皮细胞的示意图。
下表选项中正确的是选项管腔中氨基酸→上皮细胞管腔中Na+→上皮细胞上皮细胞中氨基酸→组织液A主动运输被动运输主动运输B被动运输被动运输被动运输C被动运输主动运输被动运输D主动运输被动运输被动运输【答案】D3.(2022届四川成都第七中高三4月)将某哺乳动物的两种细胞置于肯定浓度的 Q 溶液中,测定不同状况下吸取 Q 的速率,结果如下表所示:由表中数据能得出的结论是A.两种细胞吸取 Q 均取决于浓度差B.两种细胞吸取 Q 均不需载体蛋白的参与C.胚胎干细胞吸取 Q 的方式为主动运输D.成熟红细胞吸取 Q 的方式为被动运输【答案】C【解析】依据题意,胚胎干细胞通入空气后吸取速率发生明显转变,说明胚胎干细胞可以进行有氧呼吸释放能量,为细胞吸取相关物质供应能增多导致吸取速率提高,即胚胎干细胞吸取相关物质的方式与能量的多少有关,则肯定为主动运输;而成熟红细胞不能吸取速率不未发生明显变化,则成熟红细胞不能进行有氧呼吸,但因成熟红细胞可进行无氧呼吸,也可为物质运输供能,故吸取方式不能确定,可能为任意一种跨膜运输。
植物跨膜离子转运蛋白与其耐盐性关系研究进展西北植物,2OO6,26(3):0635--0640ActaBot.Borea1.一Occident.Sin.文章编号:1000—4025(2OO6)03—0635—06植物跨膜离子转运蛋白与其耐盐性关系研究进展王景艳,张高华,苏乔,安利佳,刘兆普h(1南京农业大学资源与环境科学学院,南京210095;2大连理工大学基因工程实验室,辽宁大连116024)摘要:盐胁迫下植物吸收过多的Na,使植物体内的离子平衡受到破坏,为了维持其正常生长细胞内的各种离子就必须保持平衡.而这一过程主要是由位于质膜和液泡膜上的离子转运蛋白完成的,并在植物耐盐性方面起关键作用.本文主要对响应盐胁迫的几种跨膜转运蛋白如:K/Na离子转运蛋白,Na/H逆向转运蛋白以及与其相关的H一ATPase等,在植物耐盐分子生物学方面的研究进展进行综述.关键词:盐胁迫;跨膜离子转运蛋白;K/Na离子转运蛋白;Na/H逆向转运蛋白;H一ATPase;耐盐性中图分类号:Q945.78文献标识码:A ResearchAdvancesabouttheRelationbetweenMembrane—spannedIonTransporterandSaltToleranceinPlantsW ANGJing—yan,ZHANGGao—hua,SUQiao,ANIA—jia,LIUZhao—pu'(1CollegeofResourcesandEnvironmentalScience,NanjingAgricuhuralUniversity,Nanji ng,210095,China;2GeneEngineeringIJab.DalianUniversityofTechnology,Dalian116024.China)Abstract:Undersaltstress,planttakeupexcessiveNaSOasmaketheionequilibriuminsideth eirbodieslosebalance,andinordertomaintaintheirgrowth,theyneedmaintainthisequilibrium;Thispr ocessisper—formedbyiontransportersonplasmlemmaandvacuolemembraneandplaysacrucialroleinpl antsalttol—erance.Thepapersummarizedtheresearchadvancesinplantsalttolerancebiologyaboutsev eralmem—brane—spannediontransporters.suchasK/NaJ.transportersandNa/Hanti—portersandtheirrelatedH一ATPase,whichrespondtosaltstress.Keywords:saltstress;membrane—spannediontransporter;K/Natransporter;Na/Hanti—porter;H一ATPase:salttolerance盐分对植物的伤害主要包括两方面:其一,土壤中较高的溶质浓度导致的水分亏缺;其二,植物吸收水分的同时吸收了过多的盐离子所带来的离子毒害,特别是Na毒害.高浓度Na可置换质膜和细胞内膜系统所结合的Ca,膜所结合的离子中Na/Ca比增加,膜的通透性增大,同时,植物体内活性氧代谢系统的平衡受到影响,活性氧含量增加,而活性氧清除剂(s()D等)活性及含量降低,膜脂过氧化或膜脂脱脂作用被启动,而导致膜的完整性被破坏,差别透性丧失,电解质及某些小分子有机物大量渗漏,细胞物质交换平衡破坏,进而导致一系列生理生化代谢紊乱,使植物受到伤害.植物降低Na的毒害的主要策略有离子外排和区域化,这两方面都与植物跨膜离子转运蛋白有着密切的关系.收稿日期:2005—09—15;修改稿收到日期:2006—01—21基金项目:国家863海洋生物技术资助项目(2003AA627040)作者简介:王景艳(1982一),女(汉族),在读硕士生.*通讯联系人Correspondenceto:IAUZhao—pu.E—mail:************.cn636西北植物1植物K+,Na+转运蛋白与耐盐性的关系钾是植物正常生长所必需的大量元素之一,参与植物许多生理生化过程包括酶活性调节,蛋白质合成皮渗透调节等,对植物生长起着非常重要的作用].因此保持胞质内较高的K/Na比对于植物生长非常必要.但在植物受到盐害时,这种高的K/Na比值往往由于Na含量的增加而降低,这主要是因为K和Na具有相似的水合离子半径,使得部分运输K的载体亦有运输Na的功能].一般认为植物对K的吸收主要有两种系统:系统1为低亲和性K吸收系统,在外界K浓度较高(1~10mmol/I)时介导K的吸收,是一种被动的K吸收过程,需要消耗能量,主要靠K通道来完成;系统2为高亲和性K吸收系统,在外界K浓度较低(0.001~O.2mmol/I)时介导K的吸收,主要由K载体完成l_l1].1.1低亲和性K通道已确定的K通道大致可分为3种类型:内向整流K通道(Kinwardrectifyingchannels,KIRCs),外向整流K通道(Koutwardrectifyingchannels,K()RCs),电压不依赖型阳离子通道(volt—ageindependentcationchannels,VICs).内向整流K通道(KIRCs)是对K浓度敏感的,依赖电压的,对K亲和力低的通道l3],如拟南芥的AKT1l5],主要存在于细胞的质膜上,具有特殊的电势依赖性,在细胞膜超极化(hyperpolarization)的电压条件下被激活打开,即在跨膜电势很低时被打开,引起胞外的K流入胞内].而拟南芥AKT1缺失突变体与野生型对盐分所表现出的相似敏感性表明:AKT1没有或极少有运输Na的功能I.外向整流K通道(KORCs)在质膜去极化时开放,介导K外排及Na内流].通过膜片钳技术已从许多植物品种和组织中鉴定到K()RCsE.从大麦根中分离出的KORCs具有较高的K/Na选择性,而从拟南芥根细胞中得到KORCs却对Na有较高的选择性|】¨.这些通道中有一种无选择性外向整流通道(nonselectiveoutwardrectifyingcon—ductance,NORC)对阳离子吸收没有特殊选择性,胞质内Ca离子浓度上升即可将其激活.许多研究表明,植物细胞质膜上还存在电压不依赖型阳离子通道(voltageindependentcation channels,VIC),这些通道比电压依赖型通道(KIRC和K()RC)具有较高的Na/K选择性|1.1998年Amtmann和Sandersl】提出了不同阳离子通道的简单模型并认为电压不依赖型通道是高盐环境中Na吸收的主要途径.1.2高亲和性K载体目前从植物根中分离的高亲和性K运输载体有两种,其一为与细菌(Achromobacter)和酵母(Satha7一omycescerevisiae)同源的KUP—HAK基因家族(K—uptaketransporter—highaffinityK transporter)[;其二为HKT1(highaffinityK transporter)运输体,即高亲和性K运输体HKT~.在拟南芥中已发现6个编码KUP—HAK高亲和K运输载体的同源基因,大麦中也发现HK1和AvHAK2基因l】.HAK运输体通过K/H协同作用发挥效应并有较高的K选择性,Na一可在毫摩尔浓度范围内竞争性阻碍HAK运输K.,且大麦AvHAK1在毫摩尔Na浓度下可介导Na一吸收.小麦TaHKT1是第一个从植物中鉴定的编码HKT1蛋白,在微摩尔Na浓度下为Na/K协同运输体,在毫摩尔Na浓度下为Na单向运输体..而拟南芥AtHK7'1只运输Na",水稻HKT有2个基因编码,OsHK7'1类似AtHK7'1为Na运输体,而OsHK7'2类似'nHK了'1可作为Na一/K协同运输体或单向运输体,OsHK7'1基因转录活性在低外界K浓度下增加而在高外界Na浓度下降低l2.Rus纠等的研究结果进一步表明HKT1蛋白在Na'吸收中的重要作用.盐胁迫条件下,拟南芥hktl—sos3双突变体植株Na含量明显降低,甚至比野生型还低,而K含量明显高于野生型.由此可见AtHK7'1不只是K运输系统,它也控制Na内流,是Na和K内流系统调节者(regulator),同时也可能控制Na进入木质部进而控制Na向地上部分的运输.以上结果可以看出,部分吸收和运输K的转运蛋白确实有吸收和运输Na的功能,但其具体的3期王景艳,等:植物跨膜离子转运蛋白与其耐盐性关系研究进展!吸收机制和调控机制仍不清楚.2植物Na+/H+逆向转运蛋白与耐盐性的关系Na/H逆向转运蛋白(NaH'.antiporteror exchanger,NHAorNHE)是酵母,藻类,动物以及高等植物膜系统上普遍存在的一种转运蛋白,是一种依赖跨膜的Na,H浓度梯度而产生的电中性的Na/H1:1跨膜转运蛋白_2.高等植物质膜和液泡膜上的Na/H逆向转运活性分别以质膜上的P 型H一ATPase和液泡膜上的V型HATPase,H一PPiase建立的跨膜质子梯度作为驱动力,驱动Na运出细胞或运进液泡.2.1植物液泡膜Na/n逆向转运蛋白目前研究较多的是液泡膜Na/H逆向转运蛋白,主要有拟南芥的AtNHX1,水稻的OsNHX1_2],小麦的TaNHX1_2,柑橘的cN—HX1[,番杏TtNHX1[3ol,玉米ZmNHX[],碱蓬的SsNHX1(AF370358),北滨藜的AgNHX1_3以及盐角草的SeNHX(AY131235)等.它们都有高度保守的氨氯吡嗪咪结合位点(即?FF??LIPPI).Na对液泡膜Na/H逆向转运蛋白基因的诱导作用因部位不同而有差别.在NaC1胁迫下,拟南芥的AtNHX1mRNA水平在叶中是对照的4倍,而在根中几乎与对照无差异【3.盐胁迫能促进北滨藜的根和叶中AgNHX1mRNA的转录及蛋白产物的增加_3.水稻幼苗用100mmol/INaC1处理24h后,地上部的0sⅣHX1基因的转录水平比根中高,且地上部和根中分别是对照的2.3和1.8倍, 证明0sⅣHX1经盐诱导后的表达增强且具有器官特异性_2.但无论在正常生长条件下还是在盐分胁迫下,液泡膜Na/H逆向转运蛋白活性和表达的调控机制还不十分清楚.对于植物液泡膜Na/H逆向转运蛋白基因的遗传转化研究发现,转单一的Na/H.逆向转运蛋白基因能够明显提高作物的耐盐性.ApseC等对转AtNHX1基因的拟南芥植株进行了分析, 过量表达Na/H逆向转运蛋白的转基因拟南芥植株在200mmol/LNaC1中能正常生长发育;免疫印迹表明,从转化植株叶片中提纯的液泡比从野生型中具有更多的AtNHX1的基因表达产物,液泡膜上Na/H逆向转运蛋白活力增强.将北滨藜的AgNHX1转入水稻中发现,转化植株的耐盐性是对照植株的8倍,且可以在300mmol/L的NaC1胁迫下存活3d.Zhang等m将拟南芥的AtNHX1基因转入番茄中,发现过量表达液泡膜Na/H逆向转运蛋白的转基因番茄在200mmol/LNaC1胁迫下能够正常生长,开花和结实,且叶片中Na浓度较高,而番茄果实中Na浓度却很低.2.2植物质膜Na/H逆向转运蛋白相对于植物液泡膜Na/H逆向转运蛋白来说,质膜Na/H逆向转运蛋白(SOS1,saltoverly sensitive)的研究较少.2002年美国亚利桑那大学植物科学系Zhu等以拟南芥为研究材料,通过快中子轰击(fastneutronbombardment),T—DNA诱变或化学突变(如EMS诱导)等分析手段,筛选盐敏感SOS突变体(saltoverlysensitive),从而鉴定了5个耐盐相关基因,即:0S1,S02,S03,SOS4和SOS5e.~.01基因编码一个含有1146个氨基酸残基,分子量为127kD的多肽(SOS1).它的N端具有高度疏水性,并含有12个跨膜结构域;亲水性的C端较长(约700个氨基酸残基),残留在细胞质中, SOS1蛋白N端的12个跨膜结构域与动物或微生物的Na'./H逆向转运蛋白(antiporter)结构域相当相似.Na/H逆向转运同源蛋白的进化树分析表明,拟南芥SOS1与其它植物,细菌和真菌质膜Na/H逆向转运蛋白,如裂殖酵母(f^Dsnff^n—romycesp017lbe)的SOD2,啤酒酵母(Schizosaccha—romycescerevisiae)的NHA1以及假单胞杆菌(Pseudomonaasaeruginosa)的NhaP等的亲源关系较近,而与动物质膜和植物液泡膜Na/H逆向转运蛋白关系较远,如NHE6,AtNHX1等.因此, SOS1很可能就是拟南芥质膜上的Na/H逆向转运蛋白,在功能上起到把Na排出细胞外的作用.Northern分析检测SOS1基因在盐胁迫下的表达情况【d:在没有盐胁迫因子存在的情况下,检测到0S1mRNA;盐胁迫因子正调控SOS1 mRNA,这个调控是针对NaCI的,它不发生在脱落酸或冷害处理的条件下,SOS1mRNA在拟南芥的根部的含量比在枝叶中多,在根部和地上部SOS1 的表达都是由NaCI胁迫因子正调节的,这个正调控是与SOS1耐Na离子的作用相一致的.638西北植物以上实验结果表明,Na/H逆向转运蛋白活性的有无和高低与植物的耐盐性密切相关,在高盐浓度下植物可以分别通过质膜和液泡膜上的Na/H逆向转运将Na运出细胞和将Na区域化在液泡构,维持细胞质内Na稳态和K/Na比相对稳定,以适应盐渍环境.3植物H+一ATPase与耐盐性的关系盐胁迫使植物质膜受到破坏,大量Na涌入细胞,从而也破坏了植物体内原有的电势平衡.植物质膜H一ATPase,液泡膜H一ATPase和Ht_PPase均具有维持细胞质内的pH值的稳定,为细胞吸收和转运营养物质及离子提供质子驱动力(PMF:pro—tonmotiveforce)l一蛇等生理功能,Na的外排和区隔化也都依赖跨膜电化学势梯度提供能量.最近对拟南芥质膜H一ATPase的研究结果表明,质膜H一ATPase可能决定植物的耐盐性".拟南芥编码质膜H一ATPase的AH4基因主要在根内皮层和花中表达,H4的缺失突变体(aha421)植株在NaCI胁迫下,根及地上部的Na/K比对照增加4~5倍,表明HA4可调控Na跨内皮层流动.盐胁迫能够激活植物液泡膜H一ATPase活性和质子泵的H转运能力,主要包括蛋白丰度的提高,动力学特征的改变,亚基成分的变化及表达调控的改变等.对盐生植物碱蓬液泡膜H十_ATPase的研究表明,NaCI胁迫明显增加了碱蓬液泡膜H十_ ATPase的水解活性和酶活性,促进了其A,B,H,e亚基的转录及蛋白表达产物的增加.植物液泡膜H一PPase主要负责H向液泡内的转运,控制胞质pH值稳定及焦磷酸代谢.过量表达拟南芥液泡膜H一PPase转基因植株的Na/H逆向转运蛋白活性增强,明显提高了其耐盐性和抗旱性.4结语在盐胁迫下,植物维持体内离子的平衡是植物对盐胁迫适应及耐盐性的关键因素.目前研究较多的是Na'的区隔化,即对植物液泡膜Na/H逆向转运蛋白及相关H一ATPase的研究,Na的吸收及外排机制却还并不清楚.因此,随着分子生物学技术的不断发展,关于植物Na的吸收,外排,K/Na选择性及其调控机制,以及各种机制之间关系将成为今后的研究热点,这对今后植物耐盐新品种的培育及盐碱地的利用都有着重大意义.参考文献:[1]刘友良,汪良驹.植物对盐胁迫的反应和耐盐性[A3.余叔文,汤章诚.植物生理-j 分f-*t-:物学i-M].北京;科学出版社,1998:752—767.E23潘瑞炽,董愚得.植物生理学(第三版)[M].北京:高等教育出版社,2000:29—3(). [33BIUMWAIDE.Sodiumtransportandsalttoleranceinplants[J].("urrentOpi111~minCel lBiology,2000,12:431--434.[43MAATHUISFJM,SANDERSD.Mechanismofpotassiumabsorptionbyhigherplantro ots[J].PlantPhysio1.,1996,96:158~168.[53SENTENACH,B()NNEAUDN,MINETM,I.ACR()UTEF,SAIM()JM,GAYMARI)F ,GRIGN()NC.Cloningandexpressi0nin yeastofaplantpotassiumiontransportsystem[J].fiem,1992,256:663—665.[63吴平,印莉萍,张立平,等.植物营养分子生理学[M].北京:科学出版社,2001:163211.,[73SPAIDINGEP,HIRSCHRE,I.WEIS1)R,ZHIQ,SUSSMANMR,LEWISl{1).Potassiu muptakesupportingplantgrowlhintheab—seneeofAKT1channelactivity.Inhibitionbyammoniumandstimulationbysodium[J].(mP sio1.,1999,113:909—918.[83scHAcHTMANDP.MolecularinsightsintothestructureandfunctionofplantKtransportmechanisms[J].Biochim.Biohys.AftⅡ,2002,I465:127—139.[93HIRSHRE,LEWISBD,SPAI1)1NGEP.ArolefortheAKTIpotassiumchannelinplantn utrition[J3.cience,1998,280t918--921.[1O]WEGNERLH,RASHKEK.Ionchannelsinthexylemparenchymaofbarleyroots[J3.P IⅡntPhysio1.,1994,105:799813.[11]MAA THUISFJM,SANDERSI).ContrastingrolesiniontransportoftwoKchanneltype sinrootcellsofArabidopsithⅡliⅡnⅡ[J].Planta,1995,197}456—464.[123DEBORAH,WEGNERLH.Regulatorymechanismsofionchannelsinxylemparench ymacells[J].J.Exp.Bot.,1997,48:451--458.[133TYERMANSD,SKERREETlM.Rootionchannelsandsalinity[J].Sci.Hurt.,1999,78l 175—235.3期王景艳.等:植物跨膜离子转运蛋白与其耐盐性关系研究进展639[14][15][16][17][18][19][2O][21][22][23][24][25][26][27][28][29][3O][3i][32][33][34][35][36][37][38]AMTMANNA.SANDERD.MechanismsofNa+uptakebyplantcells[J].AdvancesinBota nicalResearch,1998,29;76—112-SCHACHTMAND.1luw.M0lecularpiecestothepuzzleoftheinteractionbetweenpotassiu mandsodiumuptakeinplants[J].TrendsPlantSci..1999.4:281—286.SANTA—MARIAG.RUBIOF,DUBCOVSKYJ,RODRIGUEZ—NZVZRROA.TheHAKIgeneofbarleyisamemberofalargegene familyandencodesahigh—affinitypotassiumtransporter[J].PlantCell?1997,9:2281—2289-KIMEJ,KWAKJM.UOZUMIN.SCHROEDERJl.AtKUP1:AnArabidopsisgeneencodin ghigh—affinitypotassiumtransportactivi—ty[J].PlantCell,1998.10:51—62.FUH,LUANS.AdualaffinityKtransporterfromArabidopsis[J].PlantCel1.1998.10:63—73.CHACHTMANDP.SCHROEDERJ1.Structureandtransportmechanismofhighaffinityp otassiumuptaketransporterfromhigherplants[J].Nature,l994,370:655—658.UOZUMIN.KIMEJ,BRESSANRA,PARDOJM.HASEGAWAPM.TheArabidopsisHK TIgenehomologmediatesinwardNa currentsinenopuslaevisoccytesandNauptakeinSaccharomycescerevisiae[J].PlantPhysio1.,2000,122:1249--1259.HORIET.YOSHIDAK.NAKAY AMAH.YAMADAK,()lKlSKSHlNMY()A.Twotypeso fHKTtransporterswithdifferentproper—tiesofNaandKtransportinOryzasativa[J].Plant.,..2001.270:129—138.RUSA,KYOKOI.SKSHARKHUUA.KREDDYMKI,EEBHKMATSUMOTOT.KKKO W AHK,ZHUJK.KBRESSANRA.KHAsEGAwAPM.AtHK'I'1isasalttolerancedeterminatethattonirolsNaentryintoplantro ots[J].PANS,2001,98:14150—14155.BIUMMWAIDE.POO1ERJ.Na/Hantiportinisolatedtonoplastvesiclesfromstoragetissue ofBetavulgarls[J].PlantPhysio1.,1985.78:163—167.BI,UMMWAI,DE,REAPA,POOl,ERJ.Preparationoftonoplastvesicles:ApplicationstoH 一coupledsecondarytransportinplantvacuoles[J].MethodsEnzymo1.,1987.148:115—123.DUPORTFM.Salt—inducedchangesiniontransport:regulationofprimarypumpsandsecondarytransporters[A] .CookeDT,ClarksonDT,eds.Transportandreceptorproteinsofplantmembranes[M].NewY ork:PlenumPress.1 992:91—100.GARIOI,ARA?RAOR?SHERMANA.GRISAFIP,AIPERSl,.FINKGR.TheArabidopsis thalianaprotontransporters.AtNhxlandAvpl,canfunctionincationdetoxificationinyeast[J].Prt~"A.1999, 96:1480—1485.FUKUDAA,NAKAMURAA?TANAKAY.MolecularcloningandexpressionoftheNa/He xchangergeneinOryzasativa[J].BiochimicaetBiophysieaActa.1999,1446:149—155.W ANGZN(王子宁).ZHANGJs(张劲松).GUOBH(郭北海).HESJ(何思洁),TIANAG(田爱国).CHENSHY(陈受宜).Cloning andcharacterizationoftheNa/Hantiportgenesfrom7'riticumaestivum[J].ActaBotanicaSincia(植物),2002,44(10):12O3—1208(inChinese).PORATR?PAVONCEI1,OD?BEN—HAYYIMG.LURIES.AheattreatmentinducedtheexpressionofaNa/H+antiportgene(cN —HXI)incitrusfruit[J].PlantScience.2002.162:957—963.I.OHX(吕慧颖)?LlYx(李银心).CHENH(陈华).1IUJ(刘晶).LlP(李平).YANGQK(杨庆凯).MolecularcloningandcharacterizationofaNa/Hantiportergeneinhalophytel'etragoniatetragonioides[J].HighTe chnologyLetters(高技术通讯),2004,11:26—31(inChinese).CHRISTIANZANJAN.SANDRAK.FENGY.SVENS.Molecularcharacterizati0nofNa+ /H+antiporters(ZmNHX)ofmaize(Zeamaysl,.)andtheirexpressionundersaltstress[J].PlantPhysio1..2005,162:55—66. HAMADAA.SHONOM.XIA T.OHTAM.HAYSHIY.TANAJAA.HAYAKAWA T.Isolati onandcharacterizati0n0faNa+/H+ antiportergenefromthehalophyteAtriple.rgmelini[J].PlantMolecularBiology.2001.46:3 5--42.QUINTEROFJ'BIA TTMR,PARD()JM.Functionalconservationbetweenyeastandplante ndosomalNa+/H+antiporters[J].FEBSLetter.2000.471:224——228.APSEMP,AHARONGS.SNEDDENW A.BI,UMWAIDE.Salttoleranceconferredbyover expressionofavacuolarNa+/H+an—tiportinArabdopsis[J].Science,1999.285:I256—1258.OHTAM?HAYASHIY?NAKASHIMAA.HAMADAA.TANAKAA.NAKANURA T,H Y AKAW AT.Introducti0nofaNa/H+ antiportergenefromAtriplexgmeliniconferssalttolerancetorice[J].FEBSLetter.2002,532 :279—282.ZHANGHX,BI,UUMW ARDE.Transgenicsalt~toleranttomatoplantsaccumulatesaltinfoliagebutnotinfruit[J].N口tureBiotecho—ogy?2001?19:765—768.ZHUJK.GeneticanalysisofplantsalttoleranceusingArabidopsis[J].PlantPhysio1.,2000,1 24;941—948.SHIH,XIONGL,STEVERSONB.TheArabidopsissaltoverlysensitive4mutantsuncovera criticalroleforvitaminB6in口lantsaIt640西北植物26卷tolerance[J].PlantCell,2002,14:575—588.[39]SHIH.ZHUJK.s()S4,apyridoxalkinasegene,isrequiredforroothairdevelopmentinAr abidopsis[J]?PlantPhysiol?,2002,129:585——593.[403SHIH.KINYS,Gu()Y.TheArabidopsisSOS5locusencodesaputativecellsurfaceadhe sionproteinandisrequiredfornormalcellex—pansion[J].PlantCell,2003.15:19—32.[41]SHIH,ISHITANIM,KIMC.TheArabidopsisthalianasalttolerancegeneSOS1encodes aputativeNa/Hantiporter[J].Proc.Nat1.A,2000,97(12):6896—6901.[423W ANGBSH(王宝山),z()UQ(邹琦).Advancesinthestudyonplasmamembrane—boundtranslocatingproteinsandtheirrelationswithsalttoleranceinplants[J].ChineseBulletinBotany(植物学通报),2000,17(1):17—26(inChinese).[43]VITATV,BAXTER1,D()ERNERP,HARPERJF.Evidenceforaroleingrowthandsaltre sistanceofaplasmamembraneH一AT—Paseintherootendodermis[J].Plant.,.,2001,27:191—201.[44]RATAJAZAR.Structure,functionandregulationoftheplantvacuolarH一translocatingATPase[J].Biochim.BiophysAeta,2000,1465:17—36.[45]LIPH(李平华),(;HENM(陈敏),WANGBSH(王宝山).EffectofKnutritionongrowthandactivityofleaftonoplastV—H一A T—PaseandV—PPaseof5"口ⅡsalsaunderNaCIstressEJ].ActaBotanicaSinica(植物),2002.44:433—440(inChinese).[46]MAESHAMM.Tonoplasttransportersorganizationandfunction[J].Annu.Rev.Physi o1.PlantMo1.Bio1.,2001,52:469--497.[47]GAXIAOIARA.DroughtandsalttolerantplantsfromoverexpressionoftheAVPHpum p[J].PANS,2001,98:11444—11449.[483YANGHJ(杨惠娟),ANGY(安国勇),ZHANGG(张国),M1AOCH(苗琛),ZHOUY(周云),SONGCHP(宋纯鹏).Effectsof NaandCaontheinwardKcurrentintheplasmamembraneofArabidopsisrootcells[J].ActaB ot.Borea1.一cident.Sin.(西北植物).2004,24(8):1409—1413(inChinese).[49]MA TJ(马挺军),LIZH(李卓),ZHANGXJ(张旭家),WANNGSHSH(王沙生).StudiesonpurificationoftonoplastH一ATPase fromPopuluseuphraticaanditssalttolerance[J].ActaBot.Borea1.一OccidentSin.(西北植物),2004,24(7):1246—1249(inChi—nese).[50]LIPH(李平华),ZHANGH(张慧),W ANGBSH(王宝山).Ionichomeostasisofplantundersaltstress[J].ActaBot.Borea1.一Occi—dent.Sin.(西北植物),2003,10:1810一I817(inChinese).。
第四章植物细胞跨膜离子运输第一节生物膜的化学组成与生物膜的主要理化特性第二节细胞膜结构中的跨膜运输蛋白第三节植物细胞的离子跨膜运输机制第四节高等植物K+、Ca+的跨膜运输机制研究进展[主要内容]:介绍植物细胞膜的化学组成和理化特性,膜上运输蛋白的类型、离子跨膜运输机制及K+、Ca+跨膜运输机制研究进展。
[教学要求]:要求学生了解细胞离子跨膜运输的意义,生物膜的理化特性,掌握膜上运输蛋白的类型、特性及离子跨膜运输的机理,了解K+、Ca+的跨膜运输机制研究进展。
[教学重点]:离子跨膜运输蛋白的种类、特性,离子跨膜运输机理。
[教学难点]:[授课时数]:3学时引言(3 min)高等植物的生长发育有赖于构成植物个体的活细胞不断从土壤、大气、水体等环境中吸收利用各种矿质元素。
在植物细胞水平上对营养元素的吸收利用过程是植物不断吸收营养元素的基础。
植物细胞质膜是细胞与环境之间的空间界限,活细胞对各种营养元素的吸收就是这些元素的跨膜运输过程。
植物所必需的各种矿质元素大部分是以带电离子的形式被吸收的,因此本章的主要内容是“植物细胞跨膜离子运输”。
植物细胞与动物微生物细胞跨膜离子运输机制有许多相似之处,也有不同之处,但作为物质运动的一种形式,都遵循物理化学的基本规律。
以下先介绍离子跨膜运输的基本知识,在此基础上讨论各种离子的运输过程。
第一节生物膜的化学组成和物理化学性质(8分)细胞最外层是质膜,它是外界物质进入的屏障,质膜控制着细胞与环境的物质交流,维持了细胞内环境的相对稳定。
质膜是由双磷脂层与蛋白质构成。
磷脂结构:胆碱、磷酸、甘油、脂肪酸(饱和,不饱和)。
与磷脂相联的蛋白质分两类:内在蛋白(Integral)、外在蛋白(Peripheral)内在蛋白插入双层脂中,常常是跨膜的。
外在蛋白通过非共价键,如氢键,附着在膜上。
所以磷脂表现出亲水和亲脂的性质。
为研究生物膜对溶质的通透性,常用人工双层脂膜和生物膜进行比较研究:结果表明:对于非极性(O2)和极性小分子(如H2O、CO2、甘油)二者的通透性类似。
第四章植物细胞跨膜离子运输
第一节生物膜的化学组成与生物膜的主要理化特性
第二节细胞膜结构中的跨膜运输蛋白
第三节植物细胞的离子跨膜运输机制
第四节高等植物K+、Ca+的跨膜运输机制研究进展
[主要内容]:介绍植物细胞膜的化学组成和理化特性,膜上运输蛋白的类型、离子跨膜运输机制及K+、Ca+跨膜运输机制研究进展。
[教学要求]:要求学生了解细胞离子跨膜运输的意义,生物膜的理化特性,掌握膜上运输蛋白的类型、特性及离子跨膜运输的机理,了解K+、Ca+的跨膜运输机制研究
进展。
[教学重点]:离子跨膜运输蛋白的种类、特性,离子跨膜运输机理。
[教学难点]:
[授课时数]:3学时
引言(3 min)
高等植物的生长发育有赖于构成植物个体的活细胞不断从土壤、大气、水体等环境中吸收利用各种矿质元素。
在植物细胞水平上对营养元素的吸收利用过程是植物不断吸收营养元素的基础。
植物细胞质膜是细胞与环境之间的空间界限,活细胞对各种营养元素的吸收就是这些元素的跨膜运输过程。
植物所必需的各种矿质元素大部分是以带电离子的形式被吸收的,因此本章的主要内容是“植物细胞跨膜离子运输”。
植物细胞与动物微生物细胞跨膜离子运输机制有许多相似之处,也有不同之处,但作为物质
1
运动的一种形式,都遵循物理化学的基本规律。
以下先介绍离子跨膜运输的基本知识,在此基础上讨论各种离子的运输过程。
第一节生物膜的化学组成和物理化学性质(8分)
细胞最外层是质膜,它是外界物质进入的屏障,质膜控制着细胞与环境的物质交流,维持了细胞内环境的相对稳定。
质膜是由双磷脂层与蛋白质构成。
磷脂结构:胆碱、磷酸、甘油、脂肪酸(饱和,不饱和)。
与磷脂相联的蛋白质分两类:内在蛋白(Integral)、外在蛋白(Peripheral)
内在蛋白插入双层脂中,常常是跨膜的。
外在蛋白通过非共价键,如氢键,附着在膜上。
所以磷脂表现出亲水和亲脂的性质。
为研究生物膜对溶质的通透性,常用人工双层脂膜和生物膜进行比较研究:
结果表明:
对于非极性(O2)和极性小分子(如H2O、CO2、甘油)二者的通透性类似。
对于离子和大的极性分子(如糖)二者表现出较大差异。
天然生物膜比人工膜通透性大得多。
说明:天然生物膜中的蛋白质有利于这些溶质运输。
生物膜中促进溶质运输的蛋白质。
称为运输蛋白(transport proteins)。
二者没有差异的小分子显然可通过双层脂运输。
2
第二节.细胞膜结构中的离子跨膜运输蛋白(30 min 重点内容)
研究已发现膜上有大量与运输有关的蛋白质。
一般将其分为三种类型:
通道蛋白(channel);载体(carrier);离子泵(ion pump)
通道蛋白是细胞膜上的一类内在蛋白,一般由几个亚基构成选择性孔道,孔的大小及孔内表面电荷等性质决定它转运溶质的性质。
离子通道的构象会随环境条件的改变而发生变化,处于某些构象时,中间形成孔道,允许溶质通过,由大小和电荷决定……。
当受到细胞内部或外界环境的刺激时,通道以某种方式关闭。
根据孔开闭的机制将通道分为两类:一类是膜电势控制的通道,可对跨膜电势梯度发生反应,另一类则对外界刺激(如光照,激素等)发生反应的通道。
图3—5是一个假想的K+离子通道模型:在这里,K+顺电化学势梯度(逆浓度梯度)从外转移到细胞内。
感受蛋白可对细胞内外由光照激素等引起的刺激做出反应,并通过某种未知方式将感受的信号传膜上的阀门由此做出开关的决定。
在植物细胞质膜上已鉴定出K+、Ca+、Cl-等离子的通道。
气孔保卫细胞质膜上内、外向的K+通道如图。
近年膜片钳技术的应用大大推动了离子通道的研究。
Patch clamp PC技术是指使用微电极从一小片细胞膜上获取电子信息的技术。
载体蛋白:也是膜上的内在蛋白。
由载体蛋白转运的物质,首先与载体蛋白的活性部位结合,结合后载体蛋白产生构象变化,将被转运物质暴露于膜的另一侧,并释放出去。
载体蛋白对溶质的运输具有高度特异性;但同一族的分子或离子可具有共同的载体,如
3。