分析化学3.3.3.1 酸碱指示剂的变色原理及选择
- 格式:ppt
- 大小:1.33 MB
- 文档页数:9

酸碱指示剂变色原理(一)酸碱指示剂变色1. 简介•酸碱指示剂是一种广泛应用于化学实验室和工业生产中的化学试剂。
•它能够通过颜色的变化来确定溶液的酸碱性质。
2. 原理•酸碱指示剂是由一种或多种指示剂组成的混合物,指示剂是一种具有特定酸碱变色性质的化合物。
•指示剂分子的结构决定了它的酸碱变色性质。
•当酸碱指示剂与溶液中的氢离子或氢氧根离子发生反应时,指示剂分子会发生结构变化,从而导致颜色的变化。
3. 酸性指示剂•酸性指示剂在酸性溶液中呈现出不同的颜色。
•例如,酚酞是一种常用的酸性指示剂,它在酸性溶液中呈现出红色。
4. 碱性指示剂•碱性指示剂在碱性溶液中呈现出不同的颜色。
•例如,甲基橙是一种常用的碱性指示剂,它在碱性溶液中呈现出黄色。
5. 中性指示剂•中性指示剂在酸性和碱性溶液中都呈现出不同的颜色。
•例如,酚酞甲醛是一种常用的中性指示剂,它在酸性溶液中呈现出红色,在碱性溶液中呈现出黄色。
6. 其他指示剂•除了酸性、碱性和中性指示剂,还有一些根据具体需要设计的特殊指示剂。
•例如,铜铁吡啶三酮是一种可以用于测定氧化还原电位的指示剂。
7. 应用领域•酸碱指示剂广泛应用于化学实验室和工业生产中。
•在化学实验室中,酸碱指示剂可以用于酸碱度测定、滴定等实验。
•在工业生产中,酸碱指示剂可以用于监测和控制化学反应过程中的酸碱性质。
8. 注意事项•不同的酸碱指示剂对pH值的判断范围有所不同,使用时需要根据实际情况选择合适的指示剂。
•酸碱指示剂具有酸碱性质,避免直接接触皮肤和眼睛,使用时需佩戴实验手套和护目镜。
通过以上的介绍,可以看出酸碱指示剂变色原理的基本工作方式。
它可以帮助我们快速判断溶液的酸碱性质,提高化学实验和工业生产的效率和准确性。
希望本文能给读者带来一些有用的信息。
酸碱指示剂变色1. 简介•酸碱指示剂是一种广泛应用于化学实验室和工业生产中的化学试剂。
•它能够通过颜色的变化来确定溶液的酸碱性质。
2. 原理•酸碱指示剂是由一种或多种指示剂组成的混合物,指示剂是一种具有特定酸碱变色性质的化合物。
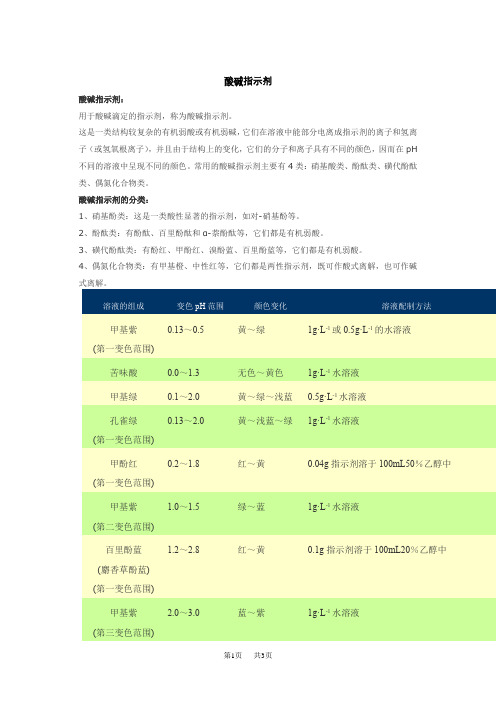
酸碱指示剂酸碱指示剂:用于酸碱滴定的指示剂,称为酸碱指示剂。
这是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。
常用的酸碱指示剂主要有4类:硝基酸类、酚酞类、磺代酚酞类、偶氮化合物类。
酸碱指示剂的分类:1、硝基酚类:这是一类酸性显著的指示剂,如对-硝基酚等。
2、酚酞类:有酚酞、百里酚酞和α-萘酚酞等,它们都是有机弱酸。
3、磺代酚酞类:有酚红、甲酚红、溴酚蓝、百里酚蓝等,它们都是有机弱酸。
4、偶氮化合物类:有甲基橙、中性红等,它们都是两性指示剂,既可作酸式离解,也可作碱式离解。
0.13~0.5黄~绿1g·L-1或0.5g·L-1的水溶液甲基紫(第一变色范围)苦味酸0.0~1.3无色~黄色1g·L-1水溶液甲基绿0.1~2.0黄~绿~浅蓝0.5g·L-1水溶液0.13~2.0黄~浅蓝~绿1g·L-1水溶液孔雀绿(第一变色范围)0.2~1.8红~黄0.04g指示剂溶于100mL50%乙醇中甲酚红(第一变色范围)1.0~1.5绿~蓝1g·L-1水溶液甲基紫(第二变色范围)1.2~2.8红~黄0.1g指示剂溶于100mL20%乙醇中百里酚蓝(麝香草酚蓝)(第一变色范围)2.0~3.0蓝~紫1g·L-1水溶液甲基紫(第三变色范围)1.9~3.3红~黄1g·L-1水溶液茜素黄R(第一变色范围)二甲基黄 2.9~4.0红~黄0.1g 或0.01g 指示剂溶于100mL90%乙醇中甲基橙 3.1~4.4红~橙黄1g·L-1水溶液溴酚蓝 3.0~4.6黄~蓝0.1g指示剂溶于100mL20%乙醇中刚果红 3.0~5.2蓝紫~红1g·L-1水溶液3.7~5.2黄~紫1g·L-1水溶液茜素红S(第一变色范围)溴甲酚绿 3.8~5.4黄~蓝0.1g指示剂溶于100mL20%乙醇中甲基红 4.4~6.2红~黄0.1g或0.2g指示剂溶于100mL60%乙醇中溴酚红 5.0~6.8黄~红0.1g或0.04g指示剂溶于100mL20%乙醇中溴甲酚紫 5.2~6.8黄~紫红0.1g指示剂溶于100mL20%乙醇中溴百里酚蓝 6.0~7.6黄~蓝0.05g指示剂溶于100mL20%乙醇中中性红 6.8~8.0红~亮黄0.1g指示剂溶于100mL60%乙醇中酚红 6.8~8.0黄~红0.1g指示剂溶于100mL20%乙醇中甲酚红7.2~8.8亮黄~紫红0.1g指示剂溶于100mL50%乙醇中8.0~9.0黄~蓝参看第一变色范围百里酚蓝(麝香草酚蓝)(第二变色范围)酚酞8.2~10.0无色~紫红(1)0.1g指示剂溶于100mL60%乙醇中(2)1g酚溶于100mL90%乙醇中百里酚酞9.4~10.6无色~蓝0.1g指示剂溶于100mL90%乙醇中10.0~12.0紫~淡黄参看第一变色范围茜素红S(第二变色范围)茜素黄R10.1~12.1黄~淡紫1g·L-1水溶液(第二变色范围)11.5~13.2蓝绿~无色参看第一变色范围孔雀绿(第二变色范围)达旦黄12.0~13.0黄~红1g·L-1水溶液。

常见指示剂的颜色变化原理指示剂是一种用于检测溶液酸碱性或其他化学性质的物质。
它们通常在化学实验、分析化学和其他领域中被广泛使用。
指示剂的颜色变化原理是基于它们与酸碱溶液中的氢离子或氢氧根离子发生化学反应,从而导致颜色的改变。
本文将介绍几种常见指示剂的颜色变化原理。
1. 酚酞指示剂酚酞是一种常用的指示剂,它在酸性溶液中呈现无色,而在碱性溶液中呈现粉红色。
这是因为酚酞分子在酸性溶液中处于酚酞酸的形式,而在碱性溶液中则处于酚酞碱的形式。
酚酞酸和酚酞碱的分子结构不同,导致它们吸收的光谱也不同,从而呈现出不同的颜色。
2. 甲基橙指示剂甲基橙是一种常用的指示剂,它在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
这是因为甲基橙分子在酸性溶液中处于甲基橙酸的形式,而在碱性溶液中则处于甲基橙碱的形式。
甲基橙酸和甲基橙碱的分子结构不同,导致它们吸收的光谱也不同,从而呈现出不同的颜色。
3. 酚酞指示剂溴酚蓝是一种常用的指示剂,它在酸性溶液中呈现黄色,而在碱性溶液中呈现蓝色。
这是因为溴酚蓝分子在酸性溶液中处于溴酚蓝酸的形式,而在碱性溶液中则处于溴酚蓝碱的形式。
溴酚蓝酸和溴酚蓝碱的分子结构不同,导致它们吸收的光谱也不同,从而呈现出不同的颜色。
4. 甲基红指示剂甲基红是一种常用的指示剂,它在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
这是因为甲基红分子在酸性溶液中处于甲基红酸的形式,而在碱性溶液中则处于甲基红碱的形式。
甲基红酸和甲基红碱的分子结构不同,导致它们吸收的光谱也不同,从而呈现出不同的颜色。
5. 酚酞指示剂酚酞是一种常用的指示剂,它在酸性溶液中呈现无色,而在碱性溶液中呈现粉红色。
这是因为酚酞分子在酸性溶液中处于酚酞酸的形式,而在碱性溶液中则处于酚酞碱的形式。
酚酞酸和酚酞碱的分子结构不同,导致它们吸收的光谱也不同,从而呈现出不同的颜色。
总结:常见指示剂的颜色变化原理是基于它们与酸碱溶液中的氢离子或氢氧根离子发生化学反应,从而导致颜色的改变。

三种常见酸碱指示剂性质及其变色原理酸碱指示剂的变色原理--- 专题简介原创:S OSO问问精益求精团队小虾编辑整理及扩充人们在实践中发现,有些有机燃料在不同的酸碱性溶液中能显示不同的颜色。
于是,人们就利用它们来确定溶液的pH。
这种借助其颜色变色来指示溶液pH的物质叫做酸碱指示剂。
石蕊酸碱指示剂一般是有机弱酸或有极弱碱。
它们的变色原理是由于其它分子和电离出来的离子的结构不同,因此分子和离子的颜色也不同。
在不同pH的溶液里,由于其分子浓度和离子浓度的比值不同,因此显示出来的颜色也不同。
例如,石蕊是一种有机弱酸,它是由地衣值得的一种蓝色色素。
如果用HIn 代表石蕊分子,HIn 在水中发生下列电离:HIn(红色[酸色])← =→H++In- (蓝色[碱色])(注:← =→代表可逆符号,下同)石蕊什么情况下变色?在酸性溶液里, 分子是其存在的主要形式, 使溶 液呈红色 ;(由于 [H+] 增大,平衡向左移) 在碱性溶液里,石蕊水解发生的电离平衡向 右移动,电离产生的酸根离子是其存在的主要形 式,故使溶液呈蓝色 ;(由于 [OH-] 增大,平衡右 移)在中性溶液里, 分子和酸根离子共存, 因而 溶液呈紫色。
( [HZ]=[Z-] )遇酸 变红 PH<5.0遇碱 变蓝 PH>8.0蓝紫色粉末。
是从植物中提取得到的蓝色色 素,能部分地溶解于水而显蓝色。
石蕊是一种常 用的指示剂, 变色范围是 pH5.0—8.0之间。
石蕊 起指示剂作用是由于石蕊中含石蕊精(C7H7O4N) 的原因。
其原理是石蕊也是一种弱酸在中性溶液中: [HZ]=[Z-]石蕊是什么物质 ?石蕊在酸性溶液中:由于[H+] 则大,平衡向左移,溶液呈红色。
在碱性溶液中:由于[OH-] 增大,平衡右移,则溶液呈蓝色。
[石蕊试液的配制] (1)先用热酒精溶解去除杂质,把酒精倾去。
(2)加水溶解石蕊,搅拌、静置、过滤。
(3)滤液稀释至1%即得石蕊试液。

酸碱指示剂的种类与颜色变化规律酸碱指示剂是一种在酸碱溶液中发生颜色变化的物质,它可以帮助我们判断溶液的酸碱性质。
酸碱指示剂种类繁多,不同种类的酸碱指示剂在不同的酸碱溶液中呈现出不同的颜色变化。
本文将为您介绍各种常见酸碱指示剂的种类以及它们的颜色变化规律。
一、酸碱指示剂的分类根据颜色变化规律和化学性质,酸碱指示剂可以分为以下几类:1. 酚酞类:如酚红、溴酚蓝等。
这类指示剂在酸性溶液中呈现红色,而在碱性溶液中则呈现黄色或无色。
2. 酮类:如甲基橙、溴酚绿等。
这类指示剂在酸性溶液中显现为橙色或红色,而在碱性溶液中呈现黄色或绿色。
3. 酞类:如酞菁、洋红素等。
这类指示剂在酸性溶液中呈现红色,而在碱性溶液中则变为蓝色或紫色。
4. 苯酚类:如苯酚红、苯酚蓝等。
这类指示剂在酸性溶液中为无色或淡黄色,而在碱性溶液中则显现为蓝色。
5. 酮酸类:如溴酸溴酯、溴酸紫等。
这类指示剂在碱性溶液中呈现黄色或红色,而在酸性溶液中变为紫色。
二、酸碱指示剂的颜色变化规律不同种类的酸碱指示剂在酸碱溶液中的颜色变化规律也各不相同。
下面将介绍一些常见指示剂的颜色变化规律:1. 酚酞类指示剂:酚红:在酸性溶液中呈现红色,而在碱性溶液中则由红色逐渐变为黄色。
溴酚蓝:在酸性溶液中呈现黄色,而在中性溶液中变为绿色,进一步在碱性溶液中变为蓝色。
2. 酮类指示剂:甲基橙:在酸性溶液中呈现红色,而在碱性溶液中变为黄色。
溴酚绿:在酸性溶液中呈现黄色,而在碱性溶液中变为绿色。
3. 酞类指示剂:酞菁:在酸性溶液中呈现红色,而在碱性溶液中则显现为蓝色。
洋红素:在酸性溶液中呈现红色,而在碱性溶液中变为紫色。
4. 苯酚类指示剂:苯酚红:在酸性溶液中为无色或淡黄色,而在碱性溶液中呈现红色。
苯酚蓝:在酸性溶液中为无色或淡黄色,而在碱性溶液中则呈现蓝色。
5. 酮酸类指示剂:溴酸溴酯:在碱性溶液中呈现黄色或红色,而在酸性溶液中变为紫色。
溴酸紫:在碱性溶液中呈现黄色或红色,而在酸性溶液中变为紫色。

酸碱指示剂的变色原理 ---专题简介之公保含烟创作原创:SOSO问问锦上添花团队.小虾编纂整理及扩年夜人们在实践中发现,有些有机燃料在分歧的酸碱性溶液中能显示分歧的颜色.于是,人们就应用它们来确定溶液的pH.这种借助其颜色变色来指示溶液pH的物质叫做酸碱指示剂.石蕊酸碱指示剂一般是有机弱酸或有极弱碱.它们的变色原理是由于其它分子和电离出来的离子的构造分歧,因此分子和离子的颜色也分歧.在分歧pH的溶液里,由于其分子浓度和离子浓度的比值分歧,因此显示出来的颜色也分歧.例如,石蕊是一种有机弱酸,它是由地衣值得的一种蓝色色素.如果用HIn代表石蕊分子,HIn在水中发作下列电离:HIn(白色[酸色])←=→H++In-(蓝色[碱色])(注:←=→代表可逆符号,下同)石蕊什么情况下变色?石蕊是什么物质?石蕊是什么物质?—8.0之间.石蕊起指示剂作用是由于石蕊中含石蕊精(C7H7O4N)的原因.其原理是石蕊也是一种弱酸在中性溶液中:[HZ]=[Z-]在酸性溶液中:由于[H+]则年夜,平衡向左移,溶液呈白色.在碱性溶液中:由于[OH-]增年夜,平衡右移,则溶液呈蓝色.[石蕊试液的配制] (1)先用热酒精溶解去除杂质,把酒精倾去.(2)加水溶解石蕊,搅拌、静置、过滤.(3)滤液稀释至1%即得石蕊试液.石蕊(shirei)(Cladonia)地衣门、石蕊科中的石蕊属.种类多.地衣体壳状至鳞片状,并从地衣体上长出空心的果柄,不分枝或具多分枝.子囊盘生果柄顶端,子囊盘网衣型,子囊孢子单胞型,无色,椭圆形.土生或生于腐木或岩石表土上.广布于全国各地石蕊在医药和化学试剂方面,有重要价值.有些种类可提取抗菌素,如雀石蕊、软石蕊、红头石蕊、粉杆红石蕊、粉杯红石蕊等;有些种类可提取石蕊试剂,如石蕊、鳞片石蕊、杯腋石蕊、喇叭石蕊等.酸性物质把试液变红.石蕊和酚酞都是酸碱指示剂,它们是一种弱的有机酸.在溶液里,随着溶液酸碱性的变卦,指示剂的分子构造发作变卦而显示出分歧的颜色.石蕊(主要成分用HL暗示)在水溶液里能发作如下电离:HL白色H+ L-蓝色在酸性溶液里,白色的分子是存在的主要形式,溶液显白色;在碱性溶液里,上述电离平衡向右移动,蓝色的离子是存在的主要形式,溶液显蓝色;在中性溶液里,白色的分子和蓝色的酸根离子同时存在,所以溶液显紫色.石蕊能溶于水,不溶于酒精,变色范围是pH 5.0~8.0.紫色石蕊试液和酚酞是溶液酸碱性的指示剂,其颜色是否变卦,取决于溶液的pH年夜小.我们通常说的pH<7的溶液使紫色石蕊变红,使无色酚酞不变色,只是一种粗略说法.其实紫色石蕊试液和酚酞有一定的变色范围,参看图.任何水溶液中都存在H+和OH-,pH的年夜小决取于溶液H+浓度和OH-浓度的关系.H+浓度=OH-浓度pH=7 溶液呈中性H+浓度>OH-浓度pH<7溶液呈酸性H+浓度<OH-浓度pH>7溶液呈碱性在酸溶液中,H+浓度>OH-浓度,故pH<7,但pH<7的溶液纷歧定是酸溶液,某些盐溶于水后,使得溶液呈酸性,如KHSO4溶于水,会发作以下电离:在KHSO4溶液中,存在少量的H+,pH<7.故应该说“能使紫色石蕊试液变红的溶液一定是酸性溶液”.“不使酚酞试液变色的溶液能够是酸性溶液,也能够是中性溶液或弱碱性溶液.”也能够是中性溶液或弱碱性溶液”.“紫色石蕊试纸”和“白色石蕊试纸”究竟有什么区别?石蕊试纸有三种:白色石蕊试纸(检验碱性),蓝色石蕊试纸(检验酸性)、中性石蕊试纸.常常使用的是前两种,中性石蕊试纸不常常使用. 浸制办法是用滤纸在石蕊液中浸制、凉干、枯燥、封存,备用. 用石蕊原液(蓝紫色)浸制成蓝色石蕊试纸,用白色石蕊试液浸制成白色石蕊试纸,用紫色石蕊试液浸制成中性石蕊试纸.紫色石蕊小花当然要用紫色石蕊试液浸制.然则,由于H2CO3只存在于水溶液中,所以用于浸制白色石蕊试纸和浸染紫色石蕊小花的石蕊液,只能用极稀的H3PO4与石蕊原液来调制.取滤纸条浸入石蕊指示液中,加极少量的盐酸使成白色,取出,枯燥,即得.谁知道紫色石蕊试剂怎么配制?准备:①在250mL烧杯中注入150mL左右的蒸馏水,参加半药匙石蕊粉末,微热至50℃~60℃,搅动减速溶解成深蓝紫色石蕊溶液(原液),备用.②试管里注入1P2体积的蒸馏水,通入CO2制成饱和CO2水溶液(H2CO3),备用. 紫色石蕊液配制:在不竭振荡的条件下,在蓝紫色石蕊原液中逐滴参加饱和CO2水溶液,直至溶液由蓝紫色酿成纯粹的紫色(拜会初三化学下册48页图1021的石蕊试液的色泽),即成.分配紫色石蕊液,还可以用极稀的H3PO4来替代饱和CO2水溶液(但不要用H2SO4、HCl等强酸);如果H3PO4稍过量则会调制成白色石蕊试液.酚酞是一种酸碱指示剂酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式构造,当8.2醌式构造. 酚酞的变色范围是8.2~10.0,所以酚酞只能检验碱而不能检验酸.(浅白色)(白色)碱性物质的专用指示剂酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式构造,当pH>8.2时为白色的醌式构造. 如何配什么是酚酞别名:非诺夫他林三维构造化学式:C20H14O4 酚酞(Phenolphthalein):本品为3,3-双(4-羟基苯基)-1(3H)-异苯并呋喃酮(3,3-Bis(4-hydroxyphenyl)-1(3H)-isobenzofuranone),白色或微黄色的结晶或粉末,无臭,无味.分子式:C20H14O4 ,CAS号:77-09-8.熔点:260℃~263℃,在乙醇中溶解,在乙醚中略溶,在水中简直不溶.由邻苯二甲酸酐和苯酚在参加脱水剂的条件下加热至115-120℃停止缩合制得. [编纂本段]化学用途是一种酸碱指示剂酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式构造,当8.2醌式构造. 酚酞的变色范围是8.2~10.0,所以酚酞只能检验碱而不能检验酸. (浅白色)(白色)酸碱指示剂酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式构造,当pH>8.2时为白色的醌式构造. 酚酞的醌式或醌式酸盐,在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐式;遇到较浓的碱液,会立刻转酿成无色的羧酸盐式.所以,酚酞试剂滴入浓碱液时,酚酞开端变红,很快白色退去酿成无色. 酚酞为白色或微带黄色的细小晶体,难溶于水而易溶于酒精.因此通常把酚酞配制成酒精溶液使用.当酚酞试剂滴入水或中性、酸性的水溶液时,会呈现白色混浊物,这是由于酒精易溶于水,使试剂中难溶于水的酚酞析出的缘故. 酚酞的用途主要有:(1)制药工业医药原料:适用于习惯性顽固便秘,有片剂、栓剂等多种剂型;(2)用于有机分解:主要用于分解塑料,特别是分解二氮杂萘酮聚芳醚酮聚芳醚酮类聚合物,该类聚合物由于具有优良的耐热性、耐水性、耐化学腐蚀性、耐热老化性和良好的加工成型性,由其制成的纤维、涂料及复合资料等很快被普遍应用于电子电器、机械设备、交通运输、宇航、原子能工程和军事等范畴;(3)用于酸碱指示剂,非水溶液滴定用指示剂,色层剖析用试剂. 酚酞溶液的配制0.5g酚酞粉末参加80%乙醇直至100ml.甲基橙0.1%的水溶液是常常使用的酸碱指示剂,pH值变色范围3.1(红)-4.4(黄),测定少数矿酸、强碱和水的碱度.容量测定锡(热时Sn2+(2+上标)使甲基橙褪色).强复原剂(Ti3+(3+上标)、Cr2+(2+上标)和强氧化剂(氯、溴)的消色指示剂.分光光度测定氯、溴和溴离子.可与靛蓝二磺酸钠或溴甲酚绿组成混合指示剂,以缩短变色域和提高变色的锐灵性.氧化复原指示剂,如用于溴酸钾滴定三价砷或锑.甲基橙在什么情况下变黄色甲基橙在什么情况下变黄色甲基橙试剂的用途酸碱指示剂,pH值变色范围3.1(红)-4.4(黄),测定少数矿酸、强碱和水的碱度.容量测定锡(热时Sn2+(2+上标)使甲基橙褪色).强复原剂(Ti3+(3+上标)、Cr2+(2+上标)和强氧化剂(氯、溴)的消色指示剂.分光光度测定氯、溴和溴离子.可与靛蓝二磺酸钠或溴甲酚绿组成混合指示剂,以缩短变色域和提高变色的锐灵性.氧化复原指示剂,如用于溴酸钾滴定三价砷或锑.。
酸碱指示剂的变色原理 ---专题简介之马矢奏春创作创作时间:二零二一年六月三十日原创:SOSO问问精益求精团队.小虾编纂整理及扩充人们在实践中发现, 有些有机燃料在分歧的酸碱性溶液中能显示分歧的颜色.于是, 人们就利用它们来确定溶液的pH.这种借助其颜色变色来指示溶液pH的物质叫做酸碱指示剂.石蕊酸碱指示剂一般是有机弱酸或有极弱碱.它们的变色原理是由于其它分子和电离出来的离子的结构分歧, 因此分子和离子的颜色也分歧.在分歧pH的溶液里, 由于其分子浓度和离子浓度的比值分歧, 因此显示出来的颜色也分歧.例如, 石蕊是一种有机弱酸, 它是由地衣值得的一种蓝色色素.如果用HIn代表石蕊分子, HIn在水中发生下列电离:HIn(红色[酸色])←=→H++In-(蓝色[碱色])(注:←=→代表可逆符号, 下同)石蕊什么情况下变色?石蕊是什么物质?石蕊是什么物质?—8.0之间.石蕊起指示剂作用是由于石蕊中含石蕊精(C7H7O4N)的原因.其原理是石蕊也是一种弱酸在中性溶液中:[HZ]=[Z-]在酸性溶液中:由于[H+]则年夜, 平衡向左移, 溶液呈红色.在碱性溶液中:由于[OH-]增年夜, 平衡右移, 则溶液呈蓝色.[石蕊试液的配制] (1)先用热酒精溶解去除杂质, 把酒精倾去.(2)加水溶解石蕊, 搅拌、静置、过滤.(3)滤液稀释至1%即得石蕊试液.石蕊(shirei)(Cladonia)地衣门、石蕊科中的石蕊属.种类多.地衣体壳状至鳞片状, 并从地衣体上长出空心的果柄, 不分枝或具多分枝.子囊盘生果柄顶端, 子囊盘网衣型, 子囊胞子单胞型, 无色, 椭圆形.土生或生于腐木或岩石表土上.广布于全国各地石蕊在医药和化学试剂方面, 有重要价值.有些种类可提取抗菌素, 如雀石蕊、软石蕊、红头石蕊、粉杆红石蕊、粉杯红石蕊等;有些种类可提取石蕊试剂, 如石蕊、鳞片石蕊、杯腋石蕊、喇叭石蕊等.酸性物质把试液变红.石蕊和酚酞都是酸碱指示剂, 它们是一种弱的有机酸.在溶液里, 随着溶液酸碱性的变动, 指示剂的分子结构发生变动而显示出分歧的颜色.石蕊(主要成份用HL 暗示)在水溶液里能发生如下电离: HL红色 H+ L-蓝色在酸性溶液里, 红色的分子是存在的主要形式, 溶液显红色;在碱性溶液里, 上述电离平衡向右移动, 蓝色的离子是存在的主要形式, 溶液显蓝色;在中性溶液里, 红色的分子和蓝色的酸根离子同时存在, 所以溶液显紫色.石蕊能溶于水, 不溶于酒精, 变色范围是pH 5.0~8.0.紫色石蕊试液和酚酞是溶液酸碱性的指示剂, 其颜色是否变动, 取决于溶液的pH年夜小.我们通常说的pH<7的溶液使紫色石蕊变红, 使无色酚酞不变色, 只是一种粗略说法.其实紫色石蕊试液和酚酞有一定的变色范围, 参看图.任何水溶液中都存在H+和OH-, pH的年夜小决取于溶液H+浓度和OH-浓度的关系.H+浓度=OH-浓度 pH=7 溶液呈中性H+浓度>OH-浓度 pH<7溶液呈酸性H+浓度<OH-浓度 pH>7溶液呈碱性在酸溶液中, H+浓度>OH-浓度, 故pH<7, 但pH<7的溶液纷歧定是酸溶液, 某些盐溶于水后, 使得溶液呈酸性, 如KHSO4溶于水, 会发生以下电离:在KHSO4溶液中, 存在年夜量的H+, pH<7.故应该说“能使紫色石蕊试液变红的溶液一定是酸性溶液”.“不使酚酞试液变色的溶液可能是酸性溶液, 也可能是中性溶液或弱碱性溶液.”也可能是中性溶液或弱碱性溶液”.“紫色石蕊试纸”和“红色石蕊试纸”究竟有什么区别?石蕊试纸有三种:红色石蕊试纸(检验碱性), 蓝色石蕊试纸(检验酸性)、中性石蕊试纸.经常使用的是前两种, 中性石蕊试纸不经常使用. 浸制方法是用滤纸在石蕊液中浸制、凉干、干燥、封存, 备用. 用石蕊原液(蓝紫色)浸制成蓝色石蕊试纸, 用红色石蕊试液浸制成红色石蕊试纸, 用紫色石蕊试液浸制成中性石蕊试纸.紫色石蕊小花固然要用紫色石蕊试液浸制.可是, 由于H2CO3只存在于水溶液中, 所以用于浸制红色石蕊试纸和浸染紫色石蕊小花的石蕊液, 只能用极稀的H3PO4与石蕊原液来调制.取滤纸条浸入石蕊指示液中, 加极少量的盐酸使成红色, 取出, 干燥, 即得.谁知道紫色石蕊试剂怎么配制?准备:①在250mL烧杯中注入150mL左右的蒸馏水, 加入半药匙石蕊粉末, 微热至50℃~60℃, 搅动加速溶解成深蓝紫色石蕊溶液(原液), 备用.②试管里注入1P2体积的蒸馏水, 通入CO2制成饱和CO2水溶液(H2CO3), 备用. 紫色石蕊液配制:在不竭振荡的条件下, 在蓝紫色石蕊原液中逐滴加入饱和CO2水溶液, 直至溶液由蓝紫色酿成纯粹的紫色(拜会初三化学下册48页图1021的石蕊试液的色泽), 即成.调配紫色石蕊液, 还可以用极稀的H3PO4来取代饱和CO2水溶液(但不要用H2SO4、HCl等强酸);如果H3PO4稍过量则会调制成红色石蕊试液.酚酞是一种酸碱指示剂酚酞是一种弱有机酸, 在pH<8.2的溶液里为无色的内酯式结构, 当8.2醌式结构. 酚酞的变色范围是8.2~10.0, 所以酚酞只能检验碱而不能检验酸.(浅红色)(红色)碱性物质的专用指示剂酚酞是一种弱有机酸, 在pH<8.2的溶液里为无色的内酯式结构, 当pH>8.2时为红色的醌式结构. 如何配什么是酚酞别名:非诺夫他林三维结构化学式:C20H14O4 酚酞(Phenolphthalein):本品为3, 3-双(4-羟基苯基)-1(3H)-异苯并呋喃酮(3,3-Bis(4-hydroxyphenyl)-1(3H)-isobenzofuranone), 白色或微黄色的结晶或粉末, 无臭,无味.分子式:C20H14O4 , CAS号:77-09-8.熔点:260℃~263℃, 在乙醇中溶解, 在乙醚中略溶, 在水中几乎不溶.由邻苯二甲酸酐和苯酚在加入脱水剂的条件下加热至115-120℃进行缩合制得. [编纂本段]化学用途是一种酸碱指示剂酚酞是一种弱有机酸, 在pH<8.2的溶液里为无色的内酯式结构, 当8.2醌式结构.酚酞的变色范围是8.2~10.0, 所以酚酞只能检验碱而不能检验酸. (浅红色)(红色)酸碱指示剂酚酞是一种弱有机酸, 在pH<8.2的溶液里为无色的内酯式结构, 当pH>8.2时为红色的醌式结构. 酚酞的醌式或醌式酸盐, 在碱性介质中很不稳定, 它会慢慢地转化成无色羧酸盐式;遇到较浓的碱液, 会立即转酿成无色的羧酸盐式.所以, 酚酞试剂滴入浓碱液时, 酚酞开始变红, 很快红色退去酿成无色. 酚酞为白色或微带黄色的细小晶体, 难溶于水而易溶于酒精.因此通常把酚酞配制成酒精溶液使用.当酚酞试剂滴入水或中性、酸性的水溶液时, 会呈现白色浑浊物, 这是由于酒精易溶于水, 使试剂中难溶于水的酚酞析出的缘故. 酚酞的用途主要有:(1)制药工业医药原料:适用于习惯性顽固便秘, 有片剂、栓剂等多种剂型;(2)用于有机合成:主要用于合成塑料, 特别是合成二氮杂萘酮聚芳醚酮聚芳醚酮类聚合物, 该类聚合物由于具有优良的耐热性、耐水性、耐化学腐蚀性、耐热老化性和良好的加工成型性,由其制成的纤维、涂料及复合资料等很快被广泛应用于电子电器、机械设备、交通运输、宇航、原子能工程和军事等领域;(3)用于酸碱指示剂, 非水溶液滴定用指示剂, 色层分析用试剂. 酚酞溶液的配制0.5g酚酞粉末加入80%乙醇直至100ml.甲基橙0.1%的水溶液是经常使用的酸碱指示剂, pH值变色范围3.1(红)-4.4(黄), 测定大都矿酸、强碱和水的碱度.容量测定锡(热时Sn2+(2+上标)使甲基橙褪色).强还原剂(Ti3+(3+上标)、Cr2+(2+上标)和强氧化剂(氯、溴)的消色指示剂.分光光度测定氯、溴和溴离子.可与靛蓝二磺酸钠或溴甲酚绿组成混合指示剂, 以缩短变色域和提高变色的锐灵性.氧化还原指示剂, 如用于溴酸钾滴定三价砷或锑.甲基橙在什么情况下变黄色甲基橙在什么情况下变黄色甲基橙试剂的用途酸碱指示剂, pH值变色范围3.1(红)-4.4(黄), 测定大都矿酸、强碱和水的碱度.容量测定锡(热时Sn2+(2+上标)使甲基橙褪色).强还原剂(Ti3+(3+上标)、Cr2+(2+上标)和强氧化剂(氯、溴)的消色指示剂.分光光度测定氯、溴和溴离子.可与靛蓝二磺酸钠或溴甲酚绿组成混合指示剂, 以缩短变色域和提高变色的锐灵性.氧化还原指示剂, 如用于溴酸钾滴定三价砷或锑.。
三种常见酸碱指示剂性质及其变色原理酸碱指示剂的变色原理--- 专题简介原创:S OSO问问精益求精团队小虾编辑整理及扩充人们在实践中发现,有些有机燃料在不同的酸碱性溶液中能显示不同的颜色。
于是,人们就利用它们来确定溶液的pH。
这种借助其颜色变色来指示溶液pH的物质叫做酸碱指示剂。
石蕊酸碱指示剂一般是有机弱酸或有极弱碱。
它们的变色原理是由于其它分子和电离出来的离子的结构不同,因此分子和离子的颜色也不同。
在不同pH的溶液里,由于其分子浓度和离子浓度的比值不同,因此显示出来的颜色也不同。
例如,石蕊是一种有机弱酸,它是由地衣值得的一种蓝色色素。
如果用HIn 代表石蕊分子,HIn 在水中发生下列电离:HIn(红色[酸色])← =→H++In- (蓝色[碱色])(注:← =→代表可逆符号,下同)石蕊什么情况下变色?在酸性溶液里, 分子是其存在的主要形式, 使溶 液呈红色 ;(由于 [H+] 增大,平衡向左移) 在碱性溶液里,石蕊水解发生的电离平衡向 右移动,电离产生的酸根离子是其存在的主要形 式,故使溶液呈蓝色 ;(由于 [OH-] 增大,平衡右 移)在中性溶液里, 分子和酸根离子共存, 因而 溶液呈紫色。
( [HZ]=[Z-] )遇酸 变红 PH<5.0遇碱 变蓝 PH>8.0蓝紫色粉末。
是从植物中提取得到的蓝色色 素,能部分地溶解于水而显蓝色。
石蕊是一种常 用的指示剂, 变色范围是 pH5.0—8.0之间。
石蕊 起指示剂作用是由于石蕊中含石蕊精(C7H7O4N) 的原因。
其原理是石蕊也是一种弱酸在中性溶液中: [HZ]=[Z-]石蕊是什么物质 ?石蕊在酸性溶液中:由于[H+] 则大,平衡向左移,溶液呈红色。
在碱性溶液中:由于[OH-] 增大,平衡右移,则溶液呈蓝色。
[石蕊试液的配制] (1)先用热酒精溶解去除杂质,把酒精倾去。
(2)加水溶解石蕊,搅拌、静置、过滤。
(3)滤液稀释至1%即得石蕊试液。
酸碱指示剂的变色原理 ---专题简介之相礼和热创作原创:SOSO问问精益求精团队.小虾编辑整理及扩充人们在理论中发现,有些无机燃料在分歧的酸碱性溶液中能表现分歧的颜色.于是,人们就利用它们来确定溶液的pH.这种借助其颜色变色来指示溶液pH的物质叫做酸碱指示剂.石蕊酸碱指示剂一样平常是无机弱酸或有极弱碱.它们的变色原理是由于别的分子和电离出来的离子的结构分歧,因而分子和离子的颜色也分歧.在分歧pH的溶液里,由于其分子浓度和离子浓度的比值分歧,因而表现出来的颜色也分歧.例如,石蕊是一种无机弱酸,它是由地衣值得的一种蓝色色素.假如用HIn代表石蕊分子,HIn在水中发生下列电离:HIn(红色[酸色])←=→H++In-(蓝色[碱色])(注:←=→代表可逆符号,下同)石蕊什么状况下变色?石蕊是什么物质?石蕊是什么物质?—8.0之间.石蕊起指示剂作用是由于石蕊中含石蕊精(C7H7O4N)的缘故原由.其原理是石蕊也是一种弱酸在中性溶液中:[HZ]=[Z-]在酸性溶液中:由于[H+]则大,均衡向左移,溶液呈红色.在碱性溶液中:由于[OH-]增大,均衡右移,则溶液呈蓝色.[石蕊试液的配制] (1)先用热酒精溶解往除杂质,把酒精倾往.(2)加水溶解石蕊,搅拌、静置、过滤.(3)滤液浓缩至1%即得石蕊试液.石蕊(shirei)(Cladonia)地衣门、石蕊科中的石蕊属.品种多.地衣体壳状至鳞片状,并从地衣体上长出空心的果柄,不分枝或具多分枝.子囊盘生果柄顶端,子囊盘网衣型,子囊孢子单胞型,无色,椭圆形.土生或生于腐木或岩石表土上.广布于天下各地石蕊在医药和化学试剂方面,有紧张价值.有些品种可提取抗菌素,如雀石蕊、软石蕊、红头石蕊、粉杆红石蕊、粉杯红石蕊等;有些品种可提取石蕊试剂,如石蕊、鳞片石蕊、杯腋石蕊、喇叭石蕊等.酸性物质把试液变红.石蕊和酚酞都是酸碱指示剂,它们是一种弱的无机酸.在溶液里,随着溶液酸碱性的变更,指示剂的分子结构发生变更而表现出分歧的颜色.石蕊(次要成分用HL暗示)在水溶液里能发生如下电离: HL红色 H+ L-蓝色在酸性溶液里,红色的分子是存在的次要方式,溶液显红色;在碱性溶液里,上述电离均衡向右挪动,蓝色的离子是存在的次要方式,溶液显蓝色;在中性溶液里,红色的分子和蓝色的酸根离子同时存在,以是溶液显紫色.石蕊能溶于水,不溶于酒精,变色范围是pH 5.0~8.0.紫色石蕊试液和酚酞是溶液酸碱性的指示剂,其颜色能否变更,取决于溶液的pH大小.我们通常说的pH<7的溶液使紫色石蕊变红,使无色酚酞不变色,只是一种粗略说法.其实紫色石蕊试液和酚酞有肯定的变色范围,参看图.任何水溶液中都存在H+和OH-,pH的大小决取于溶液H+浓度和OH-浓度的关系.H+浓度=OH-浓度pH=7 溶液呈中性H+浓度>OH-浓度pH<7溶液呈酸性H+浓度<OH-浓度pH>7溶液呈碱性在酸溶液中,H+浓度>OH-浓度,故pH<7,但pH<7的溶液纷歧定是酸溶液,某些盐溶于水后,使得溶液呈酸性,如KHSO4溶于水,会发生以下电离:在KHSO4溶液中,存在大量的H+,pH<7.故应该说“能使紫色石蕊试液变红的溶液肯定是酸性溶液”.“不使酚酞试液变色的溶液可能是酸性溶液,也可能是中性溶液或弱碱性溶液.”也可能是中性溶液或弱碱性溶液”.“紫色石蕊试纸”和“红色石蕊试纸”到底有什么区别?石蕊试纸有三种:红色石蕊试纸(检验碱性),蓝色石蕊试纸(检验酸性)、中性石蕊试纸.经常运用的是前两种,中性石蕊试纸不经常运用.浸制方法是用滤纸在石蕊液中浸制、凉干、干燥、封存,备用.用石蕊原液(蓝紫色)浸制成蓝色石蕊试纸,用红色石蕊试液浸制成红色石蕊试纸,用紫色石蕊试液浸制成中性石蕊试纸.紫色石蕊小花当然要用紫色石蕊试液浸制.但是,由于H2CO3只存在于水溶液中,以是用于浸制红色石蕊试纸和浸染紫色石蕊小花的石蕊液,只能用极稀的H3PO4与石蕊原液来调制.取滤纸条浸入石蕊指示液中,加极大批的盐酸使成红色,取出,干燥,即得.谁晓得紫色石蕊试剂怎样配制?预备:①在250mL烧杯中注入150mL左右的蒸馏水,加入半药匙石蕊粉末,微热至50℃~60℃,搅动加速溶解成深蓝紫色石蕊溶液(原液),备用.②试管里注入1P2体积的蒸馏水,通入CO2制成饱和CO2水溶液(H2CO3),备用.紫色石蕊液配制:在不竭振荡的条件下,在蓝紫色石蕊原液中逐滴加入饱和CO2水溶液,直至溶液由蓝紫色酿成纯正的紫色(拜见初三化学下册48页图1021的石蕊试液的色泽),即成.调配紫色石蕊液,还可以用极稀的H3PO4来代替饱和CO2水溶液(但不要用H2SO4、HCl 等强酸);假如H3PO4稍过量则会调制成红色石蕊试液.酚酞是一种酸碱指示剂酚酞是一种弱无机酸,在pH<8.2的溶液里为无色的内酯式结构,当8.2醌式结构.酚酞的变色范围是8.2~10.0,以是酚酞只能检验碱而不克不及检验酸.(浅红色)(红色)碱性物质的公用指示剂酚酞是一种弱无机酸,在pH<8.2的溶液里为无色的内酯式结构,当pH>8.2时为红色的醌式结构. 怎样配什么是酚酞别号:非诺夫他林三维结构化学式:C20H14O4酚酞(Phenolphthalein):本品为3,3-双(4-羟基苯基)-1(3H)-异苯并呋喃酮(3,3-Bis(4-hydroxyphenyl)-1(3H)-isobenzofuranone),白色或微黄色的结晶或粉末,无臭,无味.分子式:C20H14O4 ,CAS号:77-09-8.熔点:260℃~263℃,在乙醇中溶解,在乙醚中略溶,在水中几乎不溶.由邻苯二甲酸酐和苯酚在加入脱水剂的条件下加热至115-120℃进行缩合制得. [编辑本段]化学用处是一种酸碱指示剂酚酞是一种弱无机酸,在pH<8.2的溶液里为无色的内酯式结构,当8.2醌式结构.酚酞的变色范围是8.2~10.0,以是酚酞只能检验碱而不克不及检验酸.(浅红色)(红色)酸碱指示剂酚酞是一种弱无机酸,在pH<8.2的溶液里为无色的内酯式结构,当pH >8.2时为红色的醌式结构. 酚酞的醌式或醌式酸盐,在碱性介质中很不波动,它会渐渐地转化成无色羧酸盐式;遇到较浓的碱液,会马上转酿成无色的羧酸盐式.以是,酚酞试剂滴入浓碱液时,酚酞开始变红,很快红色退往酿成无色.酚酞为白色或微带黄色的微小晶体,难溶于水而易溶于酒精.因而通常把酚酞配制成酒精溶液运用.当酚酞试剂滴入水或中性、酸性的水溶液时,会出现白色浑浊物,这是由于酒精易溶于水,使试剂中难溶于水的酚酞析出的缘故.酚酞的用处次要有:(1)制药工业医药质料:适用于风俗性顽固便秘,有片剂、栓剂等多种剂型;(2)用于无机合成:次要用于合成塑料,特别是合成二氮杂萘酮聚芳醚酮聚芳醚酮类聚合物,该类聚合物由于具有精良的耐热性、耐水性、耐化学腐蚀性、耐热老化性和良好的加工成型性,由其制成的纤维、涂料及复合材料等很快被广泛运用于电子电器、机械设备、交通运输、宇航、原子能工程和军事等领域;(3)用于酸碱指示剂,非水溶液滴定用指示剂,色层分析用试剂. 酚酞溶液的配制0.5g酚酞粉末加入80%乙醇直至100ml.甲基橙0.1%的水溶液是经常运用的酸碱指示剂,pH值变色范围3.1(红)-4.4(黄),测定多数矿酸、强碱和水的碱度.容量测定锡(热时Sn2+(2+上标)使甲基橙褪色).强还原剂(Ti3+(3+上标)、Cr2+(2+上标)和强氧化剂(氯、溴)的消色指示剂.分光光度测定氯、溴和溴离子.可与靛蓝二磺酸钠或溴甲酚绿组成混合指示剂,以延长变色域和进步变色的锐灵性.氧化还原指示剂,如用于溴酸钾滴定三价砷或锑.甲基橙在什么状况下变黄色甲基橙在什么状况下变黄色甲基橙试剂的用处酸碱指示剂,pH值变色范围3.1(红)-4.4(黄),测定多数矿酸、强碱和水的碱度.容量测定锡(热时Sn2+(2+上标)使甲基橙褪色).强还原剂(Ti3+(3+上标)、Cr2+(2+上标)和强氧化剂(氯、溴)的消色指示剂.分光光度测定氯、溴和溴离子.可与靛蓝二磺酸钠或溴甲酚绿组成混合指示剂,以延长变色域和进步变色的锐灵性.氧化还原指示剂,如用于溴酸钾滴定三价砷或锑.。
酸碱指示剂原理酸碱指示剂是一种可以根据其颜色在酸性、中性或碱性溶液中发生变化的化学物质。
这种化学物质在化学实验和工业生产中被广泛使用,可以帮助人们快速准确地判断溶液的酸碱性质。
酸碱指示剂的原理是基于它们在不同pH值下颜色的变化,主要应用于酸碱滴定、溶液中酸碱度的检测和化学试剂的选择等方面。
通过酸碱指示剂的使用,我们可以更好地了解溶液的性质,从而在化学实验和工业生产中更好地控制和调节pH值。
酸碱指示剂的原理主要是通过分子内酸碱指示基团的变化来实现的。
这些指示基团在不同pH条件下会发生质子化或去质子化,致使分子整体的电荷发生变化。
当酸碱指示剂处于酸性条件下时,指示基团会接受质子,使得分子带正电荷;而在碱性条件下,指示基团会失去质子,使得分子带负电荷。
这种电荷的变化会导致分子结构的改变,从而引起颜色的变化。
酸碱指示剂的颜色变化是由于分子结构的改变导致的吸收光谱的变化。
在酸性条件下,酸碱指示剂分子带正电荷,与溶液中的负离子发生作用,从而产生某种颜色的吸收峰;而在碱性条件下,酸碱指示剂分子带负电荷,与溶液中的阳离子发生作用,导致吸收光谱向不同波长偏移,表现为另一种颜色的吸收峰。
因此,通过测量酸碱指示剂在不同pH条件下的吸收光谱,我们可以判断其颜色变化的原因,从而确定溶液的酸碱性质。
酸碱指示剂的应用十分广泛,不仅可以用于酸碱滴定实验中,还可以用于医疗、环境监测、食品安全等领域。
在酸碱滴定实验中,通过向待测溶液中加入少量的酸碱指示剂,在滴定过程中观察其颜色的变化,可以确定滴定终点,从而计算出待测溶液的浓度。
在医疗领域,酸碱指示剂可以用于检测尿液、血液等生物体液的酸碱平衡,帮助医生诊断疾病。
在环境监测中,酸碱指示剂可以用于检测大气中二氧化碳等有害气体的浓度,为环境保护提供数据支持。
在食品安全领域,酸碱指示剂可以用于检测食品中添加剂的酸碱度,确保食品的安全性。
除了在实验和工业生产中的应用外,酸碱指示剂还可以用于探索更多深层次的化学原理。