第4讲.物质结构与化学键(目)
- 格式:doc
- 大小:2.28 MB
- 文档页数:16


制作人:绍飞校对人:李慧限时:35分钟总分:66分第4讲化学键学习目标:1.会判断离子键、共价键、离子化合物、共价化合物2.知道分子间作用力、氢键对物理性质的影响【例题】(选择6分,简答、判断2分)例1、判断正误(正确的打“√”,错误的打“×”)(1)形成离子键的阴、阳离子间只存在静电吸引力()(2)某些金属与非金属原子间能形成共价键()(3)某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键()(4)所有物质中都存在化学键()例2、下列每组中各物质内既有离子键又有共价键的一组是()A.NaOH、H2SO4、(NH4)2SO4B.MgO、Na2SO4、NH4HCO3C.Na2O2、KOH、Na2SO4D.HCl、Al2O3、MgCl2例3、短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。
下列化合物中同时存在极性和非极性共价键的是()A.Z2Y B.X2Y2C.Z2Y2D.ZYX例4、下列有关说法正确的是()A.该组化合物中只含有共价键:H2O、NH4Cl、H2O2 B.非金属原子间以共价键结合的物质都是共价化合物C.Na2O、NaOH和Na2SO4为离子化合物,HCl、NH3、NH4NO3、H2SO4为共价化合物D.共价化合物可以由不同种非金属原子间或金属与非金属原子间通过共用电子对形成【归纳总结】(阅读教材完成下列内容)一、化学键1、概念:使离子相结合或原子相结合的作用力。
2、分类:二、离子化合物、共价化合物的判断1、离子化合物:(1)概念:由离子键构成的化合物。
(2)判断方法:例5、下列关于化合物的说法正确的是( ) A .只含有共价键的物质一定是共价化合物B .由两种原子组成的纯净物一定是化合物 C .共价化合物熔化时破坏共价键D .熔化状态下不导电的化合物一定是共价化合物例6、判断正误:F 2、Cl 2、Br 2、I 2的熔沸点逐渐升高,是因为分子间作用力越来越大( )例7、下图中每条折线表示元素周期表中第ⅣA ~ⅦA 族中的某一族元素氢化物的沸点变化。

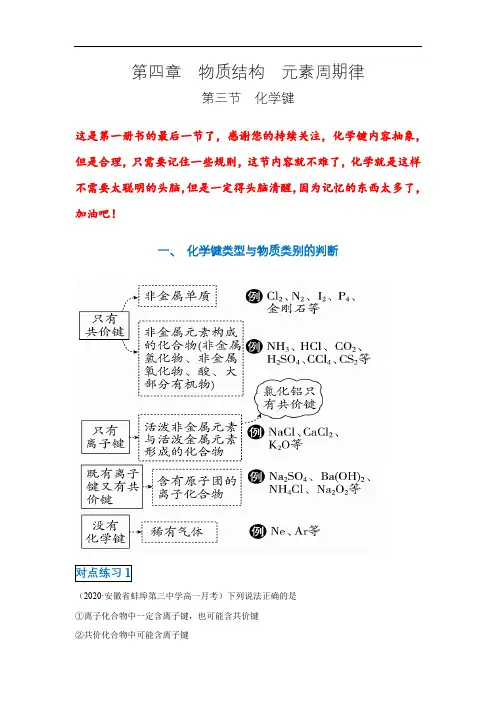
第四章物质结构元素周期律第三节化学键这是第一册书的最后一节了,感谢您的持续关注,化学键内容抽象,但是合理,只需要记住一些规则,这节内容就不难了,化学就是这样不需要太聪明的头脑,但是一定得头脑清醒,因为记忆的东西太多了,加油吧!一、化学键类型与物质类别的判断(2020·安徽省蚌埠第三中学高一月考)下列说法正确的是①离子化合物中一定含离子键,也可能含共价键②共价化合物中可能含离子键③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤构成单质分子的粒子不一定存在共价键⑥不同元素组成的多原子分子里的化学键一定只有极性键 ⑦有化学键断裂的变化属于化学变化 A .①③⑤⑥ B .②④⑥C .①③⑤D .③⑤⑦【答案】C 【详解】①离子化合物中一定含离子键,也可能含共价键,如NaOH 、Na 2O 2中含有离子键和共价键,①正确;②含有离子键的一定是离子化合物,所以共价化合物中只含共价键,不可能含离子键,②错误;③含金属元素的化合物不一定是离子化合物,如氯化铝为共价化合物,③正确; ④由非金属元素组成的化合物不一定是共价化合物,如铵盐为离子化合物,④错误; ⑤构成单质分子的粒子不一定存在共价键,如稀有气体中不含化学键,⑤正确;⑥不同元素组成的多原子分子里的化学键,若为同种元素之间形成的是非极性共价键,不同元素之间形成的是极性共价键,如H 2O 2中两个氧原子之间为非极性共价键,氢原子和氧原子之间为极性共价键,⑥错误;⑦有旧化学键断裂和新化学键的生成的变化属于化学变化,只有有化学键断裂的变化不一定属于化学变化,也可能属于物理变化,如氯化钠溶于水有离子键的断裂但属于物理变化,⑦错误;综上所述,正确的是①③⑤,答案选C 。
二、电子式书写的常见错误(1)漏写孤电子对。
如将N 2的电子式误写成N ⋮⋮N ,正确的应为··N ⋮⋮N ··。



高一化学必修一第四章第三节化学键【考纲要求】1.了解化学键、离子键、共价键的定义。
2.了解离子键、共价键的形成;理解化学反应的本质。
3.了解分子间作用力与氢键。
4.学会用电子式表示常见的物质及形成过程。
【考点梳理】考点一:化学键1.定义:使离子或原子相结合的强烈的相互作用力称为化学键。
化学键包括离子键、共价键等。
2.离子键与共价键的比较键型离子键共价键概念带相反电荷离子之间的相互作用原子之间通过共用电子对所形成的相互作用成键方式通过得失电子达到稳定结构通过形成共用电子对达到稳定结构成键粒子阴、阳离子原子成键性质静电作用静电作用形成条件大多数活泼金属与活泼非金属化合时形成离子键同种或不同种非金属元素化合时形成共价键(稀有气体元素除外)表示方法①电子式如②离子键的形成过程:①电子式,如②结构式,如H—Cl③共价键的形成过程:存在离子化合物绝大多数非金属单质、共价化合物、某些离子化合物考点二:极性共价键与非极性共价键的比较共价键极性共价键非极性共价键定义不同元素的原子形成的共价键,共用电子对偏向吸引电子能力强的原子一方。
同种元素的原子形成共价键,共用电子对不发生偏移。
原子吸引电子能力不相同相同成键条件不同种非金属元素的原子同种非金属元素的原子存在共价化合物,某些离子化合物中非金属单质,某些化合物中实例H—Cl H—H、Cl—Cl共价键一般是在非金属元素的原子之间,但某些金属元素和非金属元素间也可能存在共价键,如AlCl3等。
考点三:离子化合物与共价化合物的比较离子化合物共价化合物概念以离子键形成的化合物以共用电子对形成的化合物粒子间的作用阴离子与阳离子间存在离子键原子之间存在共价键导电性熔融态或水溶液导电熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)熔化时破坏的作用力一定破坏离子键,可能破坏共价键(如NaHCO3)一般不破坏共价键实例强碱、大多数盐、活泼金属的氧化物中酸、非金属的氢化物、非金属的氧化物中要点诠释:离子化合物和共价化合物的判断方法(1)根据化学键的类型判断凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,是共价化合物。



高考要求内容要求层次具体要求ⅠⅡⅢ原子结构与化学键√了解元素、核素和同位素的含义√依据原子构成了解原子序数、核电荷数、质子数、核外电子数的彼此关系和质子数、中子数、质量数之间的相互关系√了解原子核外电子排布√通过离子键、共价键(极性键和非极性键)的形成过程认识化学键元素周期表与元素周期律√了解元素周期表的结构√通过同一短周期或同一主族元素性质的递变规律与原子结构的关系,理解元素周期律的实质√通过金属、非金属在元素周期表中的位置及其性质递变规律,理解元素的原子结构、元素在周期表中的位置和元素性质三者之间的相互关系北京高考解读年次2010 2011 2012题号27(1)(6)25 9、26(1)分值 4 10 8解析本部分在高考中多考查原子结构与元素周期律结合进行元素推断,此外元素、核素、同位素概念,电子式书写,微粒结构等也是考点之一。
元素周期律的特点是规律性强,内容丰富。
一方面可以以元素化合物知识为载体,进行分析与推断;另一方面考查对于元素中期表与元素周期律的应用。
满分晋级新课标剖析第4讲物质结构物质结构与元素周期律3级元素周期表(律) 推断专题物质结构与元素周期律6级元素周期表(律) 化学键物质结构与元素周期律7级物质结构3839化学键 物质结构原子结构同位素等电子粒子化学键原子核核外电子电子层最外层电子核外电子的排布规律Z :质子数N :中子数A :质量数原子中微粒的量的关系常见“10”电子微粒常见“18”电子微粒符号:元素:具有相同核电荷数(即质子数)的同一类原子的总称X A Z核素:具有一定数目的质子和一定数目的中子的一种原子同位素:具有相同质子数而有不同中子数的同一类元素的不同核素之间的互称同位素、同素异形体、同系物、同分异构体之间的区别概念分类表示方法离子键共价键极性共价键非极性共价键与物质类别的关系离子化合物共价化合物结构式电子式使离子相结合或使原子相结合的作用力元素周期表元素周期律横行:周期纵列:族元素原子核外电子排布的周期性元素性质的周期性原子结构元素性质元素在周期表中的位置排布原则递变规律结构决定归纳编排依据表现形式4.1 原子结构知识点拨知识网络40一、原子的构成【小结】原子、离子中粒子间的数量关系:1. 核内质子数(Z )= 核电荷数 = 原子核外电子数 = 原子序数; 2. 质量数(A )= 质子数(Z )+中子数(N ); 3. 质量数≈相对原子质量二、原子核外的电子排布规律1. 电子层的划分电子层数(n)1 2 3 4 5 6 7 字母符号 K L M N OP Q最多容纳电子数(2n 2)281832……2n 22. 核外电子的排布规律(1) 各电子层最多容纳的电子数是2n 2个(n 表示电子层序数)。
(2) 最外层电子数不超过8个(K 层是最外层时最多不超过2个); (3) 次外层电子数不超过18个;倒数第三层不超过32个。
(4) 核外电子总是最先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
3. 短周期元素的原子结构特征(1) 最外层电子数等于次外层电子数的元素是Be 、Ar ;(2) 最外层电子数是次外层电子数2倍的元素是C ,是次外层电子数3倍的元素是O ,是次外层电子数4倍的元素是Ne ;(3) 最外层电子数是电子层数2倍的元素是He 、C 、S ; (4) 电子层数与最外层电子数相等的元素是H 、Be 、Al ; (5) 电子总数为外层电子数2倍的元素是Be ;(6) 次外层电子数是最外层电子数2倍的元素是Si 、Li ;(7) 内层电子数之和是最外层电子数2倍的元素是Li 、P 。
三、常见的等电子粒子(1) 分子 离子一核10电子 Ne 3N -、2O -、F -、Na +、2Mg +、3Al +二核10电子 HF OH -三核10电子 2H O 2NH - 四核10电子3NH3H O +41(2) 常见“18电子”的微粒4.2 元素 核素 同位素一、元素、核素、同位素二、不同的“相对原子质量”1. 同位素的相对原子质量的计算式:r 121C 12M =⨯一个同位素原子的质量一个原子质量 2. 同位素的近似相对原子质量数值上约等于该同位素原子的质量数。
3. 元素的相对原子质量等于该元素各种同位素的相对原子质量与它们的丰度的乘积之和。
计算的平均值。
r =%+%+%+M A a B b C c ⋅⋅⋅⋅⋅⋅⋅⋅⋅【备注】①其中A 、B 、C…分别为各同位素的相对原子质量;a %、b %、c %…分别为该同位素在自然界中所占的原子的含量或原子个数的组成分数;r M 是元素(精确)的相对原子质量。
②同位素原子的数目在原子总数中所占的个数百分数称为该元素的丰度。
4.3 化学键一、化学键的分类与对比“[ ]”②作为有机物基团的原子团,不需要用“[4243H相同离子间隔排列,注意相同离子不能合并。
原子通过共价键形成,出未成键电子。
如对于多原子分子,电子式可以粗略的表示分子的构型,如【常考物质电子式】N 2:N N ∶∶; Cl 2:Cl Cl ∶∶∶; O 2:O O ∶∶; HCl :H Cl ∶∶; OH -:O H ∶; H 2O :H O H ∶∶; NH 3:H N H H ∶∶; CH 4:H C H HH∶∶; NaOH :+Na O H -[∶∶]; NH 4Cl :[H N H]Cl HH+-∶∶[∶∶]; HClO :H O Cl ∶∶∶Na 2O 2:++Na O O Na -2[∶∶∶]; H 2O 2:H O O H ∶∶∶; 3CH -: C H HH∶;4.4 元素周期表(律)一、元素周期表的结构二、元素周期律1.定义:元素的性质随原子序数的递增而呈现周期性变化的规律。
2.内容:①原子核外电子排布的周期性变化;②原子半径的周期性变化;③元素主要化合价的周期性变化;④元素金属性、非金属性的周期性变化。
3.实质:元素的原子核外电子排布周期性变化的必然结果。
三、元素周期表中元素性质递变规律1.同周期元素(从左到右)的递变规律同主族元素(从上到下)的递变规律2.4445四、原子半径和离子半径的比较规律中学化学范畴内,对于微粒半径大小可按“三看”规律来进行比较: “一看”电子层数:电子层数不同时,层数越多,半径越大。
“二看”核电荷数:电子层数相同时,核电荷数越大,半径越小。
“三看”核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
1. 原子半径的比较(1) 最外层电子数相同时,随着电子层数的递增,原子半径逐渐增大。
例:Li Na K Rb Cs ()()()()()r r r r r <<<<(2) 电子层数相同时,随着原子序数递增,原子半径逐渐减小例:Na Mg Al Si P S Cl ()()()()()()()r r r r r r r >>>>>>2. 离子半径的比较(1) 同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。
即核电荷数(质子数)相同时,核外电子数目越多,原子半径越大。
例:2+3+Fe Fe Fe ()()()r r r >>,Cl Cl ()()r r ->(2) 电子层结构相同的离子,核电荷数越大,半径越小。
例:32+2+3+N O F Na Mg Al ()()()()()()r r r r r r --->>>>>(3) 带相同电荷的离子,电子层数越多,半径越大。
例:+++++Li Na K Rb Cs ()()()()()r r r r r <<<<五、元素金属性与非金属性的判断元素金属性强弱的判断元素非金属性强弱的判断 依据得失电子能力 金属原子失电子能力或金属阳离子得电子能力 非金属原子得电子能力或非金属阴离子失电子能力 借助工具表元素在金属活动性顺序表、周期表中的位置元素在周期表中的位置借助实验结论 ①金属与水(酸)置换出氢气的难易程度 ②最高价氧化物对应水化物的碱性强弱 ③金属与盐溶液的置换反应(还原性) ①非金属单质与2H 化合难易程度或气态氢化物的稳定性 ②最高价氧化物对应的水化物的酸性③非金属之间的相互置换(氧化性)六、元素周期表中的一些特殊的规律1.“三角”规律若C、A、B(C、D、B)三种元素位于元素周期表中如右图所示位置,则有关的各种性质均可排出顺序:原子半径:C>A>B;金属性:C>A>B;非金属性:B>A>C原子半径:C>D>B;金属性:C>D>B;非金属性:B>D>C2.对角线相似规律周期表中位于对角线位置的元素性质相似,如上图中A和D两种元素,尤以Li和Mg、Be 和Al最为典型。
4.5 元素周期表(律)的应用一、元素周期表中“位、构、性”的关系元素的原子结构决定了元素在周期表中的位置和元素的性质,元素在周期表中的位置反映了元素的原子结构和元素的性质,故三者之间可相互推断。
二、元素周期表的应用1.预测元素的性质:常见题目是给出一种不常见的主族元素或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质。
2.启发人们在一定区域内寻找新物质或新材料。
①半导体材料:位于金属与非金属阶梯线交界处的元素多为半导体材料,如Si、Ge等。
②优良催化剂:多为过渡金属元素,如Fe、Cu、Ni等。
③耐高温、耐腐蚀的特种合金材料:IIIB~VIIB族的过渡金属元素,如Ti、Cr、Mn等。
④高效农药:含Cl、P、S、N、As等元素的化合物。
三、元素推断1.推断元素的思路根据原子结构、元素周期表的知识及相关已知条件,可推算原子序数,判断元素在元素周期表中的位置、元素的相对原子质量或元素的特征等,进而推断出具体元素。
基本思路如下图所示:46“10电子粒子”“18电子粒子”特殊微粒形成单质的状态形成物质的特殊颜色特殊物理性质特殊的含量典型的化学性质及用途元素的化合价规律元素性质、存在、用途的特殊性形成物质的特殊反应现象直观推断图式求解计算分析元素在周期表中的相对位置关系同主族或同周期中元素原子序数之间的关系原子结构特征元素特征周期数、族序数原子序数相对原子质量位置与结构的特殊关系,如族序数为周期数的二倍的元素等相应的计算,例如最外层电子数之和为16等根据同主族及同周期元素的递变规律元素名称2.周期表中特殊位置、结构的元素(前20号元素)(1)族序数等于周期数的元素:H、Be、Al;族序数等于周期数的2倍的元素:C、S;族序数等于周期数的3倍的元素:O。
(2)周期数是族序数2倍的元素:Li、Ca;(3)最高正价与最低负价代数和为零的短周期元素:C。