常见化学电源电极反应式的书写汇总
- 格式:doc
- 大小:57.00 KB
- 文档页数:5

电极反应方程式一、原电池电极反应方程式1.Cu─H2SO4─Zn原电池正极:2H+ + 2e- == H2↑负极:Zn—2e- == Zn2+总反应式:Zn + 2H+ == Zn2+ + H2↑2.Cu─FeCl3─C原电池正极:2Fe3+ + 2e- == 2Fe2+负极:Cu —2e- == Cu2+总反应式:2Fe3+ + Cu == 2Fe2+ + Cu2+ 3.钢铁在潮湿的空气中发生吸氧腐蚀正极:O2 + 2H2O + 4e- == 4OH-负极:2Fe—4e- == 2Fe2+总反应式:2Fe + O2 + 2H2O == 2F e(O H)2↓4.钢铁在潮湿的空气中发生析氢腐蚀正极:2H+ +2e- == H2↑负极:Fe —2e- == Fe2+总反应式:Fe +2H+ == Fe2+ +H2↑5.氢氧燃料电池(中性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O6.氢氧燃料电池(酸性介质)正极:O2 + 4H+ + 4e- == 2H2O负极:2H2—4e-== 4H+总反应式:2H2 + O2 == 2H2O7.氢氧燃料电池(碱性介质)正极:O2 + 2H2O + 4e- == 4OH-负极:2H2—4e- + 4OH- == 4H2O总反应式:2H2 + O2 == 2H2O8.铅蓄电池(放电)正极(PbO2) :PbO2 + 2e- + 24SO-+ 4H+ == PbSO4↓+ 2H2O负极(Pb) :Pb—2e- + 24SO-== PbSO4↓总反应式:Pb + PbO2 + 4H+ + 224SO-== 2PbSO4↓+2H2O9.Al─NaOH─Mg原电池正极:6H2O + 6e- == 3H2↑+ 6OH-负极:2Al —6e- + 8OH- == 22AlO-+ 4H2O总反应式:2Al + 2OH- + 2H2O == 22AlO-+ 3H2↑10.CH4燃料电池(碱性介质)正极:2O2 + 4H2O + 8e- == 8OH-负极:CH4—8e- + 10OH- ==23CO-+ 7H2O总反应式:CH4 + 2O2 + 2OH- == 23CO-+ 3H2O 11.熔融碳酸盐燃料电池(Li2CO3和Na2CO3熔融盐作电解液,CO作燃料):正极:O2 + 2CO2 + 4e- == 223CO-(持续补充CO2气体)负极:2CO + 223CO-—4e- == 4CO2总反应式:2CO + O2 == 2CO212.银锌纽扣电池(碱性介质)正极(Ag2O) :Ag2O + H2O + 2e- == 2Ag + 2OH-负极(Zn) :Zn + 2OH-—2e- == ZnO + H2O总反应式:Zn + Ag2O == ZnO + 2Ag二、电解电极反应方程式1.电解CuCl2溶液阳极:2Cl-—2e- == Cl2↑阴极:Cu2+ + 2e- == Cu总反应式:2Cl- + Cu2+ ==== Cl2↑ + Cu2.电解精炼铜阳极(粗铜):Cu —2e- == Cu2+阴极(纯铜) :Cu2+ + 2e- == Cu总反应式:无3.电镀铜阳极(纯铜):Cu—2e- == Cu2+阴极(待镀金属,如Fe):Cu2+ + 2e- == Cu总反应式:无4.电解饱和食盐水阳极:2Cl-—2e- == Cl2↑阴极:2H2O + 2e- == H2↑ + 2OH-总反应式:2Cl- + 2H2O ==== H2↑+ Cl2↑ + 2OH-5.电解HCl溶液阳极:2Cl- - 2e- == Cl2↑阴极:2H+ + 2e- == H2↑总反应式:2Cl- + 2H+==== Cl2↑ + H2↑6.电解NaOH溶液阳极:4OH-—4e- == O2↑ + 2H2O阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O ==== 2H2↑+ O2↑7.电解H2SO4溶液阳极:2H2O —4e- == O2↑ + 4H+阴极:4H+ +4e- == 2H2↑总反应式:2H2O ==== 2H2↑ + O2↑8.电解KNO3溶液阳极:2H2O —4e- == O2↑ + 4H+阴极:4H2O + 4e- == 2H2↑ + 4OH-总反应式:2H2O ==== 2H2↑ + O2↑9.电解CuSO4溶液阳极:2H2O—4e- == O2↑ + 4H+电解电解电解电解电解电解阴极:2Cu2+ + 4e- == 2Cu↓总反应式:2Cu2+ + 2H2O ==== 2Cu↓+ O2↑+ 4H+ 10.电解AgNO3溶液阳极:2H2O—4e- == O2↑ + 4H+阴极:4Ag+ + 4e- == 4Ag↓总反应式:4Ag+ + 2H2O ==== 4Ag↓+ O2↑ + 4H+ 11.铅蓄电池充电阳极:PbSO4—2e- + 2H2O == PbO2 +24SO-+ 4H+阴极:PbSO4 + 2e- == Pb + 24SO-总反应式:2PbSO4 + 2H2O ==== Pb + PbO2 + 4H+ +224SO-B2H6(g) + 3O2(g) ==== B2O3(s) + 3H2O(l);ΔH = - 2165 kJ·mol-1电解电解电解。

常见化学电源及电极反应式的书写一、常见化学电源:(大体可分为三类)1、燃料电池:(1)氢氧燃料电池:2H2+O2=2H2O当电解质溶液呈酸性时;负极:2H2-4e-=4H+正极:O2+4e-+4H+=2H2O当电解质溶液呈碱性时;电解质溶液为KOH溶液,负极:2H2-4e-+4OH-=4H2O 正极:O2+4e-+2H2O=4OH-(2)甲烷燃料电池:用金属铂作电极,用KOH溶液作电解质溶液。
负极:CH4+ 10 OH--8e-==CO3 2- +7H2O 正极:2O2+ 4H2O +8e- == 8OH-总反应式为:CH4+ 2O2+2KOH==K2CO3+ 3H2O用酸液作电解质溶液负极:CH4 + 2H2O - 8e- = CO2 + 8H+ 正极:2O2 + 8H+ + 8e- = 4H2O总反应:CH4 + 2O2 = CO2 + 2H2O(3)甲醇燃料电池:强碱作为电解质溶液负极:2CH4O + 16OH--12e-==2CO3 2- +12H2O 正极:3O2+ 6H2O +12e- == 12OH-总反应式为:2CH4O + 3O2+4OH-==2CO3 2- + 6H2O(4)熔融盐燃料电池:该电池用Li2CO3和的Na2CO3熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,负极:2CO+2CO3 2- -4e-==4CO2正极:O2 + 2CO2+4e- ==2CO3 2-总反应式为:2CO +O2==2CO2(5)固体氧化物燃料电池:固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许O 2-在其间通过。
负极:2H2+ 2O2--4e- = 2H2O 正极:O2+4e- = 2O 2-总反应式为:2H2 + O2= 2H2O2、蓄电池:(1)铅蓄电池: Pb和PbO2作电极材料,H2SO4作电解质溶液。
负极:Pb+SO4 2- -2e- = PbSO4正极:PbO2+4H++ SO4 2- +2e- = PbSO4+2H2O 总反应式为:Pb+ PbO2+2H2SO4==2PbSO4+2H2O(2)碱性镍—镉电池该电池以Cd和NiO(OH) 作电极材料,NaOH作电解质溶液。

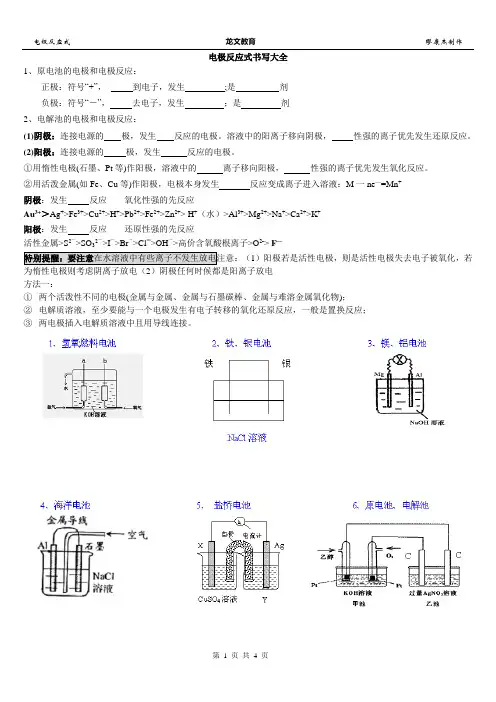
电极反应式书写大全1、原电池的电极和电极反应:正极:符号“+”,到电子,发生;是剂负极:符号“-”,去电子,发生;是剂2、电解池的电极和电极反应:(1)阴极:连接电源的极,发生反应的电极。
溶液中的阳离子移向阴极,性强的离子优先发生还原反应。
(2)阳极:连接电源的极,发生反应的电极。
①用惰性电极(石墨、Pt等)作阳极,溶液中的离子移向阳极,性强的离子优先发生氧化反应。
②用活泼金属(如Fe、Cu等)作阳极,电极本身发生反应变成离子进入溶液:M一ne—=Mn+阴极:发生反应氧化性强的先反应Au3+>Ag+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+> H+(水)>Al3+>Mg2+>Na+>Ca2+>K+阳极:发生反应还原性强的先反应活性金属>S2->SO32->I->Br->Cl->OH->高价含氧酸根离子>O2-> F—(1)阳极若是活性电极,则是活性电极失去电子被氧化,若为惰性电极则考虑阴离子放电(2)阴极任何时候都是阳离子放电方法一:①两个活泼性不同的电极(金属与金属、金属与石墨碳棒、金属与难溶金属氧化物);②电解质溶液,至少要能与一个电极发生有电子转移的氧化还原反应,一般是置换反应;③两电极插入电解质溶液中且用导线连接。
由甲醇和氧气以及强碱作电解质溶液的新型手机电池。
解析:CH3OH+O2→CO2+H2O 但:CO2在碱性环境中不存在,会与OH-反应生成CO32-总反应:正极反应式为:由于电解质溶液为碱性,所以正极的产物不再进一步反应,则负极的反应式为总反应方程式减去正极的反应式得到负极反应式为:16、a、b、c、d都为惰性电极,填空:M为极,N为极,a极上的电极反应为:b 极上的电极反应为:总方程式为:c极上的电极反应为: d极上的电极反应为:总方程式为:17、右图为以惰性电极进行电解:(1)写出A 、B、C、D各电极上的电极反应式和总反应方程式:A:____ _,B:_______________,总反应方程式:__________ _;C:__________ _,D:______________,总反应方程式:___________________________;18、甲烷-氧气燃料电池,该电池用金属铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气。


常见化学电源及电极反应式的书写—、常见化学电源:(大体可分为三类)1燃料电池:(1)氢氧燃料电池:2f+Q=2HO当电解质溶液呈酸性时;负极:2Ha-4e-=4H 正极:Q+4e-+4l4=2HO当电解质溶液呈碱性时;电解质溶液为KOH溶液,负极:2H2-4e-+4OH=4HO 正极:Q+4e+2H2O=4OH(2)甲烷燃料电池:用金属铂作电极,用KOH溶液作电解质溶液。
负极:CH I + 10 OH -8e-==CO3 - +7H2O 正极:2Q + 4H2O +8e- == 80H总反应式为:CH + 2O2 +2KOH==CO+ 3fO用酸液作电解质溶液负极:CH + 2H 2O - 8e- = CO 2 + 8H+ 正极:2O + 8H+ + 8e- = 4H 2O总反应:CH4 + 2O 2 = CO2 + 2H2O(3)甲醇燃料电池:强碱作为电解质溶液负极:2CHO + 16OH -12e-==2CO3 - +12H2O 正极:3O2 + 6H2O +12e- == 12OH2总反应式为:2CHO + 3O +4OH-==2CO - + 6fO(4)熔融盐燃料电池:该电池用Li 2CQ和的N Q CO熔融盐混合物作电解质,CO为阳极燃气, 空气与CO的混合气为阴极助燃气,2 _____________________________________________________ 2负极:2CO+2CO- -4e-==4CO 2 正极:Q+ 2CO+4e- ==2CO -总反应式为:2CO +Q ==2CO(5)固体氧化物燃料电池:固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许O 2-在其间通过。
図3负极:2f + 2O2--4e- = 2H2O 正极:Q +4e- = 2O -总反应式为:2 Hz + Q2 = 2fO2、蓄电池:(1)铅蓄电池:Pb和PbO2作电极材料,HSQ作电解质溶液。

【电极反应式总结】铁铜-氯化铝电池1.Fe/FeCl3(aq)/Cu负极:Fe-2e-=Fe2+正极:2Fe3++2e-=2Fe2+总反应:Fe+2Fe3+=3Fe2+镁铝碱性条件下原电池2.Mg/NaOH(aq)/Al负极:2Al-6e-+8OH-=2AlO2-+4H2O正极:6H2O+6e-=3H2↑+6OH-总反应:2Al+2OH-+2H2O=2AlO2-+3H2↑铝铜稀硝酸电池3.Al/稀硝酸/Cu负极:Al-3e-=Al3+正极:NO3-+3e-+4H+=NO↑+2H2O总反应:Al+4H++NO3-=Al3++NO↑+2H2O铝铜浓硝酸电池4.Al/浓硝酸/Cu负极:Cu-2e-=Cu2+正极:NO3-+3e-+4H+=NO↑+2H2O总反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 铁吸氧腐蚀5.Fe/NaCl(aq)溶解了O2/C负极:2Fe-4e-=2Fe2+正极:O2+4e-+2H2O=4OH-总反应:2Fe+O2+2H2O=2Fe(OH)2氢氧碱性燃料电池7.H2/KOH(aq)/O2负极:2H2-4e-++4OH-=4H2O正极:O2+4e-+2H2O=4OH-总反应:2H2+O2=2H2O甲烷碱性燃料电池9.CH4/KOH(aq)/O2负极:CH4-8e-+10OH-=CO32-+7H2O正极:2O2+8e-+4H2O=8OH-总反应:CH4+2O2+2OH-=CO32-+3H2O甲醇碱性燃料电池10.CH3OH/KOH(aq)/O2负极:2CH3OH-12e-+16OH-=2CO32-+12H2O正极:3O2+12e-+6H2O=12OH-总反应:2CH3OH+3O2+4OH-=2CO32-+6H2O乙醇碱性燃料电池11.C2H5OH/KOH(aq)/O2负极:C2H5OH-12e-+16OH-=2CO32-+11H2O正极:3O2+12e-+6H2O=12OH-总反应:C2H5OH+3O2+4OH-=2CO32-+5H2O12.碱性锌锰干电池负极:Zn-2e-+2OH- =Zn(OH)2正极:2MnO2+2H2O+2e-=2MnOOH+2OH-总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH13.银锌电池负极:Zn-2e-+2OH- =ZnO+H2O正极:Ag2O+H2O+2e-=2Ag+2OH-总反应:Zn+Ag2O=2Ag+ZnO14.铅蓄电池负极:Pb-2e-+SO42- =PbSO4正极:PbO2+4H++2e-+SO42- =PbSO4+2H2O总反应:Pb+PbO2+4H++SO42-=2PbSO4+2H2O15.镍镉电池:Cd/KOH(aq)/NiO(OH)负极:Cd-2e-+2OH- =Cd(OH)2正极:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-总反应:Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)216.镍氢电池:H2/KOH(aq)/NiO(OH)负极:H2-2e-+2OH- =2H2O正极:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-总反应:H2+2NiO(OH)=+2Ni(OH)2。



常见化学电源1、银-锌电池:(电解质溶液:KOH溶液)总反应:Zn + Ag2O=2Ag + ZnO正极:负极:2、Ni-Cd电池:(电解质溶液:KOH溶液)总反应:Cd +2 NiO(OH) + 2H2O=Cd(OH)2 + 2Ni(OH)2正极:负极3、铅蓄电池:(电解质溶液:硫酸)总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O正极:负极4、锌锰干电池(1)酸性(电解质:NH4Cl等)总反应:Zn + 2NH4Cl=ZnCl2 + 2 NH3 + H2正极:负极(2碱性(电解质KOH)总反应式:负极:正极:5、锂电池:(正极材料为LiMnO2)总反应:Li + MnO2=LiMnO2正极:负极6、氢-氧电池:总反应:2H2 + O2=2H2O(1)电解质溶液若为硫酸:正极:________________________________,负极:________________________________(2)电解质溶液若为KOH溶液:正极:________________________________,负极:________________________________ 7、甲烷电池:(电解质溶液:KOH溶液)总反应:CH4 +2 KOH + 2O2=K2CO3 + 3H2O正极:负极8、乙烷电池:(电解质溶液:KOH溶液)总反应:2C2H6 + 8KOH +7O2=4K2CO3 + 10H2O正极:负极9、甲醇燃料电池(40%KOH溶液)负极:正极:总反应式:10、Fe-Ni电池(爱迪生电池):(电解质溶液:KOH溶液)总反应:Fe + NiO2 + 2H2O=Fe(OH)2 + Ni(OH)2正极:负极11、铝-空气海水电池:(电解质溶液:海水)总反应:4Al + 6H2O + 3O2=4A l(O H)3正极:负极12、熔融盐电池:(电解质:熔融Li2CO3、Na2CO3)总反应:2CO + O2=2CO2正极:负极13、反应式为:的原电池。
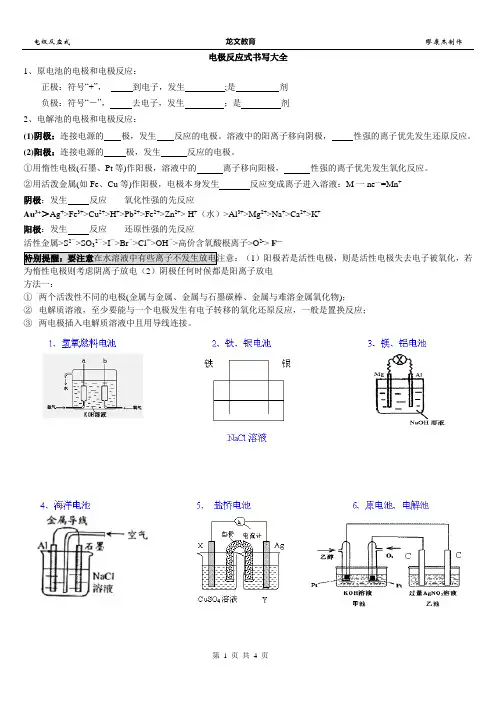
电极反应式书写大全1、原电池的电极和电极反应:正极:符号“+”,到电子,发生;是剂负极:符号“-”,去电子,发生;是剂2、电解池的电极和电极反应:(1)阴极:连接电源的极,发生反应的电极。
溶液中的阳离子移向阴极,性强的离子优先发生还原反应。
(2)阳极:连接电源的极,发生反应的电极。
①用惰性电极(石墨、Pt等)作阳极,溶液中的离子移向阳极,性强的离子优先发生氧化反应。
②用活泼金属(如Fe、Cu等)作阳极,电极本身发生反应变成离子进入溶液:M一ne—=Mn+阴极:发生反应氧化性强的先反应Au3+>Ag+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+> H+(水)>Al3+>Mg2+>Na+>Ca2+>K+阳极:发生反应还原性强的先反应活性金属>S2->SO32->I->Br->Cl->OH->高价含氧酸根离子>O2-> F—特别提醒:要注意在水溶液中有些离子不发生放电注意:(1)阳极若是活性电极,则是活性电极失去电子被氧化,若为惰性电极则考虑阴离子放电(2)阴极任何时候都是阳离子放电方法一:①两个活泼性不同的电极(金属与金属、金属与石墨碳棒、金属与难溶金属氧化物);②电解质溶液,至少要能与一个电极发生有电子转移的氧化还原反应,一般是置换反应;③两电极插入电解质溶液中且用导线连接。
由甲醇和氧气以及强碱作电解质溶液的新型手机电池。
解析:CH3OH+O2→CO2+H2O 但:CO2在碱性环境中不存在,会与OH-反应生成CO32-总反应:正极反应式为:由于电解质溶液为碱性,所以正极的产物不再进一步反应,则负极的反应式为总反应方程式减去正极的反应式得到负极反应式为:16、a、b、c、d都为惰性电极,填空:M为极,N为极,a极上的电极反应为:b 极上的电极反应为:总方程式为:c极上的电极反应为: d极上的电极反应为:总方程式为:17、右图为以惰性电极进行电解:(1)写出A 、B、C、D各电极上的电极反应式和总反应方程式:A:____ _,B:_______________,总反应方程式:__________ _;C:__________ _,D:______________,总反应方程式:___________________________;18、甲烷-氧气燃料电池,该电池用金属铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气。
常见化学电源1、银-锌电池:(电解质溶液:KOH溶液)总反应:Zn + Ag2O=2Ag + ZnO正极:负极:2、Ni-Cd电池:(电解质溶液:KOH溶液)总反应:Cd +2 NiO(OH) + 2H2O=Cd(OH)2 + 2Ni(OH)2正极:负极3、铅蓄电池:(电解质溶液:硫酸)总反应:Pb + PbO2 + 2H2SO4=2PbSO4 + 2H2O正极:负极4、锌锰干电池(1)酸性(电解质:NH4Cl等)总反应:Zn + 2NH4Cl=ZnCl2 + 2 NH3 + H2正极:负极(2碱性(电解质KOH)总反应式:负极:正极:5、锂电池:(正极材料为LiMnO2)总反应:Li + MnO2=LiMnO2正极:负极6、氢-氧电池:总反应:2H2 + O2=2H2O(1)电解质溶液若为硫酸:正极:________________________________,负极:________________________________(2)电解质溶液若为KOH溶液:正极:________________________________,负极:________________________________ 7、甲烷电池:(电解质溶液:KOH溶液)总反应:CH4 +2 KOH + 2O2=K2CO3 + 3H2O正极:负极8、乙烷电池:(电解质溶液:KOH溶液)总反应:2C2H6 + 8KOH +7O2=4K2CO3 + 10H2O正极:负极9、甲醇燃料电池(40%KOH溶液)负极:正极:总反应式:10、Fe-Ni电池(爱迪生电池):(电解质溶液:KOH溶液)总反应:Fe + NiO2 + 2H2O=Fe(OH)2 + Ni(OH)2正极:负极11、铝-空气海水电池:(电解质溶液:海水)总反应:4Al + 6H2O + 3O2=4A l(O H)3正极:负极12、熔融盐电池:(电解质:熔融Li2CO3、Na2CO3)总反应:2CO + O2=2CO2正极:负极13、反应式为:的原电池。
常见的电极反应式和总反应式1.用惰性电极电解下列溶液(1)NaCl 溶液阴极:2H ++2e -===H 2↑;阳极:2Cl --2e -===Cl 2↑;总反应式:2NaCl +2H 2O=====电解2NaOH +H 2↑+Cl 2↑。
(2)CuSO 4溶液阴极:2Cu 2++4e -===2Cu ;阳极:4OH --4e -===2H 2O +O 2↑; 总反应式:2CuSO 4+2H 2O=====电解2Cu +2H 2SO 4+O 2↑。
2.用铜作电极电解下列溶液(1)H 2O阴极:2H ++2e -===H 2↑;阳极:Cu -2e -===Cu 2+; 总反应式:Cu +2H 2O=====电解Cu(OH)2+H 2↑。
(2)H 2SO 4溶液阴极:2H ++2e -===H 2↑;阳极:Cu -2e -===Cu 2+; 总反应式:Cu +H 2SO 4=====电解CuSO 4+H 2↑。
(3)NaOH 溶液阴极:2H 2O +2e -===H 2↑+2OH -;阳极:Cu -2e -+2OH -===Cu(OH)2; 总反应式:Cu +2H 2O=====电解Cu(OH)2+H 2↑。
3.用Al 作电极电解下列溶液(1)H 2SO 4溶液阴极:6H ++6e -===3H 2↑;阳极:2Al -6e -===2Al 3+; 总反应式:2Al +3H 2SO 4=====电解Al 2(SO 4)3+3H 2↑。
(2)NaOH 溶液阴极:6H 2O +6e -===3H 2↑+6OH -;阳极:2Al -6e -+8OH -===2AlO -2+4H 2O ; 总反应式:2Al +2H 2O +2NaOH=====电解2NaAlO 2+3H 2↑。
4.铁镍电池(负极—Fe ,正极—NiO2,电解液—KOH 溶液)已知Fe +NiO 2+2H 2O 放电充电Fe(OH)2+Ni(OH)2,则: 负极:Fe -2e -+2OH -===Fe(OH)2;正极:NiO 2+2H 2O +2e -===Ni(OH)2+2OH -。
原电池电极反应式书写一、总模式:负极:还原剂,失电子→发生氧化反应(一般通式:M→M n+ + ne-)正极:氧化剂,得电子→发生还原反应(一般通式:N + me-→N m-)二、规则:①三大守恒规律:电荷守恒电子守恒质量守恒②正负极得失电子相等(负失正得)③用―=‖不用―→‖,气体用―↑‖,沉淀不用―↓‖④两式相加后电子必须抵消三、书写步骤:1、判断电池的正负极方法:利用电极材料电极现象电子流向电流流向放电物质离子流向等判断正负极2、列物质标得失找出氧化剂还原剂并标出化合价变化确定得失电子的物质3、选离子配电荷根据电解质溶液环境确定生成的离子和参与反应的离子并配电荷4、巧用水,配平式若需要水,则在两式的左边或右边加上H2O以获得H+ 或OH-5、两式加,验总式四、注意点:(1)电极反应是一种离子反应,遵循书写离子反应式的一切规则(如―拆‖、―平‖)(2)负极失电子所得氧化产物、正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在、在碱性溶液中以CO32-形式存在);(3)氧气(氧原子得电子生成O2-)溶液中不存在O2-,在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与H2O结合成OH-。
(4)两极反应相加得到总反应,总反应减去负极反应得到正极反应、总反应减去正极反应得到负极反应。
(5)若正负极的产物会同所处的电解质溶液反应的话,则必须考虑产物同电解质溶液的反应。
即电极反应的产物必须能稳定地存在与电解质溶液中。
比如:银做负极失去电子Ag-e-=Ag+ ,如果溶液中含有Cl-,Cl-与生成的Ag+反应,则电极反应变为Ag-e-+Cl-=AgCl,再如:铅蓄电池中,铅做负极失去电子变成Pb2+,溶液中有SO42-,与子反应生成硫酸铅:Pb2+-2e-+SO42-=Pb SO4。
五、书写技巧1.若知道电池总反应,根据总反应是两电极反应之和,若能写出某一极反应或已知某一极反应,由总反应减半反应可得另一极反应。
常见的原电池电极反应式书写汇总一次电池1、伏打电池:(负极一Zm 正极Yu 电解液:H2SO4)负极:Zn -2c === Zn*(氧化反应)正极:2H+ + 2c ===比f (还原反应)离于方程式:Zn + 2屮==H. f + Zir^2、铁碳电池:(负极一Fc正极一C 电解液:H2CO3弱酸性)负极:Fc - 2c === F D*(氣化反正极:2H* + 2c- === H2 f (还原反应)离于方程式:Fc + 2H H2 T + Fc"(析氢腐蚀)3、铁碳电池:(负极一Fc正极一C 电解液:中性或碱性)负极:2Fc-4c === 2Fc^* 化反应)正极:()2 + 2出()+ 4c' === 4()H'(还原反应)化学方程式:2Fc + (L+2H2O === 2F D(()H)2(吸氧腐蚀)4F C(()H)2 +()2 + 2出()===4F U(()H)3 2Fe(()H)3=== + 3出()(铁锈的生成过程)4•铝镰电池:(负极一Ah正极一Ni 电解液:NoCl溶液、(冷负极:4A1 -12c- === 4A严(氧化反应)正极:3()2+ 6出()+ 12c === 12()H•(还原反应)化学方程式:4A1 + 3()2 + 6HQ === 4A1(()H)3(海洋灯标电池)5、普通锌猛干电池:(负极一Zm正极Y 电解液:NH/X MnO.的糊状物)负极:Zn - 2c === ZiF气氧化反应)正极:2Mn()2 + 2H・ + 2c === Mn.O^ + H.O (还原反应)化学方程式:Zn + 2NH4CI + 2Mn(). === ZnCU + Mn.O^ + 2NH316、碱性锌猛干电池:(负极一Zm正极Y 电解液:KOH. MnO.的糊状物)负极:Zn + 2()H--2c- === Zn(()Hh (氧化反应)正极:2Mn()2 + 2H2()+2C === 2Mn(X)H + 2()H-(还原反应)化学方程式:Zn + 2Mn()2 + 2出()===Zn(()Hh+ MnOOH7、银锌电池:(负极一Zn、正极“AM)电解液:NaOH)负极:Zn + 2()H・-2c- === Zn(()H)2 (氧化反应)正极:AgQ + H2()+ 2c ===2Ag+2()H・(还原反应)化学方程式:Zn + A也0 + HX) === Zn(()H)2 + 2Ag8、铝-空气-海水(负极-铝、正极-石墨、钳网等能导电的情性材料电解液:海水)负极:4Al・12u" === 4AP* (<化反应)正极:3()2 + 6H2()+12c- === 12()H-(还原反应)总反应式为:4A1 + 3()2 + 6HQ === 4A1(()H)3 (钳网增大与氧气的接触面)9、镁…铝电池(负极-Al、正极一Mg 电解液:K()H )负极(Al): 2A1 + 8()H・-6c- === 2A1()2- + 4比()(氣化反应)正极(Mg): 6出()+ 6c === 3H2 f +6<)H-(还原反应)化学方程式:2A1 + 2()H・+ 2出()===2AR)2'+ 3出f正极:F C P()4 + Li* + c- === LiFcP()4 (还原反应) 阳极:LiFcP ()4-c ===F cP()4 + Li+ (氧化反应) 10.锂电池一型:(负极-金厲锂、正极“石墨 电解液:LiAlCL …SOCh )负极:8Li - 8c === 8Li^ (氧化反应)充电时 阴极:tr + C- === Li (还原反应)正极:3S()C12 + 8c"=== SC*- +2S + 6C 广(还原反应)化学方程式:8Li + 3S()C12 === Li^SO^ + 6LiCi + 2S二次电池(又叫蓄电池或充电电池)1、铅薔电池:(负极一Pb 、正极一Pb ()2 电解液:浓硫酸)放电时 负极:Pb-2c-+s ()r- === Pbs <)4 (氧化反应)正极:Pb()2 + 2c" + 4H++ S()j-=== PbS(h+ 2H2()(还原反应)充电时 阴极:PbS<)4 + 2H" + 2c === Pb + H2S()4 (还原反应)阳极:PbS (h + 2出()-2e=== Pb ()2 + HSh + 2H ・(氧化反应)总化学方程式:Pb + Pb()2 + 2H2S()4 -慕-2PbS()4 + 2HQ2、铁••镰电池:(负极・・民、正极一Z ()2 电解质:K ()H 溶液)放电时负极: Fe - 2c + 2()H - === Fu(()H)2 (氧化反应)正极: Ni()2 + 2出()+ 2 厂===Ni(()H)2 + 2()H'(还原反应)充电时阴极: F U (()H)2 + 2c === Fc + 2()H '(还原反应)阳极: Ni(( )H)2 - 2c + 2( )H ・===Ni(\ + 2Hn (氧化反应)总化学方程式:Fc + NiO, + 2HX )允电3. LiFepOq 电池(正极一LiFcPO,负极一石墨电解质:含Li ■导电固体) 放电时负极:Li - C===Li* (氧化反应)4、镣-镉电池(负极“Cd.正极一NiOQH 电解质:K()H 溶液)放电时 负极:Cd ・2J+2()H ・=HCd(()H)2 (氧化反应)正极:2Ni(X)H + 2c + 2H2() === 2Zi(()H)2 + 2()H'(还原反应)充电时 阴极:Cd(()H)2 + 2c ===Cd + 2OH-(还原反应)阳极:2Zi(()H)2 - 2e + 2()H === 2Ni()()H + 2比()(氧化反应)总化学方程式:Cd + 2Ni()OH + 2比()烷暑-Cd(()H), + 2Ni(()H)25、氢一镰电池:(负极-LaNi, ftS 氢合金、正极一Ni()()H 电解质:KOH + LiOH ) 放电时 负极:LaNi,H,-6c- + 6()H'=== LaNi, + 6兄()(氧化反应)正极:6NiO()H + 6厂 + 6H2()=== 6Ni(()H)2 + 6()H'(还原反应)充电时 阴极:LAh + 6u ・ + 6Hn===SNiH + 6()H-(还原反应)阳极:6Ni(()H)2 — 6厂+6()H ・===6Ni()()H + 6H2()(氣化反应)总化学方程式:LaNi,H^ + 6Ni()()H 充电 LaNi, + 6Ni(()H)26、高铁电池:(负极一Zn 、正极…石墨 电解质:浸湿固态碱性物质) 放电时 负极:3Zn - 6c +6()HP==3Zn(()H)2 (氧化反应)正极:2Fe()4-' + 6e+ 8H2()=== 2F C (()H)3 + 1()()H'(还原反应)充电时 阴极:3Zn(()H)2 + 6c === 3Zn + 6()H"(还原反应)阳极:2F C (OH)3-6C ' + 10()H'=== 2Fe<)4^+ «比()(氧化反应)放电总化学方程式:3Zn + 2K2F C ()4 + 汨2()「充电-3Zn(()H)2 + 2Fc((旧人 + 4I«)H 总化学方程式:F C P()4 + Li7L 电LiFcP()47、锂电池二型(负极LiC"正极含锂的二氧化钻LiC()()2、充电时LiCoO,中Li被氧化,L广还原以Li原于形式嵌入电池负极材料碳G中,以LiG耒示)放电时负极:LiCh - XC === Li,;i^)Cfi + xLi (氧化反应)正极:Li gCoQj + xc' + xLi" === LiC(》()2 (还原反应)充电时阴极:LigG +小广+ 2 H= uq (还原反应)阳极:LiC<)()2 - XC === Li(i・0C()()2 + xLi* (氧化反应)总反应方程式:LigC()()2 + Lie,充电LiCo()2 + LigG燃料电池氢氧燃料电池氢氧燃料电池一般是以惰性金属钳(PV)或石墨做电极材料,负极通入兄,正极通入O"总反应为:2H, + O, === 2HX)电板反应特别要注意电解质,有下列三种情况: 1、电解质是K()H溶液(碱性电解质)负极:H, - 2& + 2()H一===2H2()(氧化反应)正极:()2 + 2出()+ 4c === 4()H一(还原反应)总反应方程式:2出+()2 === 2比()2、电解质是HPQ溶液(酸性电解质)负极:H2-2C・H=2H+(氧化反应)正极:()2 + 4H" + 4c === 2比()(还原反应)总反应方程式:2出+()2 === 2出()3、电解质是NaCl溶液(中性电解质)正极:()2 + H2()+ 4c === 4()H-负极:H. - 2c- === 2H^ (氧化反应)总反应方程式:2H2+O2= = =2H2()说明:1、碱性溶液反应物、生成物中均无H・2、水溶液中不能出现(尸3、中性溶液反应物中无H■和()H・4、酸性溶液反应物、生成物中均无()H・二.甲»燃料电池1 •碱性电解质(钳为两极、电解液KOH溶液)正极:3()2 + 12c + 6出()===12()H・(还原反应)负极:2CH3()H-12C- + 16()H-=== 2C(V+ 12HX)(氧化反应)总反应方程式:2CH3()H + 3()2+ 4K()H === 2K2C()3 + 6出()2•酸性电解质(钳为两极、电解液HSOj溶液)正极:3()2 + 12c + 12H・===6凡()(还原反应)(注:乙醇燃料电池与甲醇燃料电池原理基本相同)负极:2CH3()H-12C+2H2()==12H J2C()2(氣化反应)总反应式:2CH3()H + 3()2 === 2C()2 + 4H2()(氣化反应)三、CO燃料电池(总反应方程式均为:2C() + a = 2C(b) 1、熔融盐(钳为两极、U2C()3和NM()3的熔融盐作电解质,CO为负极燃气,空气与C()2的混合气为正极助燃气)正极:d +4c- + 2C()2 = 2C(F・(还原反应)2、酸性电解质(钳为两极、电解液比久)4溶液)负极:2C() + 2C(V-4c-=== 4C(X (氧化反应)正极:()2 + 4c + 4H+ === 2比()(还原反应)负极:2C() - 4c' + 2比()2C()2 + 4H* (氧化反应)四、腓燃料电池(钳为两极、电解液K()H溶液)正极:()2 + 2已()+ 4c === 4(旧一(还原反应)负极:N2H4+ 4(〉H一・4c === N, + 4出()(氧化反应)总反应方程式:N2H4 + ()2 === N. + 2比()五、甲烷燃料电池1.碱性电解质(钳为两极、电解液KOH溶液)正极:2(), + 2HX)+ 8c- === 一(还原反应)负极:CH」+ 1()()H"•牝• === C(V' + 7H2()(氧化反应)总反应方程式:CH」+ 2I«)H + 2(). === K2CO3 + 3H2() 2、酸性电解质(钳为两极、电解液H3S()4溶液)正极:2()2 + 8c + 8H+ === 4HX)(还原反应)负极:CH」-8c + 2Hn === 8才+ CO.(氧化反应)总反应方程式:CH, + 2()2 === C()2 + 2出()六.丙烷燃料电池(钳为两极、正极通入()2和C()2、负极通入丙烷、电解液有三种)1、电解质炬熔融碳酸盐(KK()3或Zi2C()3)正极:5()2 + 20c + 1()C()2 === 1()C(屮(还原反应)负极:CH - 2()c + WCOs' === 3C()2 + 4H2()(氧化反应)总反应方程式:C;H, + 5()2 === 3C()2 + 4比()2、酸性电解质(电解液H3S ()4溶液)正极:5()2 + 2()c + 2()H・===lOHQ (还原反应)负极:GH. - 2()c + 6出()===3C()2 + 20H" «化反应)总反应方程式:GH, + 5()2 === 3C()2+ 4比() 3、碱性电解质(钳为两极、电解液K()H 溶液)正极:5()2 + 20c + 10HX)=== 2()()H一(还原反应)负极:GH K - 2()c + 26( )H一=== 3COf + HH.O (氧化反应)总反应方程式:GH, + 5()2 + 6K()H === 3K2C()3 + 7H2()七.乙烷燃料电池(钳为两极、电解液K()H溶液)正极:7()2 + 2牝・+14H2()===28()H"(还原反应)负极:2C2Hr 28c +36()H一=== ACCV + 24比()(氧化反应)总反应方程式:2C:H A + 7()2 + 8K()H === 4K2C()3 + lOH.O。
高中化学常见的电池的电极反应式的书写汇总TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-书写过程归纳:列物质,标得失(列出电极上的物质变化,根据价态变化标明电子得失)。
选离子,配电荷(根据介质选择合适的离子,配平电荷,使符合电荷守)。
巧用水,配个数(通常介质为水溶液,可选用水配平质量守恒)一次电池1、伏打电池:(负极—Zn、正极—Cu、电解液—H2SO4)负极: Zn–2e-==Zn2+ (氧化反应) 正极: 2H++2e-==H2↑ (还原反应)离子方程式 Zn + 2H+ == H2↑+ Zn2+2、铁碳电池:(负极—Fe、正极—C、电解液H2CO3弱酸性)负极: Fe–2e-==Fe2+ (氧化反应) 正极:2H++2e-==H2↑ (还原反应)离子方程式 Fe+2H+==H2↑+Fe2+ (析氢腐蚀)3、铁碳电池:(负极—Fe、正极—C、电解液中性或碱性)负极: 2Fe–4e-==2Fe2+ (氧化反应) 正极:O2+2H2O+4e-==4-OH (还原反应)化学方程式 2Fe+O2+2H2O==2Fe(OH)2(吸氧腐蚀) 4Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3 H2O (铁锈的生成过程)4.铝镍电池:(负极—Al、正极—Ni 电解液 NaCl溶液、O2)负极: 4Al–12e-==4Al3+ (氧化反应) 正极:3O2+6H2O+12e-==12-OH(还原反应)化学方程式 4Al+3O2+6H2O==4Al(OH)3(海洋灯标电池)5、普通锌锰干电池:(负极—Zn、正极—C 、电解液NH4Cl、MnO2的糊状物)负极:Zn–2e-==Zn2+ (氧化反应) 正极:2MnO2+2H++2e-==Mn2O3+H2O (还原反应)化学方程式 Zn+2NH4Cl+2MnO2=ZnCl2+Mn2O3+2NH3↑6、碱性锌锰干电池:(负极—Zn、正极—C、电解液KOH 、MnO2的糊状物)负极:Zn + 2OH– 2e-== Zn(OH)2(氧化反应)正极:2MnO2 + 2H2O + 2e-==2MnOOH +2 OH-(还原反应)化学方程式 Zn +2MnO2 +2H2O == Zn(OH)2+ MnOOH7、银锌电池:(负极—Zn、正极--Ag2O、电解液NaOH )负极:Zn+2OH––2e-== Zn(OH)2(氧化反应)正极:Ag2O + H2O + 2e-== 2Ag + 2 OH- (还原反应)化学方程式 Zn + Ag2O + H2O == Zn(OH)2+ 2Ag8、铝–空气–海水(负极--铝、正极--石墨、铂网等能导电的惰性材料、电解液--海水)负极:4Al-12e-==4Al3+ (氧化反应)正极:3O2+6H2O+12e-==12OH-(还原反应)总反应式为: 4Al+3O2+6H2O===4Al(OH)3(铂网增大与氧气的接触面)9、镁---铝电池(负极--Al、正极--Mg 电解液KOH)负极(Al): 2Al + 8 OH–- 6e- = 2AlO2–+4H2O (氧化反应)正极(Mg): 6H2O + 6e- = 3H2↑+6OH–(还原反应)化学方程式: 2Al + 2OH– + 2H2O = 2AlO2–+ 3H210、锂电池一型:(负极--金属锂、正极--石墨、电解液LiAlCl4 -SOCl2)负极:8Li -8e-=8 Li + (氧化反应)正极:3SOCl2+8e-=SO32-+2S+6Cl-(还原反应)化学方程式 8Li+ 3SOCl2 === Li2SO3+ 6LiCl + 2S,二次电池(又叫蓄电池或充电电池)1、铅蓄电池:(负极—Pb 正极—PbO2电解液—浓硫酸)放电时负极: Pb-2e-+SO42-=PbSO4(氧化反应)正极: PbO2+2e-+4H++SO42-=PbSO4+2H2O (还原反应)充电时阴极: PbSO4 + 2H+ + 2e-== Pb+H2SO4(还原反应)阳极: PbSO4 + 2H2O - 2e-== PbO2+ H2SO4+ 2H+ (氧化反应)总化学方程式 Pb+PbO2 + 2H2SO4充电放电2PbSO4+2H2O2、铁--镍电池:(负极-- Fe 、正极—NiO2、电解质溶液为KOH溶液)放电时负极: Fe-2e—+ 2 OH– == Fe (OH)2(氧化反应)正极: NiO2 + 2H2O + 2e—== Ni(OH)2+ 2 OH–(还原反应)充电时阴极: Fe (OH)2+ 2e—== Fe + 2 OH–(还原反应)阳极: Ni(OH)2-2e—+ 2 OH– == NiO2+ 2H2O (氧化反应)总化学方程式 Fe + NiO2+ 2H2O充电放电Fe (OH)2+ Ni(OH)23、LiFePO4电池(正极—LiFePO4,负极—石墨,含Li+导电固体为电解质)放电时负极: Li - e— ==Li + (氧化反应)正极: FePO4 + Li+ + e—== LiFePO4(还原反应)充电时:阴极: Li+ + e—== Li (还原反应)阳极: LiFePO4-e—== FePO4+ Li+ (氧化反应)总化学方程式 FePO4 + Li充电放电 LiFePO44、镍--镉电池(负极--Cd、正极—NiOOH、电解质溶液为KOH溶液)放电时负极: Cd-2e—+ 2 OH– == Cd(OH)2(氧化反应)正极: 2NiOOH + 2e—+ 2H2O == 2Ni(OH)2+ 2OH–(还原反应)充电时阴极: Cd(OH)2+ 2e—== Cd + 2 OH–(还原反应)阳极:2 Ni(OH)2-2e—+ 2 OH– == 2NiOOH + 2H2O (氧化反应)总化学方程式 Cd + 2NiOOH + 2H2O充电放电Cd(OH)2+ 2Ni(OH)25、氢--镍电池:(负极-LaNi5储氢合金、正极—NiOOH、电解质KOH+LiOH)放电时负极: LaNi5H6-6e—+ 6OH–== LaNi5+ 6H2O (氧化反应)正极: 6NiOOH +6e—+ 6H2O ==6 Ni(OH)2+ 6OH–(还原反应)充电时阴极: LaNi5 +6e—+ 6H2O== LaNi5H6+ 6OH–(还原反应)阳极: 6 Ni(OH)2 -6e—+ 6OH–== 6NiOOH + 6H2O (氧化反应)总化学方程式 LaNi5H6+ 6NiOOH充电放电LaNi5+ 6Ni(OH)26、高铁电池:(负极—Zn、正极---石墨、电解质为浸湿固态碱性物质)放电时负极:3Zn -6e- + 6 OH–== 3 Zn(OH)2(氧化反应)正极:2FeO42—+6e-+ 8H2O ==2Fe (OH)3+ 10OH–(还原反应)充电时阴极:3Zn(OH)2 +6e-==3Zn + 6 OH– (还原反应)Ni(OH)2+Cd(OH)2阳极:2Fe(OH)3-6e-+ 10OH–==2FeO42—+ 8H2O (氧化反应)总化学方程式 3Zn + 2K2FeO4+ 8H2O充电放电3Zn(OH)2+ 2Fe(OH)3+ 4KOH7、锂电池二型(负极LiC6、正极含锂的二氧化钴LiCoO2、充电时LiCoO2中Li被氧化,Li+还原以Li原子形式嵌入电池负极材料碳C6中,以LiC6表示)放电时负极: LiC6 – xe- = Li(1-x)C6+ x Li+ (氧化反应)正极: Li(1-x)CoO2+ xe- + x Li+ == LiCoO2(还原反应)充电时阴极: Li(1-x)C6+ x Li+ + xe- =LiC6(还原反应)阳极: LiCoO2 – xe-= Li(1-x)CoO2+ x Li+(氧化反应)总反应方程式 Li(1-x)CoO2+ LiC6 充电放电LiCoO2+ Li(1-x)C6燃料电池根据题意叙述书写常见于燃料电池,由于燃料电池的优点较多,成为了近年高考的方向。
电极反应式书写大全1、原电池的电极和电极反应:正极:符号“+”,到电子,发生;是剂负极:符号“-”,去电子,发生;是剂2、电解池的电极和电极反应:(1)阴极:连接电源的极,发生反应的电极。
溶液中的阳离子移向阴极,性强的离子优先发生还原反应。
(2)阳极:连接电源的极,发生反应的电极。
①用惰性电极(石墨、Pt等)作阳极,溶液中的离子移向阳极,性强的离子优先发生氧化反应。
②用活泼金属(如Fe、Cu等)作阳极,电极本身发生反应变成离子进入溶液:M一ne—=Mn+阴极:发生反应氧化性强的先反应Au3+>Ag+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+> H+(水)>Al3+>Mg2+>Na+>Ca2+>K+阳极:发生反应还原性强的先反应活性金属>S2->SO32->I->Br->Cl->OH->高价含氧酸根离子>O2-> F—特别提醒:要注意在水溶液中有些离子不发生放电注意:(1)阳极若是活性电极,则是活性电极失去电子被氧化,若为惰性电极则考虑阴离子放电(2)阴极任何时候都是阳离子放电方法一:①两个活泼性不同的电极(金属与金属、金属与石墨碳棒、金属与难溶金属氧化物);②电解质溶液,至少要能与一个电极发生有电子转移的氧化还原反应,一般是置换反应;③两电极插入电解质溶液中且用导线连接。
由甲醇和氧气以及强碱作电解质溶液的新型手机电池。
解析:CH3OH+O2→CO2+H2O 但:CO2在碱性环境中不存在,会与OH-反应生成CO32-总反应:正极反应式为:由于电解质溶液为碱性,所以正极的产物不再进一步反应,则负极的反应式为总反应方程式减去正极的反应式得到负极反应式为:16、a、b、c、d都为惰性电极,填空:M为极,N为极,a极上的电极反应为:b 极上的电极反应为:总方程式为:c极上的电极反应为: d极上的电极反应为:总方程式为:17、右图为以惰性电极进行电解:(1)写出A 、B、C、D各电极上的电极反应式和总反应方程式:A:____ _,B:_______________,总反应方程式:__________ _;C:__________ _,D:______________,总反应方程式:___________________________;18、甲烷-氧气燃料电池,该电池用金属铂片插入KOH溶液中作电极,在两极上分别通甲烷和氧气。