原子的结构和电子构型ppt课件
- 格式:ppt
- 大小:852.00 KB
- 文档页数:9


原子的结构和电子构型原子是构成物质的最基本单位,它由质子、中子和电子组成。
质子和中子位于原子的核心,称为原子核,而电子则围绕着原子核旋转。
原子核是原子的中心,由质子和中子组成。
质子带正电荷,质子数决定了元素的原子序数。
中子不带电荷,其数量会影响原子的质量。
电子壳是电子的运动区域,分为n个主量子能级(n=1,2,3...)。
第一主量子能级(K壳)离原子核最近,第二主量子能级(L壳)紧随其后,以此类推。
每个主量子能级可以容纳不同数量的电子。
电子轨道是电子在主量子能级中的运动路径。
每个主量子能级可以含有不同数量的电子轨道,分别以s、p、d和f来表示。
s轨道是最简单的电子轨道,每个s轨道可以容纳最多2个电子。
s轨道有一个球形的分布,出现在所有主量子能级上。
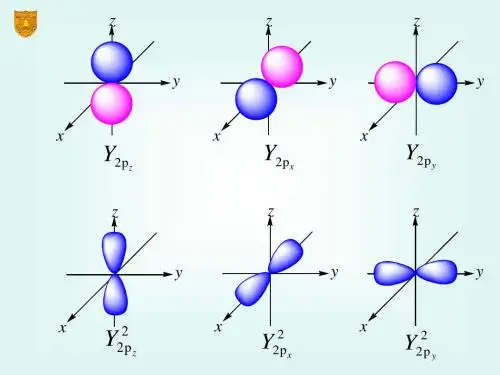
p轨道比s轨道复杂一些,每个p轨道可以容纳最多6个电子。
p轨道有三个不同的方向(xyz轴),分别以px、py、pz表示。
d轨道相对更复杂,每个d轨道可以容纳最多10个电子。
d轨道有五个不同的方向,分别以dxy、dyz、dzx、dx2-y2和dz2表示。
f轨道更加复杂,每个f轨道可以容纳最多14个电子。
f轨道有七个不同的方向,分别以fxyz、fx2-y2、fyz2、fzx2、fz3和fx3-y2表示。
当电子填充到原子中时,要遵循一定的顺序。
这一顺序可以通过洪特规则和泡利不相容原理来确定。
洪特规则指出,当电子填充到电子轨道中时,首先填充最低能级的轨道。
泡利不相容原理指出,每个电子轨道上的电子应具有相反的自旋方向。
根据这些规则,我们可以确定原子的电子构型。
以氧(O)原子为例,氧原子有8个电子,因此电子构型为1s22s22p4、这意味着氧原子的电子首先填充到1s轨道中,然后填充到2s轨道中,最后填充到2p轨道中。
电子构型对于理解原子性质和化学反应非常重要。
它可以帮助我们预测原子的化学行为和物理性质,以及解释元素周期表的排列。







原子的结构和电子构型原子是物质的基本单位,由原子核和围绕核运动的电子组成。
原子核位于原子的中心,由质子和中子组成。
质子带有正电荷,中子不带电荷。
电子带有负电荷,绕着原子核的轨道运动。
原子核的质量主要由质子和中子的质量决定,质子和中子的质量几乎相等。
质子的电荷为+1,中子没有电荷。
原子核的直径约为1/10,000分之1个原子直径。
电子的质量远小于质子和中子,电子的质量约为1/1836个质子质量。
电子的电荷为-1,质子和电子的电荷大小相等但异号。
电子围绕着原子核的轨道运动,根据量子力学理论,电子的位置不能确定,只能确定在一些轨道上的概率分布。
电子轨道是描述电子运动的数学函数,通常用主量子数(n)、角量子数(l)、磁量子数(m)和自旋量子数(s)来表示。
主量子数决定了电子的能级大小,角量子数决定了电子的轨道形状,磁量子数决定了电子在轨道上的位置,自旋量子数决定了电子的自旋方向。
电子的能级和轨道:根据量子力学理论,电子围绕着原子核的轨道可以分为不同的能级,能级越高,电子的能量越大。
第一个能级(n=1)最靠近原子核,能级数依次增加。
每个能级可以容纳的电子数由角量子数决定,第一个能级(n=1)只能容纳最多2个电子,第二个能级(n=2)最多容纳8个电子,以此类推。
每个能级又可以分为不同的子能级,子能级由角量子数决定,角量子数的取值范围为0到n-1、例如,第一个能级(n=1)只有一个子能级(l=0),称为s轨道;第二个能级(n=2)有两个子能级(l=0和l=1),分别称为s轨道和p轨道。
电子的填充原则:根据电子填充原则,电子首先填充低能级的轨道,然后逐渐填充高能级的轨道。
在填充同一个能级的轨道时,按照泡利不相容原理,每个轨道最多只能容纳两个电子,并且这两个电子的自旋方向相反。
根据能级和轨道的填充规律,我们可以推导出元素周期表的结构。
元素周期表是根据元素的原子序数(原子核中质子的数量)和电子构型排列的。
每个元素的电子构型可以通过填充电子的方式来确定,电子构型的不同决定了元素的化学性质和反应能力。