高三化学 中和热测定实验误差分析
- 格式:docx
- 大小:41.16 KB
- 文档页数:4


1、NaOH药品不纯(如NaOH中混有少量Na2O),结果偏高。
2、用天平称量NaOH时,称量时间过长。
由于部分NaOH与空气中的CO2反应生成Na2CO3 ,得到Na2CO3和NaOH的混合物,则结果偏低。
3、用天平称量NaOH时,如砝码有污物,结果偏高。
4、用天平称量NaOH时,物码颠倒,但未用游码,不影响结果。
5、用天平称量NaOH时,物码颠倒,又用了游码,结果偏低。
6、用天平称量NaOH时,若用滤纸称NaOH,结果偏低。
7、称量前小烧杯中有水,无影响。
8、向容量瓶中转移溶液时,有少量溶液流至容量瓶之外,结果偏低。
9、未把烧杯、玻璃棒洗涤2~3次,或洗涤液未注入容量瓶,结果偏低。
10、烧杯中溶液未冷却至室温,就开始转移溶液注入容量瓶,结果偏高11、定容时蒸馏水加多了,液面超过了刻度线,而用滴管吸取部分溶液至刻度线,结果偏低。
12、定容时摇匀,容量瓶中液面下降,再加蒸馏水至刻度线,结果偏低。
13、容量瓶定容时,若俯视液面读数,结果偏高。
14、容量瓶定容时,若仰视液面读数,结果偏低。
15、配制一定物质的量浓度稀H2SO4时,用量筒量取浓溶液,若俯视读数,结果偏低。
16、配制一定物质的量浓度稀H2SO4时,用量筒量取浓溶液,若仰视读数,结果偏高。
二、酸碱中和滴定17、滴定管蒸馏水洗后未用标准液润洗,就直接装入标准液,造成标准液稀释,溶液浓度降低,滴定过程中消耗标准液体积偏大,测定结果偏高。
18、盛待测液滴定管水洗后,未用待测液润洗就取液加入锥形瓶,待测液被稀释,测定结果偏低。
19、锥形瓶水洗后,又用待测液润洗,再取待测液,造成待测液实际用量增大,测定结果偏高。
20、用滴定管取待测液时,滴定管尖嘴处有气泡未排出就取液入锥形瓶,由于气泡填充了部分待测液,使得待测液体积减小,造成滴定时标准液体积减小,测定结果偏低。
21、滴定前,锥形瓶用水洗涤后,或锥形瓶中残留水,未干燥,或取完待测液后再向锥形瓶中加点水便于观察,虽然待测液体积增大,但待测液浓度变小,其物质的量不变,无影响。


中和热的测定实验误差全文共四篇示例,供读者参考第一篇示例:中和热是化学实验中常见的一种实验现象,通常是指在化学反应中,当酸和碱互相反应产生水和盐的过程。
中和反应会伴随着释放热量,导致溶液温度上升。
在实验室中,测定中和热是一种常见的实验方法,用于确定两种物质相互反应的热量变化。
在进行中和热的测定实验时,总是会伴随着一定的误差,这些误差可能来自多个方面,本文将探讨测定中和热实验中可能出现的误差,并提出相应的对策。
测定中和热时可能存在的误差之一是仪器误差。
在实验室中,测定中和热常常采用热量计来进行。
热量计的精度和灵敏度会直接影响到实验结果的准确性。
一些因素,如热量计的校准不准确、设备老化等,都可能导致仪器误差的出现。
为了减小仪器误差,可以定期校准热量计,确保其准确性;并在实验过程中注意观察仪器的反应,及时调整操作。
实验操作中的人为误差也是可能导致测定中和热误差的重要因素。
在实验操作中,如果操作不规范或者误差较大,都会对实验结果产生影响。
操作不慎导致试剂泼洒、量筒读数不准确、摇床摇动不均匀等,都可能导致误差的出现。
为了减小人为误差,实验人员应该熟悉实验步骤,严格按照标准操作程序进行实验,尽量减小人为操作不当的可能性。
温度和环境条件也可能对实验结果产生影响。
在中和热实验中,温度的变化会直接影响到反应速率和热量释放量,对温度的监测和控制十分重要。
实验环境中的湿度、气压等因素也可能对实验结果产生影响。
为了减小这些误差,实验室应该在恒温、恒湿的环境中进行实验,并确保环境条件的稳定。
除了以上几种可能的误差来源外,实验中的其他因素,如试剂纯度、反应物质量等,也有可能对实验结果产生影响。
为了减小这些误差,实验人员应该选择高纯度的试剂,严格按照实验方案进行操作,并在反应前进行必要的称量、溶解等操作,确保实验条件的一致性。
测定中和热实验是一种精密的实验方法,可能存在多种误差因素。
为了获得准确的实验结果,实验人员应该注意以下几点:1. 测定中和热实验中可能存在的误差包括仪器误差、人为误差、温度和环境条件变化等。

酸碱中和热测定的误差分析李大刚贵州省贵阳市修文中学 550200关键词:中和热测定误差分析摘要:在众多的化学参考书和复习资料以及在高考实验试题中,化学实验的误差分析是高中化学实验考题中一个重要的常见的考查内容,如:物质的量浓度溶液的配制的误差分析,酸碱中和滴定的误差分析,硫酸铜晶体中结晶水含量测定的误差分析,酸碱中和热测定的误差分析。
前三者在众多的化学参考书和复习资料中出现得比较多,而后者则很少见,即使有的资料书中也有出现过,但其介绍得不够多,不够全面。
基于这个原因,本文多角度多层次全方位的概括了该实验所有可能造成实验误差的因素及其详细的分析。
在任何一种测量中,无论所用的仪器多么精密,方法多么完善,实验者多么细心,所得结果常常不能完全一致而会有一定的误差。
由于某种特殊原因(如仪器构造不够完善、测量方法本身的限制、个人习惯等)会造成一定的误差(系统误差),由于实验者的感官的灵敏度有限或技巧不够熟练,仪器的准确度限制以及许多不能预料的其他因素对测量的影响所引起的误差(偶然误差),还有由于实验过程中犯了某种不应有的错误(如标度看错、记录看错、计算弄错等)引起的误差(过失误差)。
在高中化学实验习题中,物质的量浓度溶液的配制的误差分析,酸碱中和滴定的误差分析,硫酸铜晶体中结晶水含量测定的误差分析已出现得比较多,而新增实验酸碱中和热测定的误差分析则不多见,为此笔者多角度多层次全方位的对该实验中所有可能造成误差的因素作了详细的概括和分析,与各位老师共同探讨。
1.隔热较差隔热较差有以下几种可能的原因:①混合酸碱后,未盖硬纸板,②大烧杯上的盖板(硬纸板)的小孔太大,③实验装置中小烧杯周围的泡沫塑料或棉花未填满,④向装有盐酸的烧杯中倒入氢氧化钠溶液时动作缓慢。
以上几种原因中的任何一种都有可能造成酸碱中和后放出的热量部分散失,根据酸碱中和热公式(△H = Q /0.025 = -0.418(t2– t1)/0.025 KJ/mol ),由于热量部分散失,即 Q偏小,则中和热△H偏小或热量部分散失,体现在终止温度t2偏小,则中和热△H偏小。
酸碱中和滴定实验中的误差因素分析一、一、来自滴定管产生的误差1. 滴定管水洗后,未用标准液润洗分析:因标准液被附在滴定管内壁的水稀释了,又因为标准液的浓度不变,故消耗的标准液体积增多,所以滴定结果偏高。
2. 滴定管水洗后,未用待测液润洗分析:因待测液被附在滴定管内壁的水稀释了,故消耗的标准液体积减少,所以滴定结果偏低。
3. 盛标准液的滴定管滴定前有气泡,滴定后无气泡分析:读出来的标准液体积为实际消耗的标准液体积+ 气泡体积,故消耗的标准液体积读数偏大,所以结果偏高。
4. 盛待测液的滴定管滴定前有气泡,滴定后无气泡分析:读出来的待测液体积为实际量取的待测液体积(滴定前有气泡,则液面较高,滴定后无气泡,液面较低,两个相减后体积比实际大。
也是就是实际测得的体积小)+ 气泡体积。
即待测液量偏少,故消耗的标准液也少,所以结果偏低。
二、来自锥形瓶产生的误差1.锥形瓶用蒸馏水水洗后又用待测液润洗分析:因锥形瓶瓶内壁附着有待测液,故锥形瓶内的待测液增多,消耗的标准液增多,所以结果偏高。
2. 锥形瓶水洗后未干燥就加入待测液或滴定过程中向锥形瓶内加少量水分析:实际参与中和反应的待测液的总量不变,实际消耗的标准液也不变,故对结果无影响。
三、来自读数的误差1. 用滴定管量取待测液时(1)先俯视后仰视(先俯视后平视或先平视后仰视)分析:量取待测液的实际体积偏小,消耗的标准液也少,所以结果偏低。
(2)先仰视后俯视(先仰视后平视或先平视后俯视)分析:量取待测液的实际体积偏大,消耗的标准液也多,所以结果偏高。
2. 用滴定管量取标准液时(按仰视读数偏高,原体积比实际高;俯视读数偏低,原体积比实际低)(标准液只看其读数就行了)(1)先俯视后平视分析:读出来的标准液体积为V终-V始,而俯视时V始偏小,读出来的标准液体积偏大,所以结果偏高。
(2)先仰视后平视分析:读出来的标准液体积为V终-V始,而仰视时V始偏大,读出来的标准液体积偏小,所以结果偏低。
中和热概念及分类・一、定义・在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热. ・定义要点:・1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热. ・2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH (aq) = = = = H2O(l) 中和热均为57. 3 kJ mol 而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57. 3 kJ mol1;・3.以生成lmol水为基准.•二、注意点:・中和热是以生成1 mol H2O所放出的热量来测定的,因此书写它们的热化学方程式时,应以生成1 mol水为标准来配平其余物质的化学计量数,例如:・ KOH(aq)+ l/2H2SO4(aq)= = = = l/2K2SO4(aq) + H2O(l); AH=~57. 3 kJmol1・实质:屮+ OH- =H2O,当强酸与强碱在稀溶液中发生中和反应时,都有:H*(aq) + OH- (aq) = H2O(I); AH =-57.3kJ/mol・三、分类与实例・发生中和反应时,由于所用的酸和碱有强弱不同,又有一元、二元或多元之分,因而中和热各不相同。
・(1)一元强酸跟一元强碱的中和热・一元强酸跟一元强碱中和时,中和热为一57.3 kJ/mol。
・(2)—元强酸跟一元弱碱或一元弱酸跟一元强碱的中和热・如果有一元弱酸或弱碱参加中和反应,其中和热所放出热量一般都低57.3 kJ/mol,也有个别高于57.3 kJ/mol的。
这主要取决于弱酸或弱碱电离时吸热还是放热。
一般地说,弱酸或弱碱的电离是吸热的,因此,中和反应所放出的热量还要扣除电离时吸收的那部分热量,中和热也就低于57.3 kJ/molo 例如,1 mol CHsCOOH跟 1 mol NaOH溶液反应时,中和热是56.0 kJ/molo・有的弱电解质电离时是放热的。
例如,ImolE!氢氟酸电离时放出10.4 kJ/mol热量。
中和热的测定实验误差
中和热的测定实验误差可能来源于以下几个方面:
1.仪器误差:例如,温度计的精度、搅拌器的效率等都可能影响实验结果的准确性。
2.操作误差:在进行实验时,如果操作不规范,例如加入试剂的速度过快或过慢、搅拌不均匀等,都可能导致实验误差。
3.环境误差:例如,实验室的温度、湿度等环境因素的变化,以及电源的稳定性等都可能影响实验结果的准确性。
为了减少实验误差,可以采取以下措施:
4.提高仪器精度:使用精度更高的温度计、搅拌器等仪器,以提高实验结果的准确性。
5.规范实验操作:在进行实验时,严格按照操作规程进行,确保操作的准确性和一致性。
6.控制环境条件:在实验过程中,尽量保持实验室的温度、湿度等环境条件的稳定,以减少环境误差对实验结果的影响。
7.此外,还可以通过多次重复实验、取平均值等方法来减小实验误差。
酸碱中和滴定实验中的误差因素分析一、来自滴定管产生的误差1。
滴定管水洗后,未用标准液润洗分析:因标准液被附在滴定管内壁的水稀释了,又因为标准液的浓度不变,故消耗的标准液体积增多,所以滴定结果偏高。
2. 滴定管水洗后,未用待测液润洗分析:因待测液被附在滴定管内壁的水稀释了,故消耗的标准液体积减少,所以滴定结果偏低。
3。
盛标准液的滴定管滴定前有气泡,滴定后无气泡分析:读出来的标准液体积为实际消耗的标准液体积+ 气泡体积,故消耗的标准液体积读数偏大,所以结果偏高。
4。
盛待测液的滴定管滴定前有气泡,滴定后无气泡分析:读出来的待测液体积为实际量取的待测液体积(滴定前有气泡,则液面较高,滴定后无气泡,液面较低,两个相减后体积比实际大。
也是就是实际测得的体积小)+ 气泡体积。
即待测液量偏少,故消耗的标准液也少,所以结果偏低。
二、来自锥形瓶产生的误差1.锥形瓶用蒸馏水水洗后又用待测液润洗分析:因锥形瓶瓶内壁附着有待测液,故锥形瓶内的待测液增多,消耗的标准液增多,所以结果偏高。
2. 锥形瓶水洗后未干燥就加入待测液或滴定过程中向锥形瓶内加少量水分析:实际参与中和反应的待测液的总量不变,实际消耗的标准液也不变,故对结果无影响。
三、来自读数的误差1. 用滴定管量取待测液时(1)先俯视后仰视(先俯视后平视或先平视后仰视)分析:量取待测液的实际体积偏小,消耗的标准液也少,所以结果偏低。
(2)先仰视后俯视(先仰视后平视或先平视后俯视)分析:量取待测液的实际体积偏大,消耗的标准液也多,所以结果偏高。
2. 用滴定管量取标准液时(按仰视读数偏高,原体积比实际高;俯视读数偏低,原体积比实际低)(标准液只看其读数就行了)(1)先俯视后平视分析:读出来的标准液体积为V终-V始,而俯视时V始偏小,读出来的标准液体积偏大,所以结果偏高.(2)先仰视后平视分析:读出来的标准液体积为V终-V始,而仰视时V始偏大,读出来的标准液体积偏小,所以结果偏低.四、来自指示剂带来的误差1. 强酸滴定弱碱,指示剂选酚酞分析:恰好反应时溶液显酸性,若选酚酞,滴定终点时溶液显碱性,故标准液强酸的量偏小,结果偏低。
中和热概念及分类
•一、定义
•在稀溶液中,酸跟碱发生中和反应生成1 mol 水时的反应热叫做中和热.
•定义要点:
•1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热.
•2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)====H2O(l)中和热均为57.3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·mol-1;
•3.以生成1 mol 水为基准.
•二、注意点:
•中和热是以生成1 mol H2O所放出的热量来测定的,因此书写它们的热化学方程式时,应以生成1 mol 水为标准来配平其余物质的化学计量数,例如:
•KOH(aq)+1/2H2SO4(aq)==== 1/2K2SO4(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
•实质:H++OH- =H2O,当强酸与强碱在稀溶液中发生中和反应时,都有:H+(aq) +OH- (aq) =H2O(l);ΔH =-57.3kJ/mol •三、分类与实例
•发生中和反应时,由于所用的酸和碱有强弱不同,又有一元、二元或多元之分,因而中和热各不相同。
•(1)一元强酸跟一元强碱的中和热
•一元强酸跟一元强碱中和时,中和热为-57.3 kJ/mol。
•(2)一元强酸跟一元弱碱或一元弱酸跟一元强碱的中和热
•如果有一元弱酸或弱碱参加中和反应,其中和热所放出热量一般都低于57.3 kJ/mol,也有个别高于57.3 kJ/mol的。
这主要取决于弱酸或弱碱电离时吸热还是放热。
一般地说,弱酸或弱碱的电离是吸热的,因此,中和反应所放出的热量还要扣除电离时吸收的那部分热量,中和热也就低于57.3 kJ/mol。
例如,1 mol CH3COOH跟1 mol NaOH溶液反应时,中和热是56.0 kJ/mol。
•有的弱电解质电离时是放热的。
例如,1 mol 氢氟酸电离时放出
10.4 kJ/mol热量。
当它跟1 mol NaOH溶液反应时,中和热是67.7
kJ/mol。
•(3)二元酸跟一元强碱的中和热
•二元酸的电离是分两步进行的,两个H+的中和热各不相同。
中和第一个H+的中和热,等于57.3 kJ/mol减去二元酸电离出第一个H+所吸收的热量ΔH1;中和第二个H+的中和热,等于57.3 kJ/mol减去二元酸电离出第二个H+所吸收的热量ΔH2。
因此,二元酸跟一元强碱的中和热ΔH可用下式表示:
•ΔH=-〔2×57.3 kJ/mol-(ΔH1+ΔH2)〕
•(4)多元酸跟一元强碱的中和热
•三元酸跟一元强碱的中和热为ΔH,三元酸里的三个H+电离时所吸收的热量依次是ΔH1、ΔH2、ΔH3,则得:ΔH=-〔3×57.3 kJ/mol-(ΔH1
+ΔH2+ΔH3)〕
•中和热测定:
(1)目的:①用量热法测定HCl与NaOH的中和热。
②了解化学标定法,并掌握其操
作。
(2)原理:在298K、溶液足够稀的情况下,1molOH-与1molH+中和,可放出57.3.kJ
的热量。
即:H+(aq)+OH-(aq) =H2O(aq) △H=-57.3kJ/mol
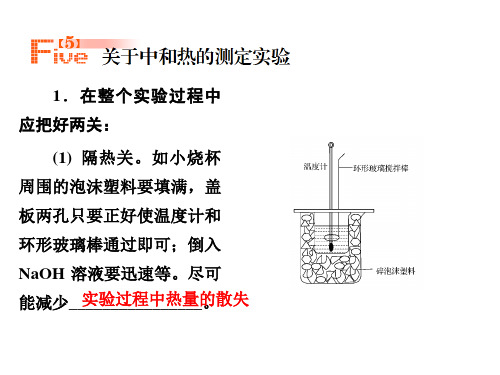
(3)仪器和实验:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50mL)两个、泡
沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol/L 盐酸、0.55 mol/L NaOH溶液。
(4)步骤:
①在大烧杯底垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。
然后再在
大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。
该实验也可在保温杯中进行。
②用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
然后把温度计上的酸用水冲洗干净。
③用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
④把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。
用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
⑤重复实验两次,取测量所得数据的平均值作为计算依据。
⑥根据实验数据计算中和热。