USNCO美国国家化学竞赛-化学Chemistry-本地local-试题 exam-2007
- 格式:pdf
- 大小:2.61 MB
- 文档页数:8


化学竞赛试题范文及答案一、选择题(每题2分,共20分)1. 下列元素中,属于碱金属族的是:A. 钠(Na)B. 镁(Mg)C. 铝(Al)D. 钾(K)答案:A2. 化学反应速率的单位通常是:A. 秒B. 升/秒C. 摩尔/秒D. 摩尔/升·秒答案:D3. 以下化合物中,不属于氧化物的是:A. 水(H2O)B. 二氧化碳(CO2)C. 氢氧化钠(NaOH)D. 氧化铁(Fe2O3)答案:C4. 根据元素周期表,下列元素中原子序数最大的是:A. 氧(O)B. 氟(F)C. 氦(He)D. 铯(Cs)答案:D5. 摩尔质量的单位是:A. 千克/摩尔B. 克/摩尔C. 千克D. 克答案:B6. 以下反应中,属于氧化还原反应的是:A. 碳酸钙受热分解B. 氢气与氧气反应生成水C. 硫酸铜与氢氧化钠反应生成氢氧化铜D. 铁与硫酸铜溶液反应答案:D7. 根据酸碱中和反应的化学方程式,下列物质中属于酸的是:A. 氢氧化钠(NaOH)B. 硫酸(H2SO4)C. 氯化钠(NaCl)D. 碳酸氢钠(NaHCO3)答案:B8. 以下化合物中,属于共价化合物的是:A. 氯化钠(NaCl)B. 硫酸铜(CuSO4)C. 氢氧化钠(NaOH)D. 二氧化碳(CO2)答案:D9. 根据化学平衡原理,下列情况中,化学平衡不移动的是:A. 增加反应物浓度B. 增加生成物浓度C. 改变温度D. 增加催化剂答案:D10. 以下元素中,属于非金属元素的是:A. 铁(Fe)B. 铜(Cu)C. 硫(S)D. 锌(Zn)答案:C二、填空题(每题2分,共20分)1. 元素周期表中,属于第ⅤA族的元素是______。
答案:氮(N)2. 根据化学计量学,1摩尔任何物质的质量等于其______。
答案:摩尔质量3. 酸碱中和反应的实质是______。
答案:氢离子与氢氧根离子结合生成水4. 元素周期表中,属于第ⅠA族的元素是______。
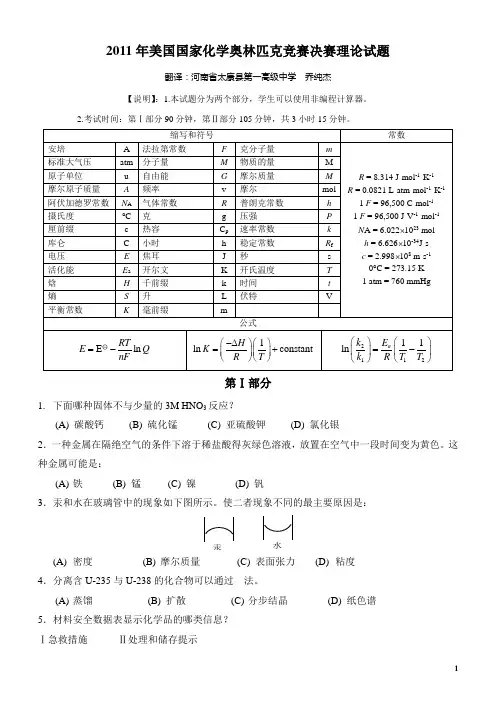
2011年美国国家化学奥林匹克竞赛决赛理论试题翻译:河南省太康县第一高级中学乔纯杰【说明】:1.本试题分为两个部分,学生可以使用非编程计算器。
2.考试时间:第Ⅰ部分90分钟,第Ⅱ部分105分钟,共3小时15分钟。
ERTnF-第Ⅰ部分1.下面哪种固体不与少量的3M HNO3反应?(A) 碳酸钙(B) 硫化锰(C) 亚硫酸钾(D) 氯化银2.一种金属在隔绝空气的条件下溶于稀盐酸得灰绿色溶液,放置在空气中一段时间变为黄色。
这种金属可能是:(A) 铁(B) 锰(C) 镍(D) 钒3.汞和水在玻璃管中的现象如下图所示。
使二者现象不同的最主要原因是:汞水(A) 密度(B) 摩尔质量(C) 表面张力(D) 粘度4.分离含U-235与U-238的化合物可以通过__法。
(A) 蒸馏(B) 扩散(C) 分步结晶(D) 纸色谱5.材料安全数据表显示化学品的哪类信息?Ⅰ急救措施Ⅱ处理和储存提示(A) Ⅰ(B)Ⅱ(C) Ⅰ和Ⅱ(D)Ⅰ和Ⅱ皆无6.一25.00mL的容量瓶质量为20.340g,当其中一部分填入一金属球时,其质量为119.691g。
然后在容量瓶中加入甲醇(d=0.791g·cm-3)至25.00mL刻度线,此时容量瓶的总质量为130.410g。
金属的密度为(A) 6.96 g·cm-3(B) 8.68 g·cm-3(C) 9.27 g·cm-3(D) 11.7 g·cm-37.某溶液中含有Ag+、Ba2+和Ni2+,以下列哪种顺序滴加NaCl、Na2S和Na2SO4稀溶液可以分别把三种阳离子沉淀出来?(A) Na2S, Na2SO4, NaCl (B) Na2S, NaCl, Na2SO4(C) Na2SO4, Na2S, NaCl (D) NaCl, Na2SO4, Na2S8.现有10.00g含C、H、O三种元素的化合物样品,完全燃烧生成14.67gCO2和6.000gH2O。

全国化学竞赛初赛试题一、写出制备金属硫化物的几类方法(按:铜、铁……等分别和硫作用均归属金属和硫反应类)。
二、写出制备二氧化硫的几类方法(按:铜、锌……。
等分别和浓硫酸作用归为同一类反应)。
三、1.磁性材料Fe2O3可由FeSO4热分解反应制得。
写出反应方程式。
2.在醋酸溶液中K4Fe(CN)6和NaNO2反应可得纯NO。
写出反应式。
3.在酸性溶液中NaNO2和KI反应可得纯NO。
写出仅应式。
按下列两种步骤进行实验(1)先把NaNO2加入酸性溶液后再加KI,(2)先混合KI和酸性溶液后再加NaNO2。
问何者制得的NO纯?4.硫和石灰乳反应得五硫化钙(CaS5)和硫代硫酸钙(CaS2O3),写出反应式。
四、如图装置。
钥匙中盛硫,金属丝为加热用,容器内盛O2,U型管内盛汞,反应前两侧液汞面持平。
给金属丝通电加热使硫起反应。
反应完成后使容器内温度恢复到反应前温度,U型管两侧液汞面仍持平。
1.由实验结果能得到什么结论?2.若反应前容器内盛空气或N2O。
分别如上实验并恢复到原温度时(已知主要反应产物相同),U形管两侧液汞面是否持平。
说明原因。
五、某温、某压下取三份等体积无色气体A,于25、80及90℃测得其摩尔质量分别为58.0、20.6、20.0克/摩尔。
于25、80、90℃下各取l1dm3(气体压力相同)上述无色气体分别溶于10dm3水中,形成的溶液均显酸性。
1.无色气体为;2.各温度下摩尔质量不同的可能原因是:3.若三份溶液的体积相同(设:溶解后溶液温度也相同),其摩尔浓度的比值是多少?六、1.写出Fe(Ⅲ)和I-在溶液中的反应现象和反应方程式。
2.有足量F-时,Fe(Ⅲ)不和I-反应。
请说出原因。
3.往1.的溶液中加足量F-,有什么现象?原因何在。
4.在足量2mol/dm3 HCl溶液中加Fe(Ⅲ)、I-、F-。
请说出反应现象,它可能和实验2的现象有何不同?七、在开采硫铁矿(FeS2)地区,开采出的矿石暴露在空气和水中,逐渐被氧化。
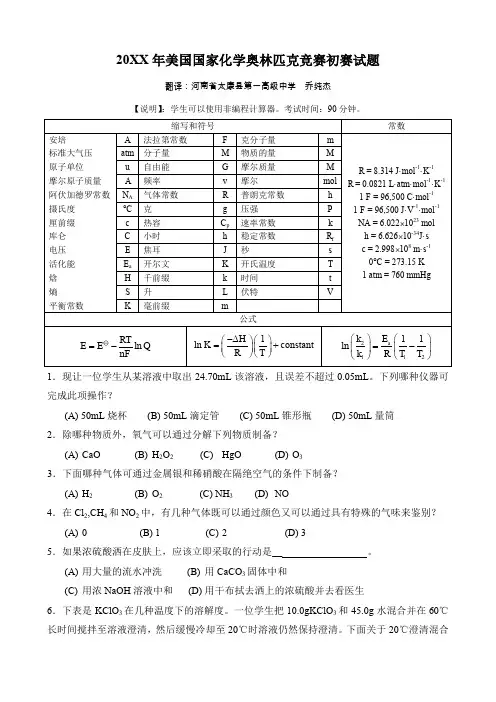
20XX年美国国家化学奥林匹克竞赛初赛试题翻译:河南省太康县第一高级中学乔纯杰【说明】:学生可以使用非编程计算器。
考试时间:90分钟。
ERT nF -1.现让一位学生从某溶液中取出24.70mL该溶液,且误差不超过0.05mL。
下列哪种仪器可完成此项操作?(A) 50mL烧杯(B) 50mL滴定管(C) 50mL锥形瓶(D) 50mL量筒2.除哪种物质外,氧气可以通过分解下列物质制备?(A) CaO (B) H2O2 (C) HgO (D) O33.下面哪种气体可通过金属银和稀硝酸在隔绝空气的条件下制备?(A) H2(B) O2 (C) NH3(D) NO4.在Cl2,CH4和NO2中,有几种气体既可以通过颜色又可以通过具有特殊的气味来鉴别?(A) 0 (B) 1 (C) 2 (D) 35.如果浓硫酸洒在皮肤上,应该立即采取的行动是__ 。
(A) 用大量的流水冲洗(B) 用CaCO3固体中和(C) 用浓NaOH溶液中和(D) 用干布拭去洒上的浓硫酸并去看医生6.下表是KClO3在几种温度下的溶解度。
一位学生把10.0gKClO3和45.0g水混合并在60℃长时间搅拌至溶液澄清,然后缓慢冷却至20℃时溶液仍然保持澄清。
下面关于20℃澄清混合物的叙述哪一个是正确的?5040302010温度,℃溶解度,g / 100g H 2O(A) 是饱和溶液 (B)是不饱和溶液,可以通过降温制得饱和溶液 (C) 是不饱和溶液,可以通过升温制得饱和溶液 (D) 是过饱和溶液7.将65.25gCuSO 4·5H 2O (M=249.7)样品溶于足量水中制得0.800L 溶液。
要制得1.00L0.100M 的溶液必须用多大体积的这种溶液加水稀释?(A) 3.27mL(B) 81.6mL (C) 209mL(D) 306mL8.燃烧2.2g C 3H 8生成CO 2和H 2O 需要几摩尔O 2?(A) 0.050(B) 0.15 (C) 0.25 (D) 0.509.在杂货店买的一种独特的聚乙烯包重12.4 g,必须由多少个乙烯(C 2H 4)分子聚合才能做成这样一个包?(A) 1.36×1024(B) 6.02×1023 (C) 5.33×1023 (D) 2.67×102310.用已知浓度的NaOH 溶液滴定某一元酸,在达到等当点时,下列哪组量是相等的?(A)OH -和H +的浓度(B)原一元酸中H +的物质的量与加入的OH -的物质的量 (C)原一元酸溶液的体积与加入的NaOH 溶液的体积(D)原一元酸的物质的量与加入的OH -的物质的量11.当难挥发溶质溶于易挥发的溶剂中时,下面哪种性质高于原溶剂?(A) 沸点 (B) 熔点 (C) 挥发速率(D) 蒸汽压12.100 mL 0.200M HNO 3溶液和200mL0.100M 的Mg(NO 3)2溶液混合后,溶液中NO 3-的浓度是多少?(A) 0.113M(B) 0.150M (C) 0.167M(D) 0.200M13.从气体到固体的相变叫做什么?(A) 凝华(B) 蒸发 (C) 聚合 (D) 升华14.某气体样品在345K 和1.40atm 时的体积为9.23L,则在525K 和3.20atm 时的体积为多大?(A) 2.65L(B) 6.14L (C) 13.9L(D) 32.1L15.下列哪种物质的色散力最强?(A) H2O (B)H2S (C) H2Se (D) H2Te16.当物质Si、KCl、CH3OH和C2H6按熔点由低到高的顺序排列时,下列正确的是哪个?(A) Si、KCl、CH3OH和C2H6(B) CH3OH、C2H6、Si和KCl(C) KCl、Si、C2H6和CH3OH (D) C2H6、CH3OH、KCl和Si17.根据下面的信息判断,在-7.4℃和400mmHg时Br2的物理状态是什么?[三相点:-7.3℃和44mmHg;液态密度:3.1g·cm-3; 固态密度:3.4g·cm-3](A) 仅以固态形式存在(B) 仅以液态形式存在(C) 仅以液态和固态形式存在(D) 以气态、液态和固态形式存在18.在27℃和1atm时,等质量的He、H2、CO2和CH4的混合气体中各种气体分子的速率比较正确的是哪个?(A) He=H2=CO2=CH4(B) H e﹤H2﹤CO2﹤CH4(C) H2﹤He﹤CH4﹤CO2(D) CO2﹤CH4﹤He﹤H219.在一个化学反应中,如果断裂化学键所吸收的能量大于形成化学键所释放的能量,下面关于此反应的叙述一定正确的是:(A) 反应吸热(B) 反应放热(C) 反应自发(D) 反应非自发20.把-10℃下的5g冰转变成15℃的液态水需要吸收的热量是多少?(假设比热容和温度无关)(A) 4.2×102J (B) 2.1×103J (C) 9.3×103J (D) 3.8×104J21.如果C2H4的标准燃烧焓为-1411KJ·moL-1,则它的标准生成焓为多少?(A) 1411 KJ·moL-1(B)51 KJ·moL-1 (C)-337 KJ·moL-1(D)-445 KJ·moL-122.在水的三相点,下面关于它的固态、液态和气态熵值的比较哪个是正确的?(A) Sоsolid﹤Sоliquid﹤Sоgas(B) Sоsolid = Sоliquid﹤Sоgas(C) Sоgas﹤Sоsolid﹤Sоliquid(D) Sоsolid = Sоliquid = Sоgas23.“一种完美的晶态物质在绝对零度时其熵值为零”是关于下面____的叙述。
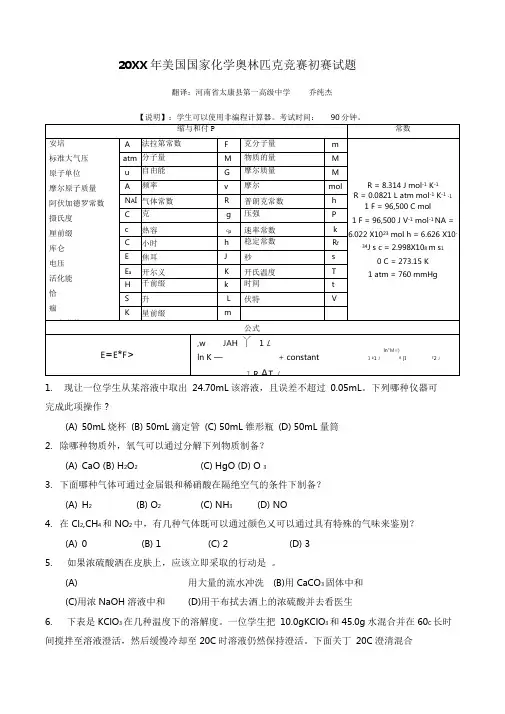
20XX年美国国家化学奥林匹克竞赛初赛试题翻译:河南省太康县第一高级中学乔纯杰【说明】:学生可以使用非编程计算器。
考试时间:90分钟。
1.现让一位学生从某溶液中取出24.70mL该溶液,且误差不超过0.05mL。
下列哪种仪器可完成此项操作?(A)50mL烧杯(B) 50mL滴定管(C) 50mL锥形瓶(D) 50mL量筒2.除哪种物质外,氧气可以通过分解下列物质制备?(A)CaO (B) H2O2 (C) HgO (D) O 33.下面哪种气体可通过金届银和稀硝酸在隔绝空气的条件下制备?(A)H2 (B) O2 (C) NH3 (D) NO4.在Cl2,CH4和NO2中,有几种气体既可以通过颜色乂可以通过具有特殊的气味来鉴别?(A)0 (B) 1 (C) 2 (D) 35.如果浓硫酸洒在皮肤上,应该立即采取的行动是。
(A)用大量的流水冲洗(B)用CaCO3固体中和(C)用浓NaOH溶液中和(D)用干布拭去洒上的浓硫酸并去看医生6.下表是KClO3在几种温度下的溶解度。
一位学生把10.0gKClO3和45.0g水混合并在60C 长时间搅拌至溶液澄活,然后缓慢冷却至20C时溶液仍然保持澄活。
下面关丁20C澄清混合物的叙述哪一个是正确的?(A)是饱和溶液 (B)是不饱和溶液,可以通过降温制得饱和溶液(C)是不饱和溶液,可以通过升温制得饱和溶液(D)是过饱和溶液7. 将65.25gCuSC 4 5H 2O( M=249.7)样品溶丁足量水中制得 0.800L 溶液。
要制得1.00L0.100M 的溶液必须用多大体积的这种溶液加水稀释?(A) 3.27mL(B) 81.6mL(C) 209mL(D) 306mL8. 燃烧2.2g C 3H 8生成CO 2和H 2O 需要几摩尔。
2?(A) 0.050 (B) 0.15(C) 0.25(D) 0.509.在杂货店买的一种独特的聚乙烯包重 12.4 g 必须由多少个乙烯(C 2H 4)分子聚合才能做成 这样一个包?(A) 1.36 t024(B) 6.02 1023(C) 5.33 1023(D) 2.67 102310. 用已知浓度的NaOH 溶液滴定某一元酸,在达到等当点时,下列哪组量是相等的?(A) OH -和H +的浓度(B) 原一元酸中H +的物质的量与加入的OH -的物质的量 (C) 原一元酸溶液的体积与加入的 NaOH 溶液的体积 (D) 原一元酸的物质的量与加入的 OH -的物质的量11. 当难挥发溶质溶丁易挥发的溶剂中时,下面哪种性质高丁原溶剂?(A)沸点 (B)熔点 (C)挥发速率(D)蒸汽压12. 100 mL 0.200M HNO 3溶液和200mL0.100M 的Mg(NO 3)2溶液混合后,溶液中 NO 3-的浓 度是多少?(A) 0.113M(B) 0.150M(C) 0.167M(D) 0.200M13. 从气体到固体的相变叫做什么?(A)凝华(B)蒸发(C)聚合 (D)升华14. 某气体样品在345K 和1.40atm 时的体积为9.23L,则在525K 和3.20atm 时的体积为多大?1 02 03 04 05 06 07 08 09 0温度,Cooo OO 5 4 3 2 1 O2H 0801 / np 度解溶(B) 6.14L (C) 13.9L (D) 32.1L (A) 2.65L15. 下歹U 哪种物质的色散力最强?(A) H 2O(B)H 2S(C) H 2Se(D) H 2Te16. 当物质Si 、KCl 、CH 3OH 和C 2H 6按熔点由低到高的顺序排列时,下列正确的是哪个?(A) Si 、KCl 、CH 3OH 和 C 2H 6 (B) CH 3OH 、C 2H 6、Si 和 KCl (C) KCl 、Si 、C 2H 6和 CH 3OH(D) C 2H 6、CH 3OH 、KCl 和 Si17. 根据下面的信息判断,在-7.4C 和400mmHg 时Br 2的物理状态是什么?[三相点:-7.3C 和44mmHg ;液态密度:3.1g cm -3;固态密度:3.4g cm -3](A)仅以固态形式存在 (B)仅以液态形式存在(C)仅以液态和固态形式存在(D)以气态、液态和固态形式存在18. 在27C 和1atm 时,等质量的He 、H 2、CO 2和CH 4的混合气体中各种气体分子的速率比 较正确的是哪个?(A) He=H 2=CO 2=CH 4 (B) He< H 2< CO 2< CH 4 (C) H 2 v He< CH 4V CO 2(D) CO 2< CH 4V He< H 219. 在一个化学反应中,如果断裂化学键所吸收的能量大丁形成化学键所释放的能量,下面 关丁此反应的叙述一定正确的是:(A)反应吸热(B)反应放热(C) 反应自发 (D)反应非自发把-10C 下的5g 冰转变成15C 的液态水需要吸收的热量是多少?(假设比热容和温度无__2_ __3_3_ _ _ _4(A) 4.2t02J (B) 2.1 1)03J(C) 9.3 103J (D) 3.8 t04J如果C 2H 4的标准燃烧焰为-1411KJ moL -1,则它的标准生成焰为多少?(A) 1411 KJ moL -1(B)51 KJ moL -1(C)-337 KJ moL -1(D)-445 KJ moL-1在水的三相点,下面关丁它的固态、液态和气态嫡值的比较哪个是正确的?(A) S Zolid V S liquid < S%as(B) S°solid = S liquid < S%as20.21. 22. 23.(C) S ga^< S solid < S°liquid(D) S%olid = S°liquid = S%as」种完美的晶态物质在绝对零度时其嫡值为零”是关丁下面的叙述。

第一题单项选择题(共25题)1 .下列化合物,在NaOH 溶液中溶解度最大的是 ( ) [A]. PbCrO4 [B] . Ag2CrO4 [C] . BaCrO4 [D] . CaCrO4 2 .向酸性K2Cr2O7溶液中加入 H2O2,却未观察到蓝色物质生成, 其原因肯定是( [A].未加入乙醚,因 CrO5与乙醚的加合物为蓝色 [B].未加入戊醇,因 醇中显蓝色 [C].未将溶液调至碱性,因 或)H2O2浓度过稀 3 .实验室配制洗液,最好的方法是 ( [A].向饱和 K2Cr2O7溶液中加入浓硫酸 ) CrO5萃取到戊 CrO5在酸性介质中分解 [D].因K2Cr2O7 (和/ ) [B].将 K2Cr2O7溶于热的浓硫酸 [C].将 K2Cr2O7溶于1 : 1硫酸[D].将 K2Cr2O7与浓硫酸共热 4 .滴加0.1mol -L-1 CaCl2溶液没有沉淀生成,再滴加氨水有白色沉淀生成, 该溶液是() [A] . Na3PO4 [B] . Na2HPO4 [C] . NaH2PO45 .从滴瓶中取少量试剂加入试管的正确操作是 ( [A].将试管倾斜,滴管口贴在试管壁,再缓慢滴入试剂 口约半厘米处缓慢滴入试剂[D].以上三种溶液均可 ) [B].将试管倾斜,滴管口距试管 [C].将试管垂直,滴管口伸入试管内半厘米再缓慢滴入试剂 [D].将试管垂直,滴管口贴在试管壁,再缓慢滴入试剂 6 .制备下列气体时可以使用启普发生器的是( ) [A].高锰酸钾晶体与盐酸反应制氯气 [B].块状二氧化锰与浓盐酸反应制氯气 碳酸钾与盐酸反应制二氧化碳 [D].块状硫化亚铁与稀硫酸反应制备硫化氢 7 .实验室用浓盐酸与二氧化锰反应制备氯气,欲使氯气纯化则应依次通过 [A].饱和氯化钠和浓硫酸 [B].浓硫酸和饱和氯化钠 [C].氢氧化钙固体和浓硫酸 和氯化钠和氢氧化钙固体 8 .使用煤气灯涉及的操作有: ①打开煤气灯开关;②关闭空气入口;③擦燃火柴; 燃煤气灯;⑤调节煤气灯火焰。

化学竞赛试题及答案第一题单项选择题(共25题)1 .下列化合物,在NaOH 溶液中溶解度最大的是 ( ) [A]. PbCrO4 [B] . Ag2CrO4 [C] . BaCrO4 [D] . CaCrO4 2 .向酸性K2Cr2O7溶液中加入 H2O2,却未观察到蓝色物质生成,其原因肯定是( [A].未加入乙醚,因 CrO5与乙醚的加合物为蓝色[B].未加入戊醇,因醇中显蓝色[C].未将溶液调至碱性,因或)H2O2浓度过稀 3 .实验室配制洗液,最好的方法是 ( [A].向饱和 K2Cr2O7溶液中加入浓硫酸 ) CrO5萃取到戊 CrO5在酸性介质中分解 [D].因K2Cr2O7 (和/ ) [B].将 K2Cr2O7溶于热的浓硫酸 [C].将K2Cr2O7溶于1 : 1硫酸[D].将 K2Cr2O7与浓硫酸共热 4 .滴加0.1mol -L-1 CaCl2溶液没有沉淀生成,再滴加氨水有白色沉淀生成,该溶液是() [A] . Na3PO4 [B] . Na2HPO4 [C] . NaH2PO45 .从滴瓶中取少量试剂加入试管的正确操作是 ( [A].将试管倾斜,滴管口贴在试管壁,再缓慢滴入试剂口约半厘米处缓慢滴入试剂[D].以上三种溶液均可) [B].将试管倾斜,滴管口距试管[C].将试管垂直,滴管口伸入试管内半厘米再缓慢滴入试剂[D].将试管垂直,滴管口贴在试管壁,再缓慢滴入试剂6 .制备下列气体时可以使用启普发生器的是( ) [A].高锰酸钾晶体与盐酸反应制氯气 [B].块状二氧化锰与浓盐酸反应制氯气碳酸钾与盐酸反应制二氧化碳[D].块状硫化亚铁与稀硫酸反应制备硫化氢7 .实验室用浓盐酸与二氧化锰反应制备氯气,欲使氯气纯化则应依次通过 [A].饱和氯化钠和浓硫酸 [B].浓硫酸和饱和氯化钠[C].氢氧化钙固体和浓硫酸和氯化钠和氢氧化钙固体8 .使用煤气灯涉及的操作有:①打开煤气灯开关;②关闭空气入口;③擦燃火柴;燃煤气灯;⑤调节煤气灯火焰。

1992年第24届国际化学奥林匹克竞赛理论试题注意事项(1) 当监考人员将“开始(start)”写在黑板上后才开始答题。
(2) 请用黑色笔(黑墨水笔或黑圆珠笔)答题。
(3) 请在每页答卷的右上角写上你的参赛编号。
(4) 请将计算过程和答案写在每题后面的空白处,勿写在纸的反面。
若需另页,可向监考人员索取。
原子量:H-1 C-12 N-14 O-16 Na-23 Si-28 P-30 S-32 Cl-35.5 K-39 Ca-40 Cr-52 Fe-56 Ag-108 物理常数:R=8.314J·mol-1· K-1=8.314m3 Pa mol-1K-1 F=96486C·mol-11.硅藻(一种微生物)是海洋中丰富的食物来源,它们通过CO2和水的光合作用产生碳水化合物(即醣):6CO2+6H2O+太阳能→C6H12O6+6O2a) 蓝鲸靠捕食一种称之为“Krill”的小鱼生长,在其头5年的生长期内体重每天增加75kg。
鲸每天吃掉的小鱼量是它自身体重增加量的10.0倍。
而小鱼(Krill)需吃掉10.0kg硅藻才增加1.0kg体重。
假定鲸在头5年内体重的增加完全是由于消耗硅藻碳水化合物,则为提供给该鲸在头5年内生长中所需要的硅藻碳水化合物,硅藻要消耗多少升CO2(0℃、1.0atm)?b)i) 在24℃和1.0atm下,每升海水溶解0.23mlCO2,若硅藻能从水中把CO2全部除去,则必须处理多大体积的水才能产生蓝鲸在5年内所需要的碳水化合物?ii) 假如海水的总体积是1.37×1018m3。
1000头蓝鲸在5年生长中所消耗的CO2(这些CO2是硅藻用来产生碳水化合物的)应该由这一总体积的百分之多少的水来溶解?c) 成年鲸质量的3%是氮。
质量为9.1×104kg的鲸死亡后所产生的NH4+的最大质量是多少(这些NH4+可为水生物利用)?d) 鲸的质量的18%是碳。

2015年美国高中化学奥林匹克竞赛初赛试题中文译文乔纯杰1.1.0 mol 苯完全燃烧消耗氧气的物质的量是多少?(A) 6.0 mol (B) 7.5 mol (C) 9.0 mol (D) 12 mol2.10.00 g 某钡盐溶液,加入过量硫酸钠溶液得到11.21 g BaSO4 (M = 233.4) 沉淀。
则这种钡盐是什么?(A) BaCl2 (M = 208.2) (B) Ba(OOCH)2 (M = 227.3) (C) Ba(NO3)2 (M = 261.3) (D) BaBr2 (M = 297.1) 3.在425 mL含有32.0 g Mg(NO3)2 (M = 148.3)的溶液中,硝酸根离子的浓度是多少?(A) 0.216 mol/L (B) 0.432 mol/L (C) 0.508 mol/L (D)1.02 mol/L4.磷酸铽的化学式为TbPO4. 则硫酸铽的化学式是(A) Tb2SO4(B) TbSO4 (C) Tb2(SO4)3(D)Tb(SO4)25.25.0 mL 0.15 mol/L AgNO3溶液和3.58 g CaCl2 (M = 111.0)反应。
下面叙述正确的是哪个?(A) AgNO3不足,生成Ca(NO3)2沉淀(B) AgNO3不足,生成AgCl沉淀(C) Ca(NO3)2不足,生成Ca(NO3)2沉淀(D) Ca(NO3)2不足,生成AgCl沉淀6.下面哪种溶液的凝固点降低程度最大(质量摩尔浓度(mB))表示,即溶质的物质的量/溶剂的物质的量。
B为溶质,m即mol/Kg。
)?(A) 1.0 m KBr (B) 0.75 m C6H12O6 (C) 0.5 m MgCl2(D)0.25 m Ga2(SO4)37.下面哪种含钙化合物在0.1 mol/LHCl中的溶解度小于在纯水中的溶解度?(A) 石灰石, CaCO3(B) 熟石灰, Ca(OH)2(C) 石膏, CaSO4• 2 H2O (D) 羟基磷灰石, Ca5(OH)(PO4)3 8.下面哪种金属在25 °C与水反应最剧烈?(A) Na (B) Mg (C) K (D) Ca9.下面物质的水溶液除了都有颜色。
2021美国国家化学奥林匹克化学竞赛初试试题整篇试题包括60道单项选择题,学生能够使用非编程运算器。
试题第二页提供了元素周期表和一些有用的信息考试时刻:60题——110分钟缩写和符号:ERT nF -1.将6M的盐酸滴加到一种未知的白色固体上产生无色气体。
这种白色固体可能是什么?(A) 硝酸钙(B) 氯化铜(C) 硫酸钾(D) 碳酸钙2.碘固体在大气中加热第一发生什么变化?(A) 固体熔化(B) 固体升华(C) 分解成原子(D) 颜色变深3.两种纯洁的有机物分别在112°C和114°C熔化,请问,当两种物质等量混合后,混合物的熔点是多少?(A) 低于112°C(B) 正好112°C(C) 在112°C和114°C之间(D) 高于114°C4.什么缘故在气压计中使用的是水银(而不是水)?(A) 水银密度比水大得多(B) 水银沸点比水高(C) 水银的化学活性比水小(D) 水银在气压降低时扩散开来,而水相反5.下列两种固体各0.1g,氯化铅和氯化银,如何将它们鉴别开来?(A) 分别加入`10mL冷水,AgCl溶解(B) 分别加入10mL热水,PbCl2溶解(C) 分别加入10mL NaCl溶液,PbCl2会变热同时开释出氯气(D) 分别加入10mL氯化锌溶液,AgCl溶液会变成金属银6.下列各图中哪个是加热液体的正确方法?7.一个水分子的质量是多少克?(A) 18(B) 1.1⨯10-21 (C) 3.0⨯10-23(D) 1.7⨯10-248.如图,假如说图中实心小球是N 2,空心小球是O 2,那么这些 气体混合物能够反应生成多少分子NO 2(A) 4分子 (B) 5分子(C) 6分子 (D) 8分子9.一种只含有硫化亚铁一种硫化物的矿石,与过量盐酸反应制备硫化氢。
假如3.15g 矿石产生了448mL 硫化氢气体(S.T.P.),问矿石中硫化亚铁的质量百分数是多少?(A) 20.4 (B) 35.5 (C) 55.8 (D) 71.010.天然铊有两种稳固同位素,Tl-203和Tl205(原子量分别为203.0和205.0),铊的相对原 子质量是204.4。
全国化学竞赛(初赛)试题与答案2022年年全国化学竞赛(初赛)试题第1 题(14 分)1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
( 1)画出EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
2) Ca(EDTA) 2溶液可用于静脉点滴以排除体内的铅。
写出这个排铅反应的化学方程式(用Pb2+表示铅)。
3)能否用EDTA 二钠盐溶液代替Ca(EDTA) 2溶液排铅?为什么?1-2 氨和三氧化硫反应得到一种晶体,熔点205o C ,不含结晶水。
晶体中的分子有一个三重旋转轴,有极性。
画出这种分子的结构式,标出正负极。
1-3 Na2[Fe(CN)5(NO)] 的磁矩为零,给出铁原子的氧化态。
Na2[Fe(CN) 5(NO)] 是鉴定S2的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
111-4 CaSO4 ? 2H2O 微溶于水,但在HNO 3 ( 1 mol L 1)、HClO 4 ( 1 mol L 1)中可溶。
写出能够解释CaSO4 在酸中溶解的反应方程式。
11-5 取质量相等的2 份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3mol L 1) 和HClO4 ( 3 mol L 1),充分混合,PbSO4在HNO3 能全溶,而在HClO 4中不能全溶。
简要解释PbSO4在HNO 3 中溶解的原因。
1-6 X 和Y 在周期表中相邻。
CaCO3 与X 的单质高温反应,生成化合物 B 和一种气态氧化物;B 与Y 的单质反应生成化合物 C 和X 的单质; B 水解生成D;C 水解生成E,E 水解生成尿素。
确定B、C、D、E、X 和Y。
第2题(5 分) 化合物X 是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。
年产量达300 万吨的氯酸钠是生产X 的原料,92%用于生产X ―在酸性水溶液中用盐酸、二氧化硫或草酸还原。
此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X。
化学竞赛试题精选3及答案班级 ___________ 姓名__________1.将amLO.lmol/L硫酸铝溶液与bmL0.5mol/L氢氧化钠溶液混合,得到cmol氢氧化铝沉淀,若已知a、b、c中任意两个值,求另一个值,所求的值不止一个解的是(各选项中,单位均略去不写)---------------------- [B]A、a=100 b=90 c=?B、a=100 c=0.015 b=?C、b=90 c=0.015 a=?D、a=75 c=0.015 b=?2.已知氯酸钾与蔗糖反应的产物为KC1、CO?和水,则氧化产物与还原产物的物质的量之比为----------------------------------------------- [A]A、3: 2B、2: 3C、8: 1D、11: 83.已知NaHS、MgSO4, NaHSO3组成的混和物中,硫元素的质量分数为a%,则混和物中氧元素的质量分数为--------------------------------- [C]A、a%B、2a%C、1-0.0175aD、1-0.0075a 出提示』:“NaH”与“Mg”的式量相等4.钠盐和钾盐性质相似,但在很多生产实际中多用钾盐而不用钠盐,如实验室制氧气是用KC1O3而不是用NaClO3,制黑火药用KNO3而不用NaNO3,并且在KNO3中不能含有NaNO3,以下各种理由合理的是--------------------- [D]A、钾盐比钠盐更容易得到B、钾盐的氧化性比钠盐强C、钾盐的熔点比钠盐高D、钠盐的吸湿性比钾盐强5.已知人体内血液的PH值总是维持在7.35-7.45范围内,引起这种现象的主要原因是[D]A、人体内有大量的水(约占正常人体重的70%)B、新陈代谢产生的二氧化碳溶解在血液中C、新陈代谢产生的酸、碱物质以等物质的量溶解在血液中D、血液中的HCO亍与H2CO3的浓度只允许保持在一定的比例范围1提示兀需向学生介绍缓冲溶液的知识6.粗食盐的主要杂质是MgCb。
化学竞赛2021真题试卷一、选择题(每题2分,共20分)1. 以下哪种元素的原子序数是26?A. 铁(Fe)B. 钴(Co)C. 镍(Ni)D. 铜(Cu)2. 根据元素周期律,同一周期内,从左到右原子半径的变化趋势是?A. 逐渐增大B. 逐渐减小C. 先增大后减小D. 无规律变化3. 以下哪个化合物属于共价化合物?A. NaClB. CaOC. H2OD. Fe3O44. 酸碱中和反应的实质是?A. 酸中的氢离子与碱中的氢氧根离子结合生成水B. 酸中的氢离子与碱中的氢离子结合生成氢气C. 酸中的氢离子与碱中的氢氧根离子结合生成盐D. 酸中的氢离子与碱中的氢氧根离子结合生成水和盐5. 以下哪个反应是氧化还原反应?A. 2H2O + CO2 → 2H2CO3B. 2H2 + O2 → 2H2OC. 2NaOH + H2SO4 → Na2SO4 + 2H2OD. CaCO3 → CaO + CO26. 根据化学平衡原理,以下哪个条件可以促使平衡向正反应方向移动?A. 增加反应物浓度B. 减少生成物浓度C. 升高温度D. 降低温度7. 以下哪个是电解质?A. 金属铜B. 蒸馏水C. 氯化钠D. 酒精8. 以下哪种物质是强酸?A. 醋酸B. 碳酸C. 硫酸D. 磷酸9. 以下哪个是弱碱?A. 氢氧化钠B. 氢氧化钾C. 氢氧化钙D. 氢氧化铵10. 以下哪种物质是强氧化剂?A. 氢气B. 氧气C. 一氧化碳D. 二氧化碳二、填空题(每空2分,共20分)11. 化学方程式书写的四个步骤是:______、______、______、______。
12. 根据化学键的类型,物质可以分为______、______、______。
13. 原子结构中,电子云密度最大的地方位于______。
14. 根据反应物和生成物的种类,化学反应可以分为______、______、______、______。
15. 根据电子的排布规律,最外层电子数不超过______个。
2023年化学竞赛(CSC)初赛试题详解
本文旨在详细解析2023年化学竞赛(CSC)初赛试题,以下
是题目的详细解析:
题目一
题目一要求考生解答关于化学反应速率的问题。
在本题中,考
生需要理解化学反应速率的概念,并能够根据反应物浓度的变化情
况推断反应速率的变化趋势。
对于这一类问题,考生可以通过绘制
反应物浓度与时间的曲线图,然后观察曲线的斜率来判断反应速率
的变化趋势。
题目二
题目二涉及到化学平衡和酸碱反应的知识。
考生需要理解化学
平衡的条件以及平衡常数的概念,并能够解答关于酸碱中性化反应
的问题。
对于这一类问题,考生可以先使用化学方程式写出反应式,然后根据反应式中的物质的摩尔比例来计算反应物的消耗量和生成
物的产生量。
题目三
题目三考察了有机化合物的结构和命名。
考生需要熟悉有机化
合物的命名规则,并能够根据化学结构式来确定化合物的命名。
对
于这一类问题,考生可以按照有机化学的命名规则来逐步分析化合
物的结构,然后选择正确的命名。
以上是本文对2023年化学竞赛(CSC)初赛试题的详细解析。
希望考生能够加强对化学知识的掌握,并在考试中取得好成绩。
参考资料:
- 《化学竞赛教程》
- 《化学基础知识教程》
- 《有机化学导论》。