硫酸亚铁铵的制备及组成测定
- 格式:doc
- 大小:2.25 MB
- 文档页数:19


硫酸亚铁铵的制备实验报告完整版实验目的:1.掌握反应条件下硫酸铵和亚铁盐反应生成硫酸亚铁铵的方法。
2.了解硫酸亚铁铵的性质和用途。
实验原理:2NH4OH+FeSO4→(NH4)2SO4+Fe(OH)2↓Fe(OH)2+H2SO4→FeSO4+2H2O(NH4)2SO4+FeSO4→(NH4)2Fe(SO4)2↓实验仪器和试剂:仪器:烧杯、玻璃棒、试管、热水浴、磁力搅拌器。
试剂:浓硫酸、硫酸铵、亚铁盐。
实验步骤:1.取一只烧杯,称取适量的硫酸铵和亚铁盐,加入烧杯中。
硫酸铵和亚铁盐的摩尔比为2∶12.在烧杯中加入少量蒸馏水,以便将试剂全部溶解。
3.将烧杯放入热水浴中,用磁力搅拌器不断搅拌溶液,保持水温在60-70℃之间,加快反应速度。
4.溶液开始沉淀后,继续保持搅拌和加热条件,直至无明显沉淀生成。
5.关闭热水浴,取出烧杯,使溶液冷却至室温。
6.将溶液过滤,收集沉淀。
7.用蒸馏水洗涤沉淀几次,使产品纯净。
8.将沉淀置于通风处,使其完全干燥。
9.称取干燥的产物,记录质量。
实验数据和结果分析:根据反应方程式可知,1 mol硫酸铵和0.5 mol亚铁盐反应可以生成1 mol硫酸亚铁铵。
假设硫酸铵和亚铁盐的质量均为m,则可推算出硫酸亚铁铵的理论产量为2m。
实验条件下,取硫酸铵和亚铁盐的质量分别为1.5g和0.75g。
经过实验反应,获得硫酸亚铁铵的实际产量为1.9g。
计算得出:实验产率=实际产量/理论产量×100%=1.9g/(2×1.5g)×100%≈63.3%移液记录:记录表明,在实验过程中,实验者需要准确记录使用的试剂质量、反应温度、时间等重要参数,以便对实验结果进行分析和讨论。
实验安全注意事项:1.实验中使用浓硫酸等腐蚀性试剂时,需要佩戴防护眼镜和实验服,防止化学物质对人体造成伤害。
2.实验过程中,需要注意对实验仪器和玻璃器皿的正确使用和保养,以防发生意外破损。
3.实验过程中的火源需要远离实验区,以防发生火灾。


硫酸亚铁铵的制备、三草酸合铁(Ⅲ)酸钾的合成、组成测定及配离子电荷数的测定北京石油化工学院化学工程学院化XXX班XXX二〇XX年五月硫酸亚铁铵的制备、三草酸合铁(Ⅲ)酸钾的合成、组成测定及配离子电荷数的测定XXX(北京石油化工学院化学工程学院,北京102600)摘要:实验首先以铁屑、硫酸及硫酸铵为原料,利用同温度下复盐的溶解度比组成它的简单盐的溶解度小的特点制备硫酸亚铁铵。
再用硫酸亚铁铵及草酸和草酸钾为原料合成三草酸合铁(Ⅲ)酸钾。
最后用重量分析法、氧化还原滴定法及离子选择性电极对三草酸合铁(Ⅲ)酸钾进行组成分析,配离子电荷数测定。
实验结果表明:称取2.0g铁屑制得硫酸亚铁铵10.5g,理论产量14.00g,产率75.00%;再用制备的硫酸亚铁铵5.0g制得三草酸合铁(Ⅲ)酸钾5.2g,理论产量6.26g,产率83.06%。
最后用0.01134mol/L的高锰酸钾标准溶液测定由1.1475g 样品溶于250mL去离子水配制的试液,测得C2O42-与Fe3+的摩尔比为3.85∶1,与理论值3∶1比较并分析误差;用离子交换法处理0.5002g样品并用离子选择性电极间接测得样品中三草酸合铁(Ⅲ)配离子电荷数为2.48,与理论值3比较并分析误差。
关键词:硫酸亚铁铵,三草酸合铁(Ⅲ)酸钾,合成,组成分析硫酸亚铁铵,俗称莫尔盐(Mohr` salt),化学式为(NH4)2SO4·FeSO4·6H2O,浅绿色单斜晶体,溶于水,不溶于乙醇。
在空气中比较稳定,不像一般亚铁盐易被氧化,因此在分析化学中常被用作还原试剂,可以用来测定高锰酸钾、重铬酸钾等溶液的浓度,广泛的应用于医药、冶金及电镀等方面。
本实验用(NH4)2SO4和FeSO4等物质的量混合制得:(NH4)2SO4+FeSO4+6H2O =(NH4)2SO4·FeSO4·6H2O三草酸合铁(Ⅲ)酸钾,化学式为K3[Fe(C2O4)3]·3H2O,翠绿色晶体,溶于水,难溶于乙醇。

硫酸亚铁铵的制备实验报告
实验目的:硫酸亚铁铵是一种常用的分析试剂和有机合成试剂,在医药、化妆品和农业等领域中有广泛的应用。
本实验旨在通过反应原料的适当选择和实验条件的控制,制备出纯度较高的硫酸亚铁铵。
实验原理:
FeSO4+(NH4)2SO4+H2SO4→(NH4)2Fe(SO4)2·6H2O
实验步骤:
1.取一只干净的烧杯,称取适量的硫酸亚铁(FeSO4)固体,称量准确。
2.将称取的硫酸亚铁固体加入烧杯中,加入适量的硫酸铵
((NH4)2SO4)固体,控制比例。
3.在烧杯中缓慢加入浓硫酸(H2SO4),注意搅拌和温度控制。
4.继续搅拌直至反应完全进行,并出现混合物的特征颜色,此时停止搅拌。
5.将制备好的混合物过滤,收集溶液。
6.将溶液冷却至室温,结晶出硫酸亚铁铵。
7.用冷蒸馏水洗涤结晶物,以去除杂质。
8.用纸巾等吸去结晶物的水分,放置在通风处自然晾干。
实验结果:
经过制备得到的硫酸亚铁铵呈现出良好的结晶性质,结晶物质呈现出蓝绿色的颜色。
实验讨论:
1.实验中应严格控制反应物的比例和实验室条件,以提高硫酸亚铁铵的纯度。
2.实验过程中应注意搅拌均匀,避免结晶物表面的杂质。
3.结晶物的洗涤过程应尽量使用冷蒸馏水,以降低杂质的溶解度。
4.实验操作中应做好个人防护,避免与反应物接触眼睛或皮肤。
结论:
本实验成功制备出纯度较高的硫酸亚铁铵。
制备过程中需要严格控制反应物的比例和实验条件,以提高产品的纯度。
实验结果显示,通过适当的反应条件和操作技巧,可以获得良好的结晶性质和纯度较高的硫酸亚铁铵。


一、实验目的1. 学习利用溶解度差异制备硫酸亚铁铵。
2. 掌握硫酸亚铁和硫酸亚铁铵复盐的性质。
3. 熟练操作水浴加热、过滤、蒸发、洗涤等基本实验技能。
4. 学习pH试纸、吸管、比色管的使用。
5. 学习用目测比色法检验产品质量。
二、实验原理硫酸亚铁铵,化学式为(NH4)2Fe(SO4)2·6H2O,俗称莫尔盐,是一种浅绿色晶体。
本实验通过铁屑与稀硫酸反应生成硫酸亚铁,再与硫酸铵反应生成溶解度较小的硫酸亚铁铵。
实验过程中,通过控制反应条件,使硫酸亚铁铵结晶析出。
三、实验仪器与药品1. 仪器:洗瓶、烧杯、锥形瓶、移液管、量筒、吸滤瓶、比色管、比色架、铁粉、盐酸、硫酸、蒸馏水。
2. 药品:硫酸亚铁、硫酸铵、KSCN溶液、FeCl3溶液。
四、实验步骤1. 硫酸亚铁的制备:- 取一定量的铁屑,加入适量的稀硫酸,搅拌均匀。
- 将混合液置于水浴中加热,保持微沸状态。
- 水浴加热过程中,不断搅拌,使反应充分进行。
- 加热至溶液变为浅绿色,表示硫酸亚铁已生成。
- 趁热过滤,去除杂质。
2. 硫酸亚铁铵的制备:- 将过滤后的硫酸亚铁溶液与等物质的量的硫酸铵溶液混合。
- 将混合液置于水浴中加热,保持微沸状态。
- 加热过程中,不断搅拌,使反应充分进行。
- 当溶液中出现结晶膜时,停止加热。
- 将混合液缓慢冷却,使硫酸亚铁铵结晶析出。
3. 硫酸亚铁铵的纯度检验:- 将所得硫酸亚铁铵晶体与KSCN溶液配制成待测溶液。
- 将待测溶液与标准溶液在比色管中配制成相同体积的溶液。
- 将两溶液在比色架下比较,观察红色深浅程度。
- 根据红色深浅程度,判断硫酸亚铁铵的纯度。
五、实验结果与分析1. 硫酸亚铁的制备:- 通过水浴加热,铁屑与稀硫酸反应生成硫酸亚铁。
- 反应过程中,溶液逐渐变为浅绿色,表示硫酸亚铁已生成。
2. 硫酸亚铁铵的制备:- 通过硫酸亚铁与硫酸铵的反应,生成溶解度较小的硫酸亚铁铵。
- 水浴加热过程中,溶液中出现结晶膜,表示硫酸亚铁铵开始结晶。


硫酸亚铁铵的制备及组成测定硫酸亚铁铵的制备及组成测定一、实验目的1.学习制备复盐(NH4)2SO4·FeSO4·6H2O的制备方法和实验条件。
2.熟练掌握水浴加热、过滤、蒸发、结晶等基本无机制备操作。
3.学习制备无机化合物有关投料、产率、产品限量分析等的计算方法。
4.掌握测定硫酸亚铁铵中各组分的的原理与方法。
二、实验原理1.硫酸亚铁铵的制备硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O)商品名为莫尔盐,为浅蓝绿色单斜晶体。
一般亚铁盐在空气中易被氧化,而硫酸亚铁铵在空气中比一般亚铁盐要稳定,不易被氧化,并且价格低,制造工艺简单,容易得到较纯净的晶体,因此应用广泛。
在定量分析中常用来配制亚铁离子的标准溶液。
和其他复盐一样,(NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成它的每一组分FeSO4或(NH4)2SO4的溶解度都要小。
利用这一特点,可通过蒸发浓缩FeSO4与(NH4)2SO4溶于水所制得的浓混合溶液制取硫酸亚铁铵晶体。
三种盐的溶解度数据列于表1。
表1 三种盐的溶解度(单位为g /100g H 2O)本实验先将铁屑溶于稀硫酸生成硫酸亚铁溶液:Fe+H 2SO 4 FeSO 4+H 2↑将溶液浓缩后冷却至室温,可得晶体FeSO 4·7H 2O (俗称绿矾)。
再将等摩尔的硫酸亚铁和硫酸铵溶液混合,并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶解度较小的硫酸亚铁铵晶体,它的氧化还原稳定性比一般的亚铁盐高,常作为亚铁试剂使用。
FeSO 4+(NH 4)2SO 4+6H 2O(NH 4)2SO 4·FeSO 4·6H 2O用目视比色法可估计产品中所含杂质Fe 3+的量。
Fe 3+与SCN -能生成红色物质[Fe (SCN )]2+,红色深浅与Fe3+相关。
将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准[Fe (SCN)]2+溶液的红色进行比较,确定待测溶液中杂质Fe3+的含量范围,确定产品等级。

实验二十四硫酸亚铁铵制备及组成分析实验目的:1.了解硫酸亚铁铵的制备方法;2.了解如何通过化学方法分析硫酸亚铁铵的组成。
实验器材和试剂:1.硫酸亚铁(FeSO4·7H2O);2.氨水(NH3·H2O);3.浓硫酸(H2SO4);4.蒸馏水;5.烧杯、容量瓶、滴定管、玻璃棒等常用实验器材。
实验步骤:1.称取一定质量的硫酸亚铁固体(FeSO4·7H2O),放入烧杯中;2.加入适量的蒸馏水搅拌溶解;3.将溶解的硫酸亚铁溶液转移到容量瓶中,加入适量的蒸馏水稀释至刻度线;4.取一小部分稀硫酸(H2SO4)滴入硫酸亚铁溶液中,用玻璃棒搅拌均匀;5.逐滴加入氨水(NH3·H2O),搅拌至溶液颜色由浅绿变为深绿,停止滴加;6.用酚酞指示剂滴加到溶液呈现淡红色,并保持该颜色;7.将溶液转移到滴定管中,进行氨水滴定,记录滴定的终点。
实验原理与反应方程:硫酸亚铁铵的制备反应方程式如下:FeSO4+2NH3→Fe(NH4)2SO4实验中,硫酸亚铁和氨水在适宜的反应条件下反应,生成硫酸亚铁铵。
滴定终点为溶液从淡红色变为无色。
实验注意事项:1.实验过程中需佩戴安全眼镜,避免溶液溅入眼睛;2.硫酸亚铁、氨水和硫酸为有毒物质,操作时需注意安全;3.实验中需将实验器材彻底清洗干净,避免实验污染。
组成分析:硫酸亚铁铵的组成可以通过氨水滴定的结果来进行分析。
滴定时,硫酸亚铁溶液中的硫酸亚铁会被氨水滴定至终点,滴定的计量就是硫酸亚铁溶液中硫酸亚铁的含量。
在滴定过程中,硫酸亚铁溶液呈现淡红色的是由于酚酞的指示剂所致。
通过氨水滴定的结果,可以计算出硫酸亚铁铵中硫酸亚铁的质量比例,进而得到硫酸亚铁铵的组成。
例如,如果滴定结果为20mL,滴定液的浓度为0.1mol/L,那么硫酸亚铁的质量为20×0.1×(Molar Mass of FeSO4)。
总结:本实验主要介绍了硫酸亚铁铵的制备方法以及通过氨水滴定分析硫酸亚铁铵的组成。
硫酸亚铁铵的制备和纯度分析一、硫酸亚铁铵的制备:1.准备所需试剂:硫酸亚铁(FeSO4)和氨水(NH3·H2O)。
2.将硫酸亚铁溶解于适量水中,得到一定浓度的硫酸亚铁溶液。
3.在混合搅拌的条件下,缓慢滴加氨水溶液至硫酸亚铁溶液中,同时用玻璃棒搅拌均匀。
4.反应进行时,会观察到溶液由深绿色变为黄绿色,反应出现混浊,并伴有氨气的排放。
搅拌反应至气泡停止排放,反应物完全溶解。
5.反应结束后,将反应混合液过滤,去除杂质。
6.将过滤后的溶液放置静置一段时间,使晶体生成,并进行结晶干燥。
7.最后,用干燥剂密封保存。
二、硫酸亚铁铵的纯度分析:为了确保硫酸亚铁铵的纯度,一般可通过以下几个方面进行分析:1.外观检查:通过观察硫酸亚铁铵的外观颜色和形态,判断是否为草绿色晶体,无杂质。
2.盐酸滴定:取一定质量的硫酸亚铁铵样品,加入适量盐酸,用标准溶液滴定至橙黄色终点,计算出硫酸亚铁铵溶液中Fe(NH4)2(SO4)2的含量。
若含量与理论值相符,则说明硫酸亚铁铵纯度较高。
3.热重分析:将硫酸亚铁铵样品加热,分析其热分解温度、热分解产物等,判断样品纯度。
4.光谱分析:使用红外光谱仪或质谱仪等设备进行光谱分析,观察样品的吸收峰、质谱峰等,确定硫酸亚铁铵中化学键和分子结构,验证纯度。
总结:硫酸亚铁铵的制备和纯度分析是确保硫酸亚铁铵质量的重要步骤。
在制备过程中,需要根据反应条件和溶液的状态进行操作,确保反应物完全反应并获得纯净的晶体产物。
在纯度分析方面,可以通过外观检查、滴定、热重分析和光谱分析等方法进行定性和定量分析,验证硫酸亚铁铵的纯度。
这些分析手段互相配合,能够全面评估硫酸亚铁铵的纯度水平,保证其在实际应用中的可靠性和准确性。
硫酸亚铁铵的制备及组成测定硫酸亚铁铵的制备及组成测定一、实验目的1.学习制备复盐(NH4)2SO4·FeSO4·6H2O的制备方法和实验条件。
2.熟练掌握水浴加热、过滤、蒸发、结晶等基本无机制备操作。
3.学习制备无机化合物有关投料、产率、产品限量分析等的计算方法。
4.掌握测定硫酸亚铁铵中各组分的的原理与方法。
二、实验原理1.硫酸亚铁铵的制备硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O)商品名为莫尔盐,为浅蓝绿色单斜晶体。
一般亚铁盐在空气中易被氧化,而硫酸亚铁铵在空气中比一般亚铁盐要稳定,不易被氧化,并且价格低,制造工艺简单,容易得到较纯净的晶体,因此应用广泛。
在定量分析中常用来配制亚铁离子的标准溶液。
和其他复盐一样,(NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成它的每一组分FeSO4或(NH4)2SO4的溶解度都要小。
利用这一特点,可通过蒸发浓缩FeSO4与(NH4)2SO4溶于水所制得的浓混合溶液制取硫酸亚铁铵晶体。
三种盐的溶解度数据列于表1。
表1 三种盐的溶解度(单位为g /100g H 2O)本实验先将铁屑溶于稀硫酸生成硫酸亚铁溶液:Fe+H 2SO 4 FeSO 4+H 2↑将溶液浓缩后冷却至室温,可得晶体FeSO 4·7H 2O (俗称绿矾)。
再将等摩尔的硫酸亚铁和硫酸铵溶液混合,并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶解度较小的硫酸亚铁铵晶体,它的氧化还原稳定性比一般的亚铁盐高,常作为亚铁试剂使用。
FeSO 4+(NH 4)2SO 4+6H 2O(NH 4)2SO 4·FeSO 4·6H 2O用目视比色法可估计产品中所含杂质Fe 3+的量。
Fe 3+与SCN -能生成红色物质[Fe (SCN )]2+,温度/℃FeSO 4 (NH 4)2SO 4 (NH 4)2SO 4·FeSO 4·6H 2O1020.0 73 17.2 2026.5 75.4 21.6 30 32.9 78 28.1红色深浅与Fe3+相关。
2-3(1)硫酸亚铁铵的制备一、实验目的1、了解制备复盐的一种方法。
2、掌握无机制备的基本操作技术:水浴加热、减压过滤、蒸发结晶。
3、练习目视比色半定量分析方法。
二、实验原理1.硫酸亚铁铵的制备硫酸亚铁铵俗称摩尔盐,为浅绿色单斜晶体,其溶解度较小,易从浓的FeSO4和(NH4)2SO4混合液中结晶析出,制备原理如下:Fe + H2SO4 = FeSO4 + H2FeSO4 + (NH4)2SO4 + 6H2O = FeSO4·(NH4)2SO4 ·6H2O2. 目视比色法测定Fe3+的含量本实验测定产品中的Fe3+含量,是应用其与KSCN作用生成血红色的配合物:Fe3+ + nSCN- = Fe(SCN)n3-n可以根据其血红色的深浅,确定Fe3+的相对多少,将样品溶液与标准Fe3+系列溶液对比,确定产品级别。
三、实验器材及药品请同学们务必在实验结束后清洗干净,摆放整齐,方便下一个班级使用。
四、实验内容1. 硫酸亚铁铵的合成2. 目视比色Fe3+含量分析四、注意事项1.硫酸亚铁制备过程中,注意控制Fe与H2SO4的反应不要过于剧烈,并根据需要适当补充蒸发的水分,以防FeSO4结晶析出。
2.若收集铁屑残渣有困难,可以在减压过滤时用双层滤纸,两张滤纸的质量差即为渣重。
3.样品比色时,应用不含O2的蒸馏水溶解产品。
五、数据记录六、思考题1.在制备FeSO4的过程中为什么强调溶液必须保证强酸性?2. 在产品检验时配制溶液为什么要用不含氧的去离子水?除氧方法是怎样的?3. 在计算硫酸亚铁的理论产量和产品硫酸亚铁铵晶体的理论产量时,各以什么物质的用量为标准?为什么?4. 为了保证产品的产量和质量,实验中应注意哪些问题?。
硫酸亚铁铵的制备和纯度鉴定实验报告一、实验目的1、掌握硫酸亚铁铵的制备原理和方法。
2、练习过滤、蒸发、结晶等基本操作。
3、学习用目视比色法测定产品中微量杂质铁的含量,从而鉴定产品的纯度。
二、实验原理硫酸亚铁铵又称莫尔盐,化学式为(NH₄)₂Fe(SO₄)₂·6H₂O,浅绿色晶体,是一种复盐。
在空气中比一般亚铁盐稳定,不易被氧化。
制备硫酸亚铁铵的原理是:先用铁屑与稀硫酸反应制取硫酸亚铁:Fe + H₂SO₄= FeSO₄+ H₂↑然后,向硫酸亚铁溶液中加入等物质的量的硫酸铵,在一定温度下,硫酸亚铁与硫酸铵反应生成硫酸亚铁铵:FeSO₄+(NH₄)₂SO₄+ 6H₂O =(NH₄)₂Fe(SO₄)₂·6H₂O在产品纯度鉴定中,常利用目视比色法来测定微量杂质铁的含量。
在酸性溶液中,Fe²⁺与 KSCN 反应生成血红色的Fe(SCN)²⁺,通过与标准溶液进行颜色比较,可确定产品中杂质铁的含量,从而鉴定产品的纯度。
三、实验仪器与试剂1、仪器电子天平、锥形瓶、烧杯、玻璃棒、漏斗、布氏漏斗、抽滤瓶、蒸发皿、酒精灯、铁架台(带铁圈)、石棉网、药匙。
2、试剂铁屑、稀硫酸(3mol/L)、硫酸铵固体、KSCN 溶液(1mol/L)、标准铁溶液(001mg/mL)。
四、实验步骤1、硫酸亚铁的制备(1)称取_____g 铁屑,放入锥形瓶中,加入_____mL 3mol/L 的稀硫酸,在通风橱中加热反应。
反应过程中要不断搅拌,使反应充分进行。
(2)待反应速度明显减慢,不再产生气泡时,趁热过滤,用少量热水洗涤锥形瓶和滤渣,将滤液和洗涤液合并,转移至烧杯中。
2、硫酸亚铁铵的制备(1)根据铁的质量,计算所需硫酸铵的质量。
(2)将计算好的硫酸铵固体加入到硫酸亚铁溶液中,搅拌使其溶解。
(3)在蒸发皿中蒸发浓缩溶液至表面出现晶膜,然后冷却至室温,使硫酸亚铁铵结晶析出。
(4)减压过滤,用少量乙醇洗涤晶体,抽干,得到硫酸亚铁铵产品,称重,计算产率。
广州大学环境学院
本科学生综合性、设计性实验报
告
实验课程普通化学实验一
实验项目硫酸亚铁的制备与组成和纯度分析
专业班级
学号姓名
指导教师贾玉江
开课学期2011至2012 学年第二学期
时间年月日
(时间不写)
实验方案设计
实验原理
实验流程和实验装置图
实验用品(包括:名称、规格、数量)
数据记录和处理(表格、计算公式等)
参考文献(要填)
教师对实验方案设计的意见
签名:
日期:
实验报告(不用写,只需写实验设计)
实验目标
实验用品
一.制备
制备原理(简述)
制备流程和现象
实验数据记录和结果
产品外观
理论产量/ g
实际产量/g
产率/ %
二.产品检验
1.定性鉴定NH4+ 、Fe2+ 、SO42-
鉴定步骤或流程实验现象实验现象解释结论
2.Fe3+ 的定量分析
原理(简述)
测定流程和现象
实验数据记录及处理
分析结果(产品等级)
三.问题与讨论(结果分析实验成败原因分析、实验成败关键环节、改进方案等)
指导教师评语及评分:
签名:年月日。
硫酸亚铁铵的制备及组成测定硫酸亚铁铵的制备及组成测定一、实验目的1.学习制备复盐(NH4)2SO4·FeSO4·6H2O的制备方法和实验条件。
2.熟练掌握水浴加热、过滤、蒸发、结晶等基本无机制备操作。
3.学习制备无机化合物有关投料、产率、产品限量分析等的计算方法。
4.掌握测定硫酸亚铁铵中各组分的的原理与方法。
二、实验原理1.硫酸亚铁铵的制备硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O)商品名为莫尔盐,为浅蓝绿色单斜晶体。
一般亚铁盐在空气中易被氧化,而硫酸亚铁铵在空气中比一般亚铁盐要稳定,不易被氧化,并且价格低,制造工艺简单,容易得到较纯净的晶体,因此应用广泛。
在定量分析中常用来配制亚铁离子的标准溶液。
和其他复盐一样,(NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成它的每一组分FeSO4或(NH4)2SO4的溶解度都要小。
利用这一特点,可通过蒸发浓缩FeSO4与(NH4)2SO4溶于水所制得的浓与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准[Fe(SCN)]2+溶液的红色进行比较,确定待测溶液中杂质Fe3+的含量范围,确定产品等级。
2.Fe2+ 含量测定(1)重铬酸钾法测铁,是铁矿中全铁量测定的标准方法。
在酸性溶液中,Fe2+可以定量地被K2Cr2O7氧化成Fe3+,反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O滴定指示剂为二苯胺磺酸钠,其还原态为无色,氧化态为紫红色。
必须加入磷酸或氟化钠等,目的有两个:一是与生成地Fe3+形成配离子[Fe(HPO4)]+,降低Fe3+/ Fe2+电对的电极电势,扩大滴定突跃范围,使指示剂的变色范围在滴定的突跃范围之内;二是生成的配离子为无色,消除了溶液中Fe3+黄色干扰,利于终点观察。
(2)采用邻菲啰啉比色法测定亚铁含量在一定酸度条件下,试液中亚铁离子(Fe2+)与1,10-邻菲啰啉生成红色配合物,于波长为506nm 处,测定其吸光度,即可计算出铁含量。
3.NH4+的测定(1)甲醛法由于铵盐中NH4+的酸性太弱,Ka=5.6×10-7 (pH=6.3)。
故无法用NaOH标准溶液直接滴定。
因此,工业生产中普遍采用甲醛法测定铵盐中的含氮量。
将铵盐与甲醛作用,定量生成六亚甲基四铵盐和H+,其具体反应如下所示:4 NH4+ + 6HCHO = (CH2)6N4H+ + 3H+ + 6H2O生成的H+和(CH2)6NH4+ :Ka 7.1×10-6 (pH=5.6),可用NaOH标准溶液滴定。
(CH2)6NH4+ + OH- =(CH2)6N4++H2O计量点时产物为六亚甲基四胺(CH2)6N4+,其水溶液显微碱性。
因此,在滴定终点时可采用酚酞作为指示剂,达到终点时试液由无色变为微红色。
(2)4.SO42-含量的测定(1)重量法将样品溶解于水后,用稀盐酸酸化后加热至沸,在不断搅拌下慢慢的加入氯化钡溶液,所得沉淀经过过滤、洗涤、烘干、灼烧后,以硫酸钡形式称量,即可求得样品中硫酸根的含量。
Ba2+ + SO42- == BaSO4 (白色) (2)EDTA络合滴定在酸性条件下,先用过量的氯化钡将溶液中SO42-的完全沉淀,溶液经过滤,沉淀硫酸钡经洗涤后,将其溶解于加入定量氨水的EDTA 溶液中,过量的EDTA 以锌标准溶液回滴,以铬黑T 为指示剂,可测定溶液中硫酸盐的浓度。
硫酸盐质量浓度( mg/L ) =(V0 - V1)×C ×96.06 ×1000/ V式中:V ———水样的体积,mL ; V0 ———滴定空白溶液所消耗锌标准溶液的体积,mL ;V1 ———滴定样品所消耗锌标准溶液的体积,mL ;C ———锌标准溶液的浓度,mol/ L三、实验仪器和药品(1)硫酸亚铁铵制备实验:电子天平,量筒(10mL,50mL),烧杯(50mL),锥形瓶(250mL),蒸发皿(60mL),玻璃棒,铁架台,酒精灯,大烧杯(可用水浴锅代替)、三脚架,石棉网,胶头滴管,药匙,吸滤瓶,比色管(25ml),吸量管,布氏漏斗,真空泵,温度计。
盐酸(2mol/L),硫酸(3 mol/L),标准Fe3+溶液(0.0100mg/mL),硫氰酸钾(KSCN,1mol/L),硫酸铵(s),碳酸钠(10%),铁屑,乙醇(95%),pH试纸、滤纸。
(2)铵根离子含量测定:25mL碱式滴定管;250mL容量瓶;25mL移液管;1000mL试剂瓶;250mL锥性瓶、烧杯;10、100mL量筒;洗瓶;玻璃棒;滴管;表面皿;吸耳球;托盘天平;电子分析天平。
氢氧化钠(AR);邻苯二甲酸氢钾;0.2%乙醇酚酞溶液;40%甲醛;硫酸铵、氯化铵试样,酚酞指示剂。
(3)SO42-离子含量的测定(重量法)电子天平、烧杯、吸量管、表面皿、玻璃棒、胶头滴管、中(慢)速定量滤纸、玻璃漏斗、瓷坩锅、干燥器、试管。
2mol/LHCl 溶液、BaCl2•H2O122g/L、0.1mol/L硝酸银、0.025mol/LEDTA、甲基红指示剂(2g/L),乙醇。
(4)亚铁离子含量的测定仪器:分光光度计;1cm比色皿柠檬酸三钠水溶液,150g/L;盐酸羟胺溶液,50 g/L;盐酸溶液,3mol/L;氨水溶液,2.5%;1,1 0-邻菲啰啉溶液,2.5 g/L:称量2.5g1, 10-邻菲啰啉溶于80℃的约l00ml水中,加lml浓盐酸,冷却后加水稀释至1000ml,储于阴凉处备用;醋酸-醋酸钠缓冲溶液:称量272g醋酸钠(NaCH3·CO2·3H2O)于约500m1水中,加入冰醋酸240ml,加水稀释至1000ml;Fe2+标准溶液,lmg/ml:称量7.024g硫酸亚铁铵于约500ml水中,加入浓盐酸10ml,移入l000ml容量瓶中,稀释至刻度;Fe2+标准溶液,20ųg/ml:吸取lmg/ml的亚铁标准溶液20ml于1000ml容量瓶中,用水稀释至刻度,混匀,临用前配制。
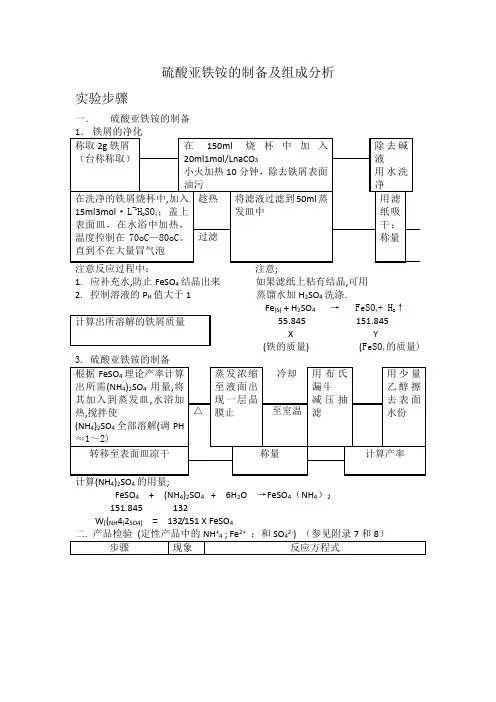
四、实验步骤1.Fe屑的净化用台式天平称取2.0g Fe屑,放入锥形瓶中,加入15 mL l0%Na2CO3溶液,小火加热煮沸约10 min以除去Fe屑上的油污,倾去Na2CO3碱液,用自来水冲洗后,再用去离子水把Fe屑冲洗干净。
2.FeSO4的制备往盛有Fe屑的锥形瓶中加入15 mL 3mol·L-1H2SO4,水浴加热至不再有气泡放出,趁热减压过滤(思考题4),用少量热水洗涤锥形瓶及漏斗上的残渣,抽干。
将滤液转移至洁净的蒸发皿中,将留在锥形瓶内和滤纸上的残渣收集在一起用滤纸片吸干后称重,由已作用的Fe屑质量算出溶液中生成的FeSO4的量。
3. (NH4)2SO4·FeSO4·6H2O的制备根据溶液中FeSO4的量,按反应方程式计算并称取所需(NH4)2SO4固体的质量,加入上述制得的FeSO4溶液中。
水浴加热,搅拌使(NH4)2SO4全部溶解,并用3mol·L-1 H2SO4溶液调节至pH为1~2(思考题5),继续在水浴上蒸发、浓缩至表面出现结晶薄膜为止(蒸发过程不宜搅动溶液)。
静置,使之缓慢冷却(思考题6),(NH4)2SO4·FeSO4·6H2O晶体析出,减压过滤除去母液,并用少量95%乙醇洗涤晶体(思考题7),抽干。
将晶体取出,摊在两张吸水纸之间,轻压吸干。
观察晶体的颜色和形状。
称重,计算产率。
4. 产品检验[Fe(Ⅲ)的限量分析](1) Fe(Ⅲ)标准溶液的配制。
称取0.8634g NH4Fe(SO4)2·12H2O,溶于少量水中,加 2.5 mL 浓H2SO4,移入1000 mL容量瓶中,用水稀释至刻度。
此溶液为0.1000g·L-1 Fe3+。
(2) 标准色阶的配制。
取0.50 mL Fe(Ⅲ)标准溶液于25mL比色管中,加2 mL3mol·LHCl和l mL25%的KSCN溶液,用蒸馏水稀释至刻度,摇匀,配制成Fe标准液(含Fe3+为0.05mg·g-1)。
同样,分别取0.05 mLFe(Ⅲ)和2.00 mLFe(Ⅲ)标准溶液,配制成Fe标准液(含Fe3+,分别为0.10mg·g-l、0.20mg·g-1)。
(3) 产品级别的确定。
称取1.0g产品于25 mL 比色管中,用15 mL去离子水溶解,再加入2 mL 3mol·LHCl和l mL25%KSCN溶液,加水稀释至25 mL,摇匀。
与标准色阶进行目视比色,确定产品级别。
此产品分析方法是将成品配制成溶液与各标准溶液进行比色,以确定杂质含量范围。
如果成品溶液的颜色不深于标准溶液,则认为杂质含量低于某一规定限度,所以这种分析方法称为限量分析。
5. (NH 4)2SO 4·FeSO 4·6H 2O 含量的测定(1) (NH 4)2SO 4·FeSO 4·6H 2O 的干燥。
将步骤3中所制得的晶体在100℃左右干燥2~3h ,脱去结晶水。
冷却至室温后,将晶体装在干燥的称量瓶中。
(2) K 2Cr 2O 7标准溶液的配制。
在分析天平上用差减法准确称取约1.2g(准确至0.1mg)K 2Cr 2O 7,放入100 mL 烧杯中,加少量蒸馏水溶解,定量转移至250 mL 容量瓶中,用蒸馏水稀释至刻度,计算K 2Cr 2O 7的准确浓度。
0.2501000)O Cr (K )O Cr (K )O Cr (K 722722722⨯=M m c)O Cr (K 722M =294.18g∙mol -1 (3)测定含量 用差减法准确称取0.6~0.8g(准确至0.1mg)所制得的(NH 4)2SO 4·FeSO 4·6H 2O 两份,分别放入250mL 锥形瓶中,各加100 mLH 2O 及20 mL 3mol·LH 2SO 4,加5 mL 85%H 3PO 4,滴加6~8滴二苯胺磺酸钠指示剂,用K 2Cr 2O 7标准溶液滴定至溶液由深绿色变为紫色或蓝紫色即为终点。
)样(1000(Fe))O Cr (K )O Cr (K 6(Fe)722722m M V c w ⨯⨯⨯=6.铵根离子含量测定(1)试剂的配制酚酞指示剂:称取0.58酚酞溶于50mL95%乙醇和50 mL的水溶液中。
0.1 mol/L NaOH溶液:在台称上取NaOH固体2 g于小烧杯中,加入50 mL蒸馏水使其溶解,稍冷后转入500 mL试剂瓶中,加水450mL,用橡皮塞塞好瓶口,摇匀。