硫酸亚铁铵的制备
- 格式:docx
- 大小:36.71 KB
- 文档页数:3
实验八硫酸亚铁铵的制备一、实验目的1、了解复盐的一般特征和制备方法;2、练习水浴加热、常压过滤与减压过滤、蒸发与结晶等基本操作;3、学习用目测比色法检验产品质量。
二、实验原理在机械加工和人们的日常生活中,经常产生大量的废铁、既浪费了资源,也污染了环境。
为了变废为宝,节约资源,美化我们的生产和生活环境,可以用废铁生产硫酸亚铁铵硫酸亚铁铵常以水合物形式存在,其水合物为浅蓝绿色单斜晶体,俗称摩尔盐,是一种复盐。
在空气中一般比较稳定,不易被氧化,溶于水而又不溶于乙醇,受热到100℃时失去结晶水。
由于硫酸亚铁铵在空气中比较稳定,而且价格低廉,制备工艺简单,因此它的用途较广。
一方面,在做定量分析时常用作标定重铬酸钾、高锰酸钾等溶液的基准物质。
另外还在工农业生产中用作染料的媒染剂,农用杀虫剂和肥料,废水处理的混凝剂等。
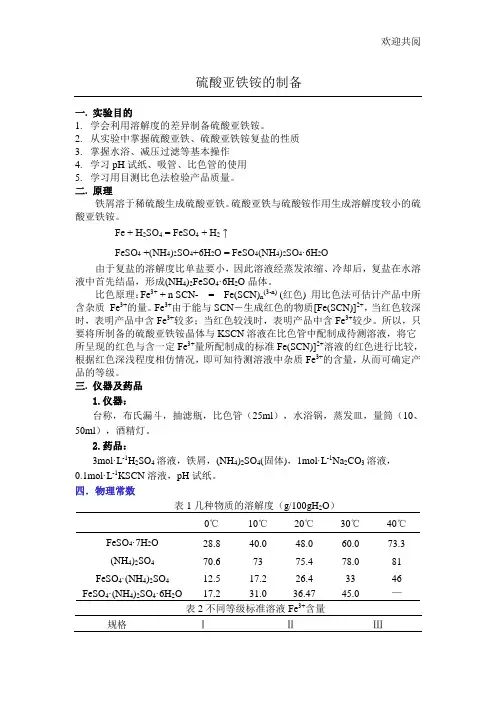
1、硫酸亚铁的制备:Fe(过量)+H 2 S0 4=FeS0 4 + H 2↑2、硫酸亚铁铵的制备像所有的复盐一样,硫酸亚铁铵在水中的溶解度比组成它的任何一个组分FeSO 4 或(NH 4 ) 2 S0 4的溶解度都要小,见表9-15-1。
因此从Fe 2 S0 4和(NH 4 ) 2 S0 4溶于水所制得的浓混合溶液中,很容易得到结晶的摩尔盐。
往硫酸亚铁溶液中加人硫酸铵并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶解度较小的硫酸亚铁铵晶体:FeS O 4 + (NH 4 ) 2 S O 4 +6H 2 O =(NH 4 ) 2 S O 4 ·FeS O 4 ·6H 2O为防上Fe 2+的水解,在制备(NH 4 ) 2 S0 4 ·FeS0 4 ·6H 2 0过程中,溶液应保持足够的酸度。
表9-15-1 铵盐在水中的溶解度( 以100gH三、主要仪器及耗材仪器:台秤,锥形瓶(150mL) ,烧杯,量筒(10 、50mL) ,漏斗,漏斗架,蒸发皿,布氏漏斗,吸滤瓶,酒精灯,表面皿,水浴( 可用大烧杯代替) ,比色管(25mL) 。


实验三硫酸亚铁铵的制备一实验目的:1. 学会利用溶解度的差异制备硫酸亚铁铵;掌握硫酸亚铁、硫酸亚铁铵复盐的性质。
2. 掌握水浴、减压过滤等基本操作;学习pH试纸、吸管、比色管的使用;学习限量分析。
二实验原理:1.铁屑溶于H2SO4,生成FeSO4:Fe + H2SO4=FeSO4 + H2↑2. 通常,亚铁盐在空气中易氧化。
例如,硫酸亚铁在中性溶液中能被溶于水肿的少量氧气氧化并进而与水作用,甚至析出棕黄色的碱式硫酸铁(或氢氧化铁)沉淀。
若往硫酸亚铁溶液中加入与FeSO4相等的物质的量(mol)的硫酸铵,则生成复盐硫酸亚铁铵。
硫酸亚铁铵比较稳定,它的六水合物(NH4)2SO4·FeSO4·6H2O不易被空气氧化,在定量分析中常用以配制亚铁离子的标准溶液。
像所有的复盐那样,硫酸亚铁铵在水中的溶解度比组成它的每一组份FeSO4或(NH4)2SO4的溶解度都要小。
蒸发浓缩所得溶液,可制得浅绿色的硫酸亚铁铵(六水合物)晶体。
FeSO4与(NH4)2SO4等物质的量作用,生成溶解度较小的硫酸亚铁铵:FeSO4 + (NH4)2SO4 + 6H2O =(NH4)2SO4·FeSO4·6H2O硫酸亚铁铵比较稳定,定量分析中常用来配制亚铁离子的标液;和其他复盐一样,硫酸亚铁铵的溶解度比它的每一组分要小。
3.比色原理:Fe3+ + n SCN- = Fe(SCN)n(3-n) (红色) 用比色法可估计产品中所含杂质Fe3+的量。
Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。
所以,只要将所制备的硫酸亚铁铵晶体与KSCN 溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。

硫酸亚铁铵的制备及组成测定硫酸亚铁铵的制备及组成测定一、实验目的1.学习制备复盐(NH4)2SO4·FeSO4·6H2O的制备方法和实验条件。
2.熟练掌握水浴加热、过滤、蒸发、结晶等基本无机制备操作。
3.学习制备无机化合物有关投料、产率、产品限量分析等的计算方法。
4.掌握测定硫酸亚铁铵中各组分的的原理与方法。
二、实验原理1.硫酸亚铁铵的制备硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O)商品名为莫尔盐,为浅蓝绿色单斜晶体。
一般亚铁盐在空气中易被氧化,而硫酸亚铁铵在空气中比一般亚铁盐要稳定,不易被氧化,并且价格低,制造工艺简单,容易得到较纯净的晶体,因此应用广泛。
在定量分析中常用来配制亚铁离子的标准溶液。
和其他复盐一样,(NH4)2SO4·FeSO4·6H2O在水中的溶解度比组成它的每一组分FeSO4或(NH4)2SO4的溶解度都要小。
利用这一特点,可通过蒸发浓缩FeSO4与(NH4)2SO4溶于水所制得的浓混合溶液制取硫酸亚铁铵晶体。
三种盐的溶解度数据列于表1。
表1 三种盐的溶解度(单位为g /100g H 2O)本实验先将铁屑溶于稀硫酸生成硫酸亚铁溶液:Fe+H 2SO 4 FeSO 4+H 2↑将溶液浓缩后冷却至室温,可得晶体FeSO 4·7H 2O (俗称绿矾)。
再将等摩尔的硫酸亚铁和硫酸铵溶液混合,并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶解度较小的硫酸亚铁铵晶体,它的氧化还原稳定性比一般的亚铁盐高,常作为亚铁试剂使用。
FeSO 4+(NH 4)2SO 4+6H 2O(NH 4)2SO 4·FeSO 4·6H 2O用目视比色法可估计产品中所含杂质Fe 3+的量。
Fe 3+与SCN -能生成红色物质[Fe (SCN )]2+,红色深浅与Fe3+相关。
将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准[Fe (SCN)]2+溶液的红色进行比较,确定待测溶液中杂质Fe3+的含量范围,确定产品等级。
实验七硫酸亚铁铵的制备一、实验目的1.掌握制备复盐硫酸亚铁铵的方法, 了解复盐的特性。
2.掌握蒸发、浓缩等基本操作。
3.了解无机物制备的投料、产量、产率的有关计算。
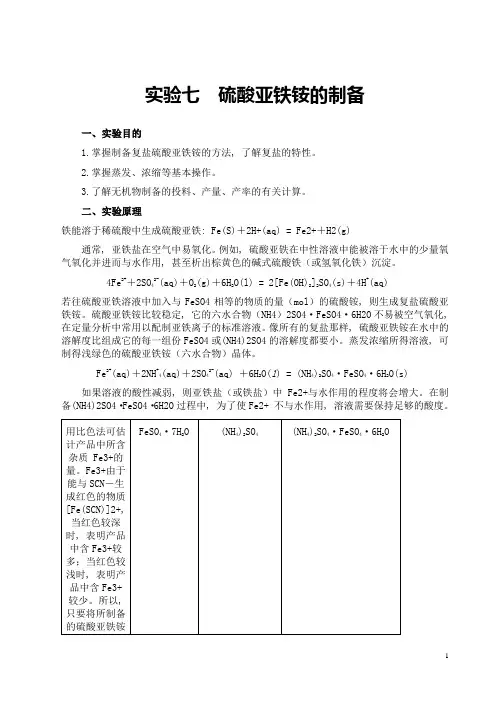
二、实验原理铁能溶于稀硫酸中生成硫酸亚铁: Fe(S)+2H+(aq) = Fe2++H2(g)通常, 亚铁盐在空气中易氧化。
例如, 硫酸亚铁在中性溶液中能被溶于水中的少量氧气氧化并进而与水作用, 甚至析出棕黄色的碱式硫酸铁(或氢氧化铁)沉淀。
4Fe2++2SO42-(aq)+O2(g)+6H2O(l) = 2[Fe(OH)2]2SO4(s)+4H+(aq)若往硫酸亚铁溶液中加入与FeSO4相等的物质的量(mol)的硫酸铵, 则生成复盐硫酸亚铁铵。
硫酸亚铁铵比较稳定, 它的六水合物(NH4)2SO4·FeSO4·6H2O不易被空气氧化, 在定量分析中常用以配制亚铁离子的标准溶液。
像所有的复盐那样, 硫酸亚铁铵在水中的溶解度比组成它的每一组份FeSO4或(NH4)2SO4的溶解度都要小。
蒸发浓缩所得溶液, 可制得浅绿色的硫酸亚铁铵(六水合物)晶体。
Fe2+(aq)+2NH+4(aq)+2SO42-(aq) +6H2O(l) = (NH4)2SO4·FeSO4·6H2O(s)如果溶液的酸性减弱, 则亚铁盐(或铁盐)中Fe2+与水作用的程度将会增大。
在制备(NH4)2SO4·FeSO4·6H2O过程中, 为了使Fe2+ 不与水作用, 溶液需要保持足够的酸度。
三、药品与试剂1.仪器50mL小烧杯、l台式天平、酒精灯、吸滤瓶、布氏漏斗、真空泵、温度计、容量瓶(1 L 及 500 mL)。
2.药品盐酸 (2 mol·L-1), 硫酸 (3 mol·L-1), 标准Fe3+溶液(1.0000g·L-1 由NH4Fe(SO4)2·12 H2O配置), 硫氰化钾(KSCN)(25%溶液), 硫酸铵(s), 碳酸钠(10%溶液), 铁屑, 乙醇, pH试纸。

硫酸亚铁铵的制备
硫酸亚铁铵是一种重要的化学肥料,能够有效提高作物的生产效率。
它的制备主要是将无机硫酸与亚铁氨基酸结合,具有良好的溶解性和肥效。
硫酸亚铁铵的制备常用一种有双金属功能的中间体,来消除无机硫酸与亚铁氨基酸之间的电子共价作用,以产生氨基硫酸亚铁的有机配合物诱导硫酸亚铁铵的合成。
首先,自发分子吸收是实现硫酸亚铁铵合成的重要过程,所以需要在准备过程中引起自发分子的协同作用。
需要将反应的原料放入实验室研磨机,保持一定的水分含量,并采用低温烘箱烘制,改善原料结构,提高颗粒细度,并减小反应时间。
紧接着,需要准备镁氢氰酸钠和氨基酸分子量作为中间体,使反应更有效,这样配体结合到每个亚铁离子上,即将其表面上的负电荷变化而去除电子共价作用,也可以提高反应的均匀性,以及最终合成硫酸亚铁铵的效果。
此外,为了更好地改善反应的效率,可以在不同的比例下分别添加硝酸铵和氯化铵,以维持反应系统的稳定。
最后,在正常温度下,反应体系中双金属功能中间体可以吸收硫酸与亚铁氨基酸这两种物质,形成微结晶粒子。
将其置于搅拌,并在较高的温度和压力环境下,当中间体吸附物质的存在至少占原料的20%时,可以迅速产生有机硫酸亚铁铵。
由此可见,硫酸亚铁铵的制备需要在制备过程中由多个步骤和过程搭配,以优化反应的结果,保证其机制效果发挥出最大值。



硫酸亚铁铵的制备[实验目的]1.制备复盐(NH4)2SO4·FeSO4·6H2O,了解复盐的特性。
2.掌握无机制备的基本操作。
3.学习产品纯度的检验方法。
[实验原理]Fe屑溶于稀H2SO4生成FeSO4:Fe + H2SO4 =FeSO4 + H2等物质的量的FeSO4与(NH4)2SO4作用,能生成溶解度较小的硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐。
FeSO4 + (NH4)2SO4+6H2O = (NH4)2SO4·FeSO4·6H2O 一般亚铁盐在空气中易被氧化,但形成复盐后就比较稳定,因此在定量分析中常用来配制亚铁离子的标准溶液。
和其它复盐一样,(NH4)2SO4· FeSO4·6H2O在水中的溶解度比组成的每一种组分[FeSO4或(NH4)2SO4]的溶解度都要小。
三种盐的溶解度数据列于表7-3。
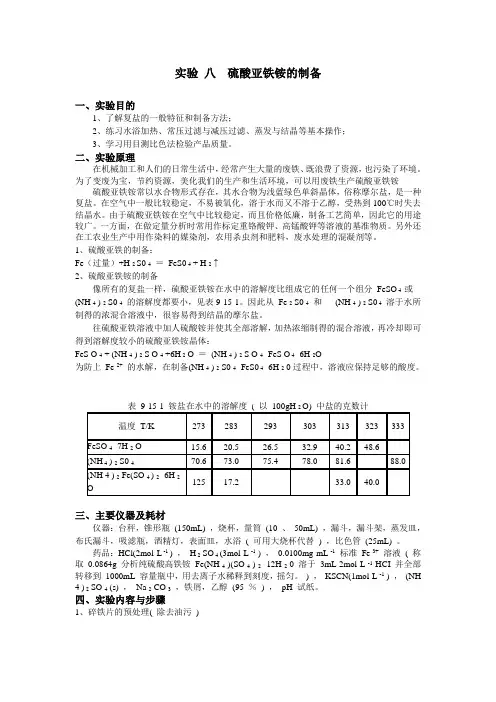
[课前预习]常压过滤操作减压过滤操作[实验步骤]1.Fe屑的净化称取 2 g Fe屑放于锥形瓶内,加入 15 mL 10 %Na2CO3溶液,小火加热10 分钟以除去 Fe屑上的油污,用倾泻法倒掉碱液并用纯水把Fe屑洗净。
2.FeSO4的制备往盛有 Fe屑的锥形瓶中加入 15 mL 3 mol·L-1 H2SO4,放在水浴上(在通风橱中进行或用吸收瓶吸收尾气)至不再有气泡放出,趁热减压滤,用少量热水洗涤锥形瓶及漏斗上的残渣,抽干。
将溶液倒入蒸发皿(若滤液稍有混浊,可滴入硫酸酸化)。
将留在锥形瓶内和滤纸上的残渣在一起用碎滤纸吸干后称重,由已作用的Fe屑质量算出溶液中生成的FeSO4的量。
3.(NH4)2SO4·FeSO4·6H2O的制备根据溶液中 FeSO4的量,接反应方程式计算并称取所需(NH4)2SO4固的量,倒入上面制得的FeSO4溶液中。
水浴蒸发、浓缩至表面出现结晶膜为止。

硫酸亚铁铵的制备注意事项硫酸亚铁铵(Fe(NH4)2(SO4)2·6H2O),也被称为铵铁(II)硫酸,是一种常见的无机化合物。
下面我将详细介绍硫酸亚铁铵的制备注意事项。
1. 实验剂和设备准备:硫酸亚铁铵的制备需要以下实验剂:硫酸铁(II)(FeSO4),氨水(NH3·H2O),硫酸(H2SO4),蒸馏水。
同时,还需要设备:容量瓶,烧杯,玻璃棒,搅拌器,滤纸,热水浴等。
2. 安全注意事项:a. 在进行实验时,应佩戴实验手套、眼镜和实验服,以免接触到有害化学物质。
b. 在进行实验时,尽量使用通风良好的实验室,以免吸入有害气体。
c. 注意酸碱溶液的浓度,避免接触浓硫酸和浓氨水,以免发生危险。
d. 严禁将废液倒入下水道,应按照规定进行处理。
3. 实验步骤:硫酸亚铁铵的制备步骤如下:a. 准备一定容量的硫酸铁(II)溶液:取适量的硫酸铁(II)固体,加入足够量的蒸馏水中,并用玻璃棒充分搅拌,使其溶解。
b. 准备一定浓度的氨水溶液:取适量的氨水加入烧杯中。
c. 慢慢将氨水滴加入硫酸铁(II)溶液中,同时用玻璃棒进行搅拌,直到溶液的pH 值达到中性为止。
d. 将溶液转移到容量瓶中,然后加入适量的硫酸溶液进行酸化,直到溶液呈现微酸性。
e. 将容量瓶密封并进行摇匀,使反应充分进行。
f. 将反应液置于热水浴中进行加热,加热到一定温度,使反应快速进行。
g. 反应完成后,取出容量瓶,冷却液体至室温。
4. 结晶与分离:a. 将冷却后的溶液加入冷却的烧杯中,并用玻璃棒搅拌,使结晶更加充分。
b. 然后将悬浊液过滤,使用滤纸进行过滤,分离出固体。
c. 用适量的蒸馏水洗涤过滤得到的固体,以去除杂质。
d. 最后将固体放置到通风处晾干,使其结晶更加完整。
5. 注意事项:a. 氨水的滴加速度要控制得适当,过快或过慢都会影响反应的进行。
b. 反应液的酸碱度要通过pH试纸进行检测,不可过度酸化或碱化。
c. 加热时要控制热水浴的温度,避免溶液沸腾,产生飞溅或溢出。
硫酸亚铁铵的制备实验原理铁屑易溶于稀硫酸,生成硫酸亚铁:Fe+HSQ=FeSQ+H2f硫酸亚铁与等物质量的硫酸铵在水溶液中相互作用,即生成溶解度较小的浅绿色硫酸亚铁铵复盐晶体:FeSQ4+(NH4)2SQ4+6H2Q=FeSQ4 • (NH^SQr 6H2Q^O一般亚铁盐在空气中都易被氧化,但形成复盐后却比较稳定,不易氧化。
实验试剂3mol/L硫酸溶液,O.1mol/L碳酸钠溶液,铁屑(本实验中亦可以铁粉代),硫酸铵。
实验仪器电子天平,量筒(10mL,50mL),烧杯(50mL),锥形瓶(250mL,蒸发皿(60mL,玻璃棒,铁架台, 酒精灯,三脚架,石棉网,胶头滴管,药匙,吸滤瓶,布氏漏斗。
墨绿色。
(5 )铁屑颗粒不宜太细,与酸反应时容易被反应产生的泡沫冲上浮在液面或粘在锥形瓶壁而脱离溶液;小段细铁丝也有类似情况。
(6 )碳酸钠溶液洗涤后,增加水洗步骤为制备实验产品纯度提供保证;二.硫酸亚铁溶液制备(1)准确称量4.20g铁粉并置于锥形瓶中,往盛着铁粉的锥形瓶内加入25mL3mol・L-1 H2SO;(2 )在酒精灯上加热(三脚架上隔石棉网),使铁屑与硫酸完全反应(约50min),应不时地往锥形瓶中加水,以补充被蒸发掉的水分;(3)趁热减压过滤,保留滤液;(4)向滤液中补加1〜2mL3mol/L硫酸溶液(防止亚铁离子在pH相对过高的情况下被氧(1)硫酸的浓度不宜太大或太小。
浓度小,反应慢;浓度太大,易产生Fe3、SO,使溶液出现黄色,或形成块状黑色物。
酸溶时适当振荡,铁屑回落进入酸溶液反应。
硫酸亚铁制备中,无论控制酸过量还是铁过量,均能得到硫酸亚铁产品,但产品的质量和纯度受影响。
铁过量可防止FeSO被氧化。
控制溶液的pH<1, 抑制FeSO 水解。
一般来说,Fe 稍过量时,产品质量较好,未反应的铁可循环反应;(2)有恒温加热装置为最佳,控制温度在60 C左右。
不要剧烈摇动锥形瓶,以防止氧化。
硫酸亚铁铵的制备
实验原理
铁屑易溶于稀硫酸,生成硫酸亚铁:Fe+H2SO4=FeSO4+H2↑
硫酸亚铁与等物质量的硫酸铵在水溶液中相互作用,即生成溶解度较小的浅绿色硫酸亚铁铵复盐晶体:FeSO4+(NH4)2SO4+6H2O=FeSO4·(NH4)2SO4·6H2O↓。
一般亚铁盐在空气中都易被氧化,但形成复盐后却比较稳定,不易氧化。
实验试剂
3mol/L硫酸溶液,0.1mol/L碳酸钠溶液,铁屑(本实验中亦可以铁粉代),硫酸铵。
实验仪器
电子天平,量筒(10mL,50mL),烧杯(50mL),锥形瓶(250mL),蒸发皿(60mL),玻璃棒,铁架台,酒精灯,三脚架,石棉网,胶头滴管,药匙,吸滤瓶,布氏漏斗。
附:实验有关装置
实验实际操作装置、产品。
硫酸亚铁铵的制备原理硫酸亚铁铵是一种常用的化学试剂,它的制备原理可以简单概括为硫酸与亚铁离子和铵离子反应生成硫酸亚铁铵盐。
下面将详细介绍硫酸亚铁铵的制备原理。
硫酸亚铁铵的主要原料是硫酸、亚铁离子和铵离子。
硫酸是一种无色、无臭的液体,可以在水中溶解。
亚铁离子是一种二价铁离子,可以通过用过量的亚铁盐溶解在水中得到。
铵离子是一种带有正电荷的氮离子,可以由铵盐溶解在水中得到。
制备硫酸亚铁铵的过程可以分为两个步骤。
首先,将硫酸和亚铁离子反应生成硫酸亚铁。
这一步骤可以通过将亚铁盐溶解在水中,然后加入适量的硫酸来实现。
反应的化学方程式为:Fe2+ + H2SO4 -> FeSO4 + H+在这个反应中,亚铁离子被氧化为二价离子,同时硫酸中的酸性氢离子被中和。
接下来,将生成的硫酸亚铁与铵离子反应生成硫酸亚铁铵。
这一步骤可以通过将适量的铵盐溶解在水中,然后将之前制备的硫酸亚铁溶液慢慢加入其中来实现。
反应的化学方程式为:FeSO4 + 2NH4+ + 2SO4^2- -> (NH4)2Fe(SO4)2在这个反应中,硫酸亚铁与铵离子反应生成硫酸亚铁铵盐。
这是一个双替换反应,其中两个铵离子取代了硫酸亚铁中的两个氯离子。
在制备硫酸亚铁铵的过程中,需要注意以下几点。
首先,反应的过程应该在适当的温度和pH条件下进行。
温度过高或过低都可能会影响反应速率和产物的纯度。
其次,反应过程应该充分搅拌,以保证反应物均匀混合。
最后,制备好的硫酸亚铁铵盐需要经过过滤和干燥等步骤,以去除杂质并得到纯净的产物。
硫酸亚铁铵是通过硫酸、亚铁离子和铵离子之间的反应制备而成的。
这种化合物具有广泛的应用领域,常用于农业、水处理、化学分析等领域。
制备硫酸亚铁铵的过程需要注意反应条件和操作步骤,以确保产物的质量和纯度。
硫酸亚铁铵的制备
一、实验目的
1.了解硫酸亚铁铵的制备方法及复盐的特性。
2. 掌握使用水浴加热、蒸发、结晶、减压过滤等基本操作。
3. 了解检验产品杂质含量的目测比色方法。
二、实验原理
硫酸亚铁铵(NH
4)
2
Fe(SO
4
)
2
6H
2
O又称摩尔盐,为浅蓝绿色单斜晶体。
它在
空气中比一般亚铁盐稳定,不易被氧化,溶于水但不溶于乙醇,而且价格低,制造工艺简单,容易得到较纯净的晶体,因此,其应用广泛,在化学上用作还原剂,工业上常用作废水处理的混凝剂,在农业上既是农药又是肥料,在定量分析中常用作氧化还原滴定的基准物质。
像所有的复盐一样,硫酸亚铁铵在水中的溶解度比组成它的任何一个组分
FeSO
4或(NH
4
)
2
SO
4
的溶解度都要小,见下表。
因此从Fe
2
SO
4
和(NH
4
)
2
SO
4
溶于水
所制得的浓混合溶液中,很容易得到结晶的摩尔盐。
几种盐的溶解度手册值(g/100gH2O)本实验采用过量铁和稀硫酸作用生成硫酸亚铁:
Fe+H
2SO
4
=FeSO
4
+H
2
↑
往硫酸亚铁溶液中加入硫酸铵并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶解度较小的硫酸亚铁铵晶体:
FeSO
4+(NH
4
)
2
SO
4
+6H
2
O=(NH
4
)
2
Fe(SO
4
)
2
6H
2
O
为防止Fe2+的水解,在制备(NH
4)
2
Fe(SO
4
)
2
6H
2
O的过程中,溶液应保持足
够的酸度。
三、仪器与试剂
仪器:台秤,锥形瓶(150mL),烧杯,量筒(10、50mL),漏斗,漏斗架,蒸发皿,布氏漏斗,吸滤瓶,酒精灯,表面皿,水浴(可用大烧杯代替)。
试剂:H
2SO
4
(3mol·L-1),(NH
4
)
2
SO
4
(s),铁屑,乙醇(95%),pH试纸。
四、实验内容
1.硫酸亚铁的制备:
往盛有2.0g洁净铁屑的锥形瓶中加入15mL3mol·L-1H2SO4溶液,放在低温电炉(或水浴)加热(在通风条件下进行)。
在加热过程中应不时加入少量去离子水,以补充被蒸发的水分,保持原有体积,防止FeSO4结晶出来;同时要控制溶液的pH不大于1(为什么?如何测量和控制?),使铁屑与稀硫酸反应至不再冒气泡为止。
趁热用普通漏斗过滤,滤液承接于洁净的蒸发皿中(如果发现滤纸上有晶体析出,可用少量去离子水冲洗),将留在锥形瓶中及滤纸上的残渣取出,用滤纸片吸干后称量(如果考虑收集反应残渣有困难,可以改用减压过滤,抽滤时加双层滤纸,抽干溶液后,残渣粘附于上层。
只要称出两张滤纸的质量差,即可知渣重)。
根据已作用的铁屑质量,算出溶液中FeSO4的理论产量。
2.硫酸亚铁铵的制备:
根据FeSO4的理论产量,计算出所需的固体(NH4)2SO4质量和温室下配制(NH4)2SO4饱和溶液所需的水的体积。
将配制好的(NH4)2SO4溶液溶液倒入盛FeSO4溶液的蒸发皿中,混合均匀后,调节pH为1~2,将蒸发皿置于水浴上加热蒸发,至溶液表面出现晶体膜时停止加热。
静置,使其自然冷却至室温,析出浅绿色结晶,减压过滤,用少量乙醇洗去晶体表面所吸附的水分。
将晶体取出,置于两张洁净的滤纸之间,并轻压以吸收母液,称量。
计算理论产量和产率。
3.目视比色Fe3+含量分析
目视比色法是确定杂质含量的一种常用方法,在确定杂质含量后便能定出产品的级别。
将产品配成溶液,与各标准溶液进行比色,如果产品溶液的颜色比某一标准溶液的颜色浅,就可确定杂质含量低于该标准溶液中的含量,即低于某一规定的限度,所以这种方法又称这限量分析。
本实验仅做摩尔盐中Fe3+的限量分析。
称取1.00g产品置于比色管中,先用少量不含O2的纯水溶解,再加入2mL 2.0mol/LHCl溶液和0.50mL 1.0mol/LKSCN溶液,用除去溶解氧的去离子水稀释至25mL,摇匀,与Fe3+标准溶液比色,确定产品的级别。
【注意】
(1)避免使用锈蚀程度过大的铁屑,因其表面Fe2O3过多无法被铁完全还原,会导致Fe3+留在溶液中而影响产品的质量。
(2)铁屑颗粒不宜太细,与酸反应时容易被反应产生的泡沫冲上浮在液面或粘在锥形瓶壁而脱离溶液;小段细铁丝也有类似情况。
(3)硫酸的浓度不宜太大或太小。
浓度小,反应慢;浓度太大,易产生Fe3+、SO2,使溶液出现黄色,或形成块状黑色物。
酸溶时适当振荡,铁屑回落进入酸
溶液反应。
硫酸亚铁制备中,无论控制酸过量还是铁过量,均能得到硫酸亚铁产品,但产品的质量和纯度受影响。
铁过量可防止FeSO4被氧化。
控制溶液的pH<1,抑制FeSO4水解。
一般来说,Fe稍过量时,产品质量较好,未反应的铁可循环反应;
(4)有恒温加热装置为最佳,控制温度在60℃左右。
不要剧烈摇动锥形瓶,以防止氧化。
加热(可采用沸水浴加热,注意控制反应速率,以防反应过快而使反应液喷出),并不断振荡锥形瓶;边加热边补充水,但不能加水过多,尽可能保持溶液pH<2以下,pH太高,Fe2+易氧化成Fe3+。
分次补充少量水,防止FeSO4析出。
酸溶过程中有必要进行尾气处理。
由于废铁屑含有的碳、硫、磷、硅等杂
(5)趁热减压过滤,为防透滤可同时用两层滤纸,而且硫酸亚铁溶液应迅速转入蒸发皿中,以防止溶液在吸滤瓶中冷却而析出硫酸亚铁晶体,导致损失。
趁热过滤用抽滤更快,用少量热水洗涤锥形瓶及漏斗上的残渣,抽干。
抽滤后若发现未反应的铁较多则应称量出未反应铁的质量。
若损失的铁较多,应重新计算硫酸铵质量。
(6)为保持溶液呈酸性,抑制水解,在反应基本结束后,加lmL3mol·L -1 H2SO4溶液,趁热过滤,防止因冷却使FeSO4晶体析出而造成损失。
五、思考题
1.为什么制备硫酸亚铁铵时要保持溶液有较强的酸性?
2.制备硫酸亚铁铵时为什么采用水浴加热法?。