质量内审检查表
- 格式:doc
- 大小:146.50 KB
- 文档页数:22
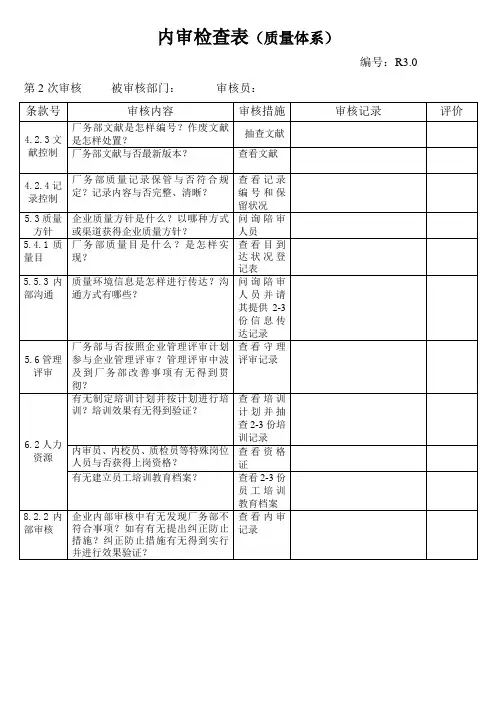
编号:R3.0 第2次审核被审核部门:审核员:
编号:LE-QC-QF-010R3.0 第2次审核被审核部门:审核员:
编号:QF-010R3.0 第2次审核被审核部门:审核员:
编号:-QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
第2次审核被审核部门:审核员:
内审检查表(质量体系)
第2次审核被审核部门:高管层审核员:
内审检查表(质量体系)
编号:-QF-010R3.0
内审检查表(质量体系)
编号:QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
编号:-QF-010R3.0 第2次审核被审核部门审核员:
内审检查表(质量体系)
编号:-QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
编号:-QF-010R3.0 第2次审核被审核部门审核员:
内审检查表(质量体系)
编号:-QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
编号-QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
编号:-QF-010R3.0。

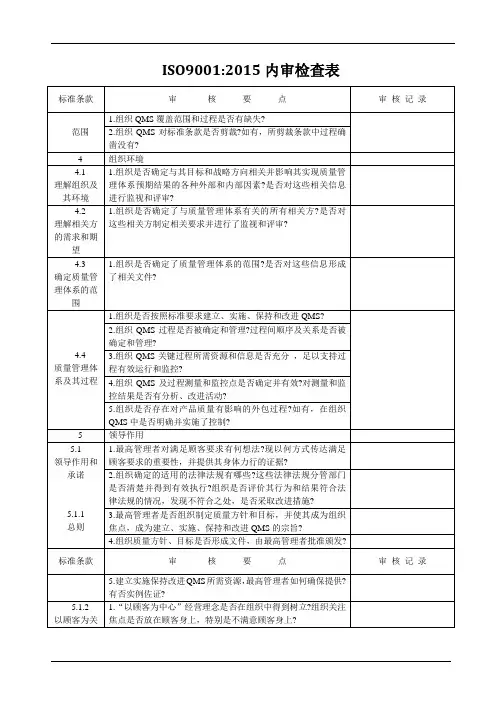
质量管理体系内审检查表内部审核检查表过程Q 4.1理解组织及其所处的环境审核内容1.是否建立了确定内、外部环境因素的机制(文件)。
2.在策划管理体系时有无考虑内外部环境的影响。
如:经营范围、财务表现、规模及设施、人力资源能力、技术优势、知识等(内部因素)及涉及法律法规和专利技术、市场占有率、主要合作伙伴及同行的影响、息渠道等(外部因素)。
3.如何收集、识别、分析、评审内外部因素。
4.是否持续地识别、分析、评审内外部因素,动态更新。
注意:该条款宜结合6.1条款风险的识别和应对一起审核。
Q 4.2理解相关方的需求和期望1.是否建立了识别相关方及其需求的机制(文件)。
2.如何识别、评价相关方;所识别的相关方是否适宜。
3.是否收集并确定这些相关方的需求及期望。
4.是否对这些相关方及其要求的息进行分析、监视和评审。
注意:该条款宜结合6.1条款风险的识别和应对一起审核。
Q 4.3确定质量管理体系的范围1.质量管理体系是否规定了明白的边界和范围。
2.公司在确定体系范围时是否考虑了内内部环境所带来的风险及其应对相关方要求和公司产品服务等因素。
3.体系范围是否形成文件,在什么文件中进行明确。
4.若体系标准的某些要求不适用,公司是否进行了声明,声明是否适宜。
审核发现(包括时间、地点、事实)结果1Q 4.4质量管理体系及其过程1.公司是否确定体系的整个过程,包括:是否确定了这些过程所需的输入和期望的输出;是否确定了这些过程的顺序和相互作用;是否确定和应用所需的准则和方法(包括监视、测量和相关绩效指标);是否确定这些进程所需的资源;是否分配这些进程的职责和权限;是否按照6.1的要求识别风险和机遇;是否有改进过程;是否对上述过程进行评价。
2.体系策划是否考虑了4.1、4.2条款的内容,是否包括了变换的策划。
3.形成了哪些质量管理体系文件以支持体系运行。
形成了哪些记录以证明体系的正常运行。
Q 5.1领导询问最高管理者: 作用和承诺1.是否清楚在质量管理体系中承担的职责。
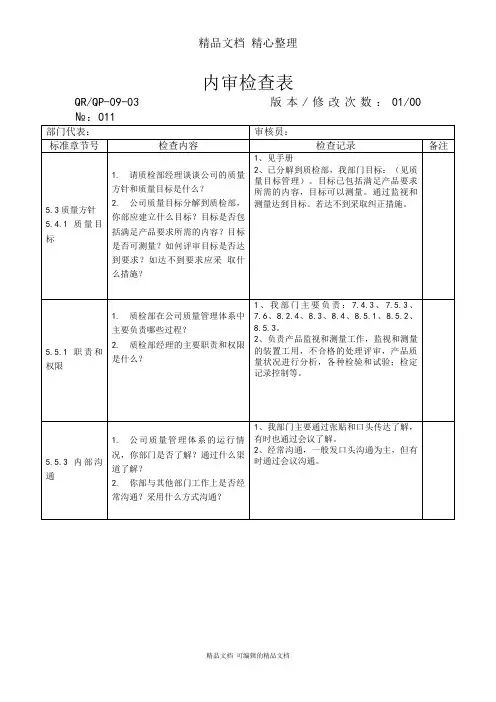

内部审核检查表注1:文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认).续表注1:文件查阅含记录的查阅.注2:“检查结果记录"栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认).注1:文件查阅含记录的查阅。
注2:“检查结果记录"栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认)。
注1:文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认).注1:文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认)。
注1:文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认)。
注1:文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认)。
注1:文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认).注1:文件查阅含记录的查阅.注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认).注1:文件查阅含记录的查阅。
注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认)。
注1:文件查阅含记录的查阅.注2:“检查结果记录”栏:符合○,轻微不符合△,严重不符合×(有不符合时要记录证据,并要求受审核部门当事人签名确认)。

内部质量体系审核检查表生产部
审核对象:生产部
审核日期:
审核人:
1. 质量控制
•生产过程控制
–是否按照生产计划进行生产?
–是否定期检查生产设备状态?
–是否对原材料进行检验并记录检验结果?
•产品质量管理
–是否制定产品质量标准?
–是否定期进行产品质量抽检?
–是否处理不合格产品的记录和处理流程?
2. 生产安全
•作业环境
–是否保持生产车间清洁整洁?
–是否定期进行安全隐患排查?
–是否提供员工必要的安全防护用品?
•作业操作
–是否员工经过必要的安全培训?
–是否严格执行作业操作规程?
–是否备案作业事故处理情况?
3. 员工管理
•员工素质
–是否定期进行员工素质培训?
–是否建立员工技能档案?
–是否定期进行员工绩效评价?
•人员配备
–是否进行生产岗位员工配备合理?
–是否有必要的人员调配预案?
–是否保持员工出勤记录?
以上为内部质量体系审核检查表生产部内容,审核人员应结合实际情况进行审核,确保生产部各项工作符合质量标准和安全要求。
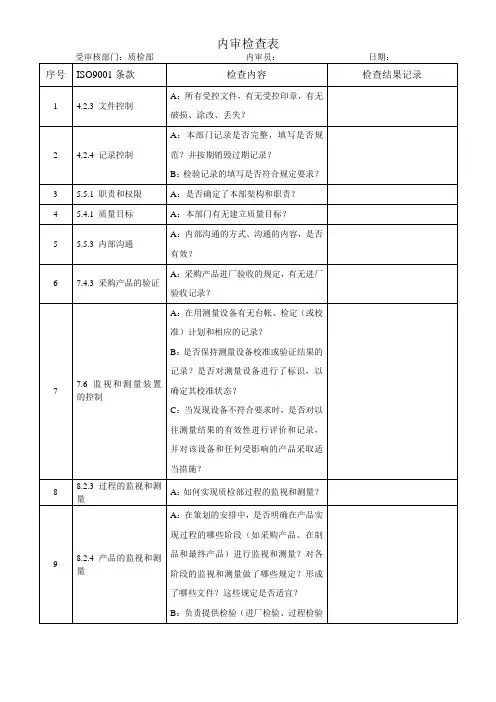
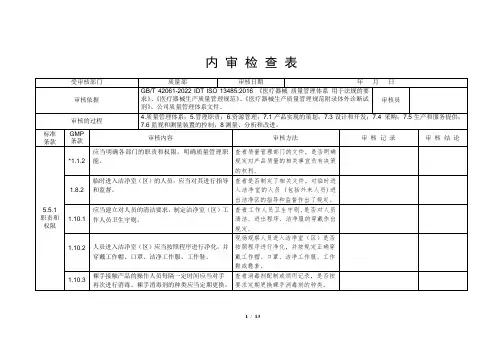
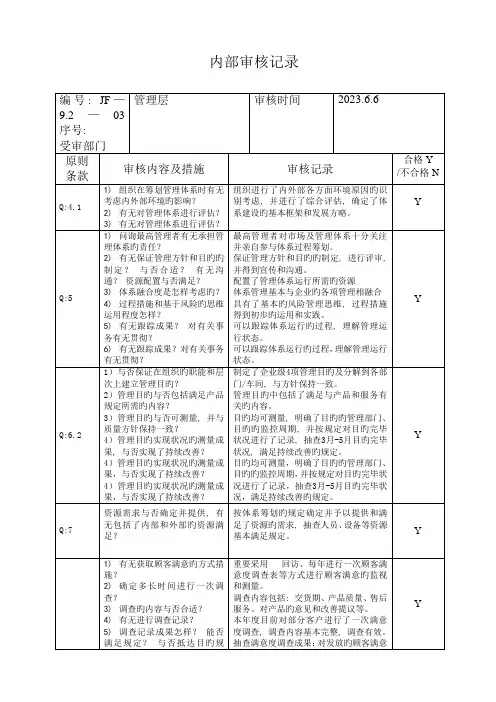
- 1 - 内部审核检查表受审部门领导层审核日期 9月 13 日 1) ISO9001:2000《质量管理体系要求》; 2)工厂制定的质量管理体系文件;审核依据审核员 3)有关产品的标准及法律法规的要求等 4.1;4.2.1;5.1;5.2;5.3;5.4.1;5.4.2;5.5.1;5.5.2;5.5.3;5.6( 9 月 13 日进行);6.1;7.1;审核事项8.1;8.5.1;8.5.3。
No. 审核内容及方法审核结果记录及判定● 组织如何识别过程及其应用; ● 过程的作用及顺序如何; 4.1 依据ISO9000的标准建立QMS体系,建立健全了QMS,并● 为确保过程有效运行和控制的准则和方总要求保持了质量管理体系。
QMS的运行和监视取得了一定成果,质量法; 管理体系得到了改进。
● 获得的信息和资源如何; 判定合格。
● 如何监视和测量分析过程; ● 实施哪些措施以改进质量管理体系; ● 组织的外包过程有哪些. ● 组织的质量管理体系文件的构成如何?是否包括了如下: 4.2.1 △质量方针.目标; 经过审核,质量管理体系文件是由质量方针、目标,质量手总则△质量手册; 册、程序文件,作业指导文件、工艺规程、检验规范等构成,规△程序文件; 范了总体质量管理体系的策划要求。
△为确保过程有效运行的文件有哪些; 判定合格。
△规定了哪些记录. ● 最高管理者对建立.实施和保持质量管理体系承诺提供哪些证据?△最高管理者如何认识满足顾客的要求和总经理说:我们掌握的有合同法、消防法、铸件的协会法规5.1 法律、法规要求的重要性?等,专业文件,以口头或文件对不同层次作出具体要求及资源存管理△最高管理者采取了哪些相应措施将满足在等。
经审核其制定、实施和坚持与公司经营宗旨相一致的质量职责顾客要求的法律、法规要求的重要性传达方针与目标等。
给组织的成员?判定合格。
△是否制定质量方针?△质量目标的确定如何? △是否主持了管理评审? △资源获得情况如何? ● 组织如何确定顾客的需求和期望? 5.2 ● 将顾客的需求和期望转化为要求的形式通过电传或上门专访已达到顾客的需求。
制药集团质量部内审检查表(***制药)受检部门:质量部文件编号:审核人:审核日期:审核条款审核内容是否符合缺陷项内容备注1文件控制1、是否建立文件的编制、变更、审查、批准、撤销、发放及保管管理制度是□否□2、文件是否保持清晰、易于识别?是否有受控标识?是□否□3、现场摆放文件是否为现行版本?是□否□4、是否工艺用水、原辅料、中间产品成品都建立质量标准、内控质量标准并根据质量标准制定了检验操作规范。
是□否□5、原辅包、半成品、成品的请验是否有文件规定?抽样量是否符合规定?是□否□2、检验6、原辅包、半成品、成品的抽样量是否有相应记录?被抽样物品有无取样证?检查取样人员是否经授权?是□否□7、检验记录包含内容:产品物料的名称、规格、批号来源、依据的质量标准检验SOP及标准仪器设备型号和编号?检验所用培养基配制编号对照品或标准品来源及批号。
是否包括主要过程、计算过程?检验结果包括:观察情况、计算过程、原始图谱或曲线图。
检验日期、检验结论检验人员及复核人签字。
是□否□8、检验报告和检验记录是否由负责人审核?并签字?是□否□9、如有委托检验,是否保存相应的资质档案、检验报告?是□否□3、物料监控10、物料的取样检验放行是否符合要求?是□否□11、是否按规定进行物料的复验?是□否□12、标签说明书是否与药监部门批准一致?是否经质量管理部门校对后印制、发放、使用?是□否□13、不合格物料是否按规定处理?是否有QA的处理意见和签字?是□否□14、是否有物料销毁记录?物料销毁是否经QA批准及签字?是□否□4、生产过程监控15、是否对生产过程的关键操作和工艺参数进行监控?是否明确了关键工序?确定质量控制点?是否有相关的规定和记录?是□否□16、操作人员是否及时填写批记录?是□否□17、是否对更换品种进行了清场控制?确认合格后才可以进行其他品种生产并保存清场记录?是□否□17、不同品种产品生产是否做到有效的隔离或其他防止混淆的有效措施?是□否□18、对工艺用水的生产进行监控?是□否□5、检验用菌种、培养基、试剂标准品管理19、检验用菌种、培养基、试剂标准品是否接收记录以及适当标识内容至少包括名称、批号开启日期含量或效价、贮存条件?使用记录台账?是□否□20、菌种购买、贮存、接种、传代是否符合GMP规定?是□否□21、检验用试剂及标准溶液是否有配制记录?标识(如名称、浓度配制日期有效期及配制人)贮存是否得当?是□否□22、检验所用培养基是否进行适用性检查,并有相应的记录。
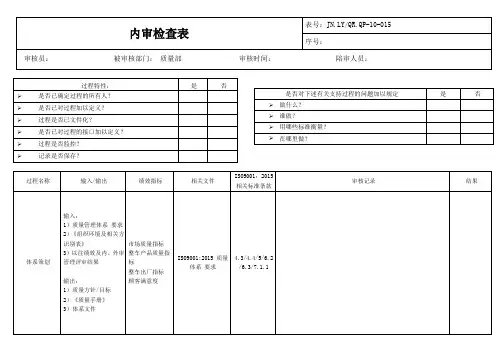
内审检查表
编号:JY/QR8.2.2-02
审核员:姚伟波、钟福丽、刘艳群日期:2015.3.10
内审检查表
编号:JY/QR8.2.2-02
第2 页共21页
审核员:姚伟波、钟福丽、刘艳群日期:2015.3.10
内审检查表
编号:JY/QR8.2.2-02
内审检查表
编号:JY/QR8.2.2-02
第4页共21 页
内审检查表
编号:JY/QR8.2.2-02
第 5 页共21页
审核员:姚伟波、钟福丽、刘艳群日期:2015.3.10
内审检查表
编号:JY/QR8.2.2-02
第 6 页共21页
内审检查表
编号:JY/QR8.2.2-02
第7 页共21 页
内审检查表
编号:JY/QR8.2.2-02
审审核员:刘艳群日期:2015.3.11
内审检查表
编号:JY/QR8.2.2-02
内审检查表
编号:JY/QR8.2.2-02
审核员:姚伟波日期:2015.3.10
内审检查表
编号:JY/QR8.2.2-02
审核员:姚伟波日期:2015.3.10
内审检查表
编号:JY/QR8.2.2-02
审核员:姚伟波日期:2015.3.10
内审检查表
编号:JY/QR8.2.2-02
审核员:刘艳群日期:2015.3.11
内审检查表
编号:JY/QR8.2.2-02
第14页共21 页
审核员:刘艳群日期:2015.3.11
内审检查表
编号:JY/QR8.2.2-02
第15 页共21页
审核员:刘艳群日期:2015.3.11
内审检查表
编号:JY/QR8.2.2-02
审核员:刘艳群日期:2015.3.11
内审检查表
编号:JY/QR8.2.2-02
内审检查表
编号:JY/QR8.2.2-02
内审检查表
编号:JY/QR8.2.2-02
审核员:姚伟波日期:2015.3.10
内审检查表
编号:JY/QR8.2.2-02
审核员:姚伟波日期:2015.3.10。