质量部内审检查表
- 格式:docx
- 大小:24.60 KB
- 文档页数:5
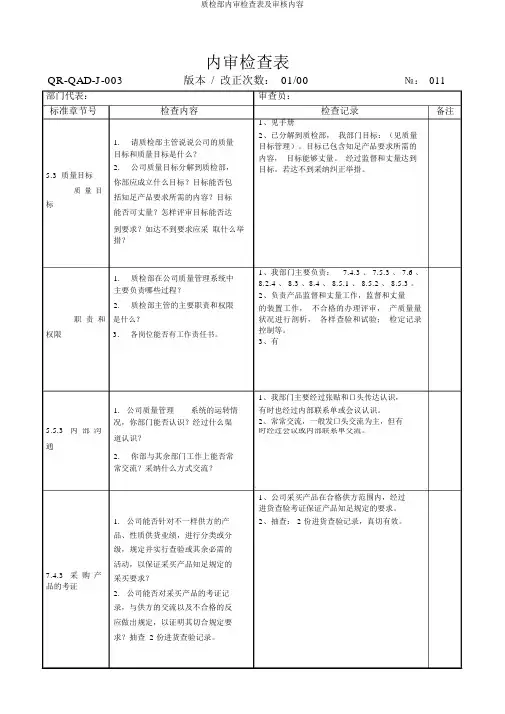
QR-QAD-J-003版本/改正次数:01/00№:011部门代表:审查员:标准章节号检查内容检查记录备注1、见手册1.请质检部主管说说公司的质量目标和质量目标是什么?2.公司质量目标分解到质检部,5.3 质量目标你部应成立什么目标?目标能否包质量目括知足产品要求所需的内容?目标标能否可丈量?怎样评审目标能否达到要求?如达不到要求应采取什么举措?1.质检部在公司质量管理系统中主要负责哪些过程?2.质检部主管的主要职责和权限职责和是什么?权限 3.各岗位能否有工作责任书。
2、已分解到质检部,我部门目标:(见质量目标管理)。
目标已包含知足产品要求所需的内容,目标能够丈量。
经过监督和丈量达到目标。
若达不到采纳纠正举措。
1、我部门主要负责:7.4.3 、 7.5.3 、 7.6 、8.2.4 、 8.3 、8.4 、 8.5.1 、 8.5.2 、 8.5.3 。
2、负责产品监督和丈量工作,监督和丈量的装置工作,不合格的办理评审,产质量量状况进行剖析,各样查验和试验;检定记录控制等。
3、有1、我部门主要经过张贴和口头传达认识,1. 公司质量管理系统的运转情有时也经过内部联系单或会议认识。
况,你部门能否认识?经过什么渠2、常常交流,一般发口头交流为主,但有5.5.3 内部沟时经过会议或内部联系单交流。
道认识?通2.你部与其余部门工作上能否常常交流?采纳什么方式交流?1、公司采买产品在合格供方范围内,经过进货查验考证保证产品知足规定的要求。
1. 公司能否针对不一样供方的产2、抽查: 2 份进货查验记录,真切有效。
品、性质供货业绩,进行分类或分级,规定并实行查验或其余必需的活动,以保证采买产品知足规定的7.4.3 采购产采买要求?品的考证2. 公司能否对采买产品的考证记录,与供方的交流以及不合格的反应做出规定,以证明其切合规定要求?抽查 2 份进货查验记录。
QR-QAD-J-003版本 / 改正次数: 01/00№: 012标准章节号检查内容检查记录备注1、用表记牌表记,分为待检区、待测试区、7.5.3 表记和不合格品区、合格品区。
编号:R3.0 第2次审核被审核部门:审核员:
编号:LE-QC-QF-010R3.0 第2次审核被审核部门:审核员:
编号:QF-010R3.0 第2次审核被审核部门:审核员:
编号:-QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
第2次审核被审核部门:审核员:
内审检查表(质量体系)
第2次审核被审核部门:高管层审核员:
内审检查表(质量体系)
编号:-QF-010R3.0
内审检查表(质量体系)
编号:QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
编号:-QF-010R3.0 第2次审核被审核部门审核员:
内审检查表(质量体系)
编号:-QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
编号:-QF-010R3.0 第2次审核被审核部门审核员:
内审检查表(质量体系)
编号:-QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
编号-QF-010R3.0 第2次审核被审核部门:审核员:
内审检查表(质量体系)
编号:-QF-010R3.0。

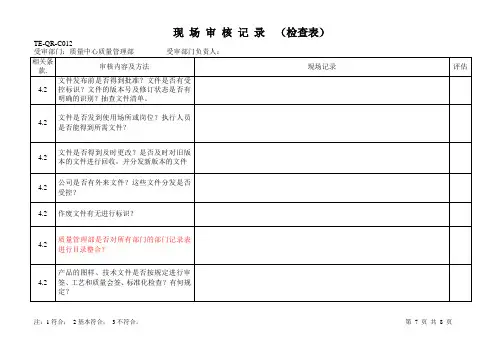


质量管理体系内审检查表内部审核检查表过程Q 4.1理解组织及其所处的环境审核内容1.是否建立了确定内、外部环境因素的机制(文件)。
2.在策划管理体系时有无考虑内外部环境的影响。
如:经营范围、财务表现、规模及设施、人力资源能力、技术优势、知识等(内部因素)及涉及法律法规和专利技术、市场占有率、主要合作伙伴及同行的影响、息渠道等(外部因素)。
3.如何收集、识别、分析、评审内外部因素。
4.是否持续地识别、分析、评审内外部因素,动态更新。
注意:该条款宜结合6.1条款风险的识别和应对一起审核。
Q 4.2理解相关方的需求和期望1.是否建立了识别相关方及其需求的机制(文件)。
2.如何识别、评价相关方;所识别的相关方是否适宜。
3.是否收集并确定这些相关方的需求及期望。
4.是否对这些相关方及其要求的息进行分析、监视和评审。
注意:该条款宜结合6.1条款风险的识别和应对一起审核。
Q 4.3确定质量管理体系的范围1.质量管理体系是否规定了明白的边界和范围。
2.公司在确定体系范围时是否考虑了内内部环境所带来的风险及其应对相关方要求和公司产品服务等因素。
3.体系范围是否形成文件,在什么文件中进行明确。
4.若体系标准的某些要求不适用,公司是否进行了声明,声明是否适宜。
审核发现(包括时间、地点、事实)结果1Q 4.4质量管理体系及其过程1.公司是否确定体系的整个过程,包括:是否确定了这些过程所需的输入和期望的输出;是否确定了这些过程的顺序和相互作用;是否确定和应用所需的准则和方法(包括监视、测量和相关绩效指标);是否确定这些进程所需的资源;是否分配这些进程的职责和权限;是否按照6.1的要求识别风险和机遇;是否有改进过程;是否对上述过程进行评价。
2.体系策划是否考虑了4.1、4.2条款的内容,是否包括了变换的策划。
3.形成了哪些质量管理体系文件以支持体系运行。
形成了哪些记录以证明体系的正常运行。
Q 5.1领导询问最高管理者: 作用和承诺1.是否清楚在质量管理体系中承担的职责。
制药集团质量部内审检查表(***制药)受检部门:质量部文件编号:审核人:审核日期:审核条款审核内容是否符合缺陷项内容备注1文件控制1、是否建立文件的编制、变更、审查、批准、撤销、发放及保管管理制度是□否□2、文件是否保持清晰、易于识别?是否有受控标识?是□否□3、现场摆放文件是否为现行版本?是□否□4、是否工艺用水、原辅料、中间产品成品都建立质量标准、内控质量标准并根据质量标准制定了检验操作规范。
是□否□5、原辅包、半成品、成品的请验是否有文件规定?抽样量是否符合规定?是□否□2、检验6、原辅包、半成品、成品的抽样量是否有相应记录?被抽样物品有无取样证?检查取样人员是否经授权?是□否□7、检验记录包含内容:产品物料的名称、规格、批号来源、依据的质量标准检验SOP及标准仪器设备型号和编号?检验所用培养基配制编号对照品或标准品来源及批号。
是否包括主要过程、计算过程?检验结果包括:观察情况、计算过程、原始图谱或曲线图。
检验日期、检验结论检验人员及复核人签字。
是□否□8、检验报告和检验记录是否由负责人审核?并签字?是□否□9、如有委托检验,是否保存相应的资质档案、检验报告?是□否□3、物料监控10、物料的取样检验放行是否符合要求?是□否□11、是否按规定进行物料的复验?是□否□12、标签说明书是否与药监部门批准一致?是否经质量管理部门校对后印制、发放、使用?是□否□13、不合格物料是否按规定处理?是否有QA的处理意见和签字?是□否□14、是否有物料销毁记录?物料销毁是否经QA批准及签字?是□否□4、生产过程监控15、是否对生产过程的关键操作和工艺参数进行监控?是否明确了关键工序?确定质量控制点?是否有相关的规定和记录?是□否□16、操作人员是否及时填写批记录?是□否□17、是否对更换品种进行了清场控制?确认合格后才可以进行其他品种生产并保存清场记录?是□否□17、不同品种产品生产是否做到有效的隔离或其他防止混淆的有效措施?是□否□18、对工艺用水的生产进行监控?是□否□5、检验用菌种、培养基、试剂标准品管理19、检验用菌种、培养基、试剂标准品是否接收记录以及适当标识内容至少包括名称、批号开启日期含量或效价、贮存条件?使用记录台账?是□否□20、菌种购买、贮存、接种、传代是否符合GMP规定?是□否□21、检验用试剂及标准溶液是否有配制记录?标识(如名称、浓度配制日期有效期及配制人)贮存是否得当?是□否□22、检验所用培养基是否进行适用性检查,并有相应的记录。