溶液的渗透压05-15
- 格式:ppt
- 大小:2.25 MB
- 文档页数:26

儿科补液最简单的方法判断某溶液的张力,是以它的渗透压与血浆渗透压正常值(280~320mosm/L,计算时取平均值300mosm/L)相比所得的比值,它是一个没有单位但却能够反映物质浓度的一个数值。
溶液渗透压=(百分比浓度×10×1000×每个分子所能离解的离子数)/分子量。
如0.9%NaCl溶液渗透压=(0.9×10×1000×2)/58.5=308mOsm/L(794.2kPa)该渗透压与血浆正常渗透压相比,比值约为1,故该溶液张力为1 张。
又如5%NaHCO3 溶液渗透压=(5×10×1000×2)/84=1190.4mOsm/L(3069.7kPa)该渗透压与血浆正常渗透压相比,比值约为4,故该溶液张力为4 张。
对以上复杂的计算过程,不要求学生掌握,但要记住张力是物质浓度的一种表达方式,其换算自然亦遵循稀释定律:C1×V1=C2×V2。
然后列出课本上已标明相应张力的几种常用溶液:10%(NaCl)11 张(临床上可按10 张计算)0.9%(NaCl)1 张5%(NaHCO3)4 张10%(KCl)9 张10%(GS)0 张(无张力,相当于水)并指出,临床上多数情况下就是用以上几种溶液配制成其它所需的液体进行治疗,只需记住此几种溶液的张力,便可灵活自如地进行配制与计算所需溶液及张力;而不必去究为什么10%NaCl张力是10 张这一复杂的计算过程。
4、举例说明混合溶液张力的计算例2、10%NaCl(10ml)+10%GS(90ml),请问该组溶液张力。
同学们很快能够根据C1×V1=C2×V2 列出算式:10×10=X×100,X=1 张例3、10%NaCl(20ml)+5%NaHCO3(25ml)+10%GS(255ml),请问该组溶液张力。
10×20+4×25=X×300,X=1 张。

目录第一节工程概述1、系统概述2、设计基础资料第二节制水工艺1、除盐水工艺流程方框图2、反渗透清洗工艺方框图3、混床再生工艺方框图4、过滤器反冲洗工艺方框图5、工艺流程说明第三节系统操作1、多介质过滤器2、阻垢剂加药装置3、保安过滤器4、RO装置5、混合离子交换器第四节运行注意事项及维护0第一节工程概述1、系统概述锅炉补给水处理系统为地下水经多介质过滤、反渗透加一级混合离子交换除盐;多介质过滤主要的悬浮物及有机物。
RO系统主要用于去除水中各种溶解固形物、胶体硅。
混合离子交换器除盐设备用于去除水中的各种盐份。
2、设计基础资料1)设计产水量:预处理及反渗透系统:200m3/h配套混床系统:300 m3/h2)原水水质:K++Na+ 16.67mg/LCa+ 89.13mg/LMg+ 32.20mg/LCl- 17.10mg/LSO42- 94.60mg/LHCO3+ 315.13mg/LNO3- 8.30mg/LPH 7.2游离性CO2 2.3mg/L固溶物 453.75mg/L3)出水水质:电导率: ≤0.2μS/cmSiO2: ≤0.02mg/L12第二节 制水工艺1、除盐水工艺流程方框图深 井 水2、反渗透清洗工艺方框图清洗液 排放3、混床再生工艺方框图4、过滤器反冲洗工艺方框图反渗透浓水 浓水收集池 反冲洗泵 多介质过滤器5、 工艺流程说明本除盐水站预处理及反渗透系统设计产水量200 m 3/h ,按2×100 m 3/h 反渗透装置进行设计,混床产设计水量300 m 3/h 。
该系统由预处理系统、反渗透(RO )系统、深度除盐处理系统等部分组成。
预处理部分结合原水水质的特点以多介质过滤器为主体的工艺,深度除盐处理部分则结合反渗透系统的淡水出水特性采用除碳器结合混床工艺。
1)预处理部分结合原水水质及RO膜元件对进水中的微溶盐、胶体、微生物、有机物及其它各种杂质颗粒等均有较高的要求,对预处理采取的具体措施如下:采用二层滤料的多介质过滤器,滤除水中颗粒和悬浮物,使出水水质的污染指数(SDI)满足要求。
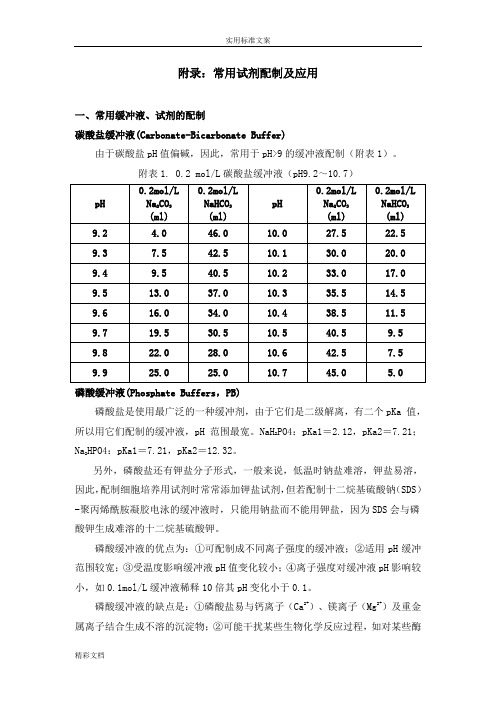
附录:常用试剂配制及应用一、常用缓冲液、试剂的配制碳酸盐缓冲液(Carbonate-Bicarbonate Buffer)由于碳酸盐pH值偏碱,因此,常用于pH>9的缓冲液配制(附表1)。
附表1. 0.2 mol/L碳酸盐缓冲液(pH9.2~10.7)磷酸缓冲液(Phosphate Buffers,PB)磷酸盐是使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,PO4:pKa1=2.12,pKa2=7.21;所以用它们配制的缓冲液,pH 范围最宽。
NaH2HPO4:pKa1=7.21,pKa2=12.32。
Na2另外,磷酸盐还有钾盐分子形式,一般来说,低温时钠盐难溶,钾盐易溶,因此,配制细胞培养用试剂时常常添加钾盐试剂,但若配制十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳的缓冲液时,只能用钠盐而不能用钾盐,因为SDS会与磷酸钾生成难溶的十二烷基硫酸钾。
磷酸缓冲液的优点为:①可配制成不同离子强度的缓冲液;②适用pH缓冲范围较宽;③受温度影响缓冲液pH值变化较小;④离子强度对缓冲液pH影响较小,如0.1mol/L缓冲液稀释10倍其pH变化小于0.1。
磷酸缓冲液的缺点是:①磷酸盐易与钙离子(Ca2+)、镁离子(Mg2+)及重金属离子结合生成不溶的沉淀物;②可能干扰某些生物化学反应过程,如对某些酶的催化活性具有一定程度的抑制作用。
NaH2PO4的pH值偏酸性,可用作pH<4的缓冲液。
Na2HPO4的pH值偏碱性,可用作pH>10的缓冲液。
而pH=6~8的中性缓冲液是更常用的缓冲液,需要NaH2PO4与Na2HPO4两种磷酸盐混合配制(附表2)。
附表2. 0.2 mol/L磷酸盐缓冲液(pH5.7~8.2)磷酸盐缓冲溶液(Phosphate-buffered saline, PBS)磷酸盐缓冲液是在磷酸缓冲液基础上添加NaCl以维持溶液的渗透压,因此,PBS适用于做细胞缓冲液,常用PBS配制如下。

无机及分析化学第一次习题课习题一.选择题()1、Fe(OH)3 正溶胶在电场作用下,向负极移动的是A 胶核B 胶粒C 胶团D 反离子()2、分析铁矿石中Fe的含量4次,测得结果为1.61%,1.53%,1.54 %,1.83%.在置信度为90 %时,用Q检验法判断,查表Q0.90=0.76。
则A、1.53%为可疑值B、1.83%为可疑值C、无可疑值D、1.53%和1.83%均为可疑值( ) 3 . 试剂中含有微量被测组分会产生系统误差,消除的方法是:A.用化学方法除去微量被测组分B.作对照试验C.作空白试验D.加入掩蔽剂( ) 4. 反应3H2(g) +N2(g) = 2NH3(g) 的△rHθ< 0 ,欲增大正反应速率, 下列措施中无用的是A. 增加H2 的分压B.升温C. 减小NH3的分压D.加正催化剂( ) 5. 下列各组物理量中,全部是状态函数的是A. P Q VB. H U WC. U H GD. S △H △G( ) 6. 如果相对误差表示为: (40.31-40.28)/40.28 ,则按有效数字的运算规则,其结果应为A. 9.926×10-4B. 9.925 ×10-4C. 9.93×10-4D. 0.001 ( ) 7.A= B+C 是吸热的可逆反应,正反应的活化能是Ea(正), 逆反应的活化能是Ea(逆), 那么,Ea(正) 与Ea(逆) 的关系是A.等于B. 小于C. 大于D. 无法确定( ) 8.某温度下,反应2SO2(g) +O2(g) = 2SO3(g) 的平衡常数为K, 则同一温度下,反应SO3(g) = SO2 (g) +1/2O2(g) 的平衡常数为A.1/(Kθ)1/2B.Kθ/2C.1/KθD.2Kθ( ) 9.与拉乌尔定律有关的主要是A. 凝固点降低B.蒸汽压降低C. 沸点升高D.渗透压降低( ) 10.用因保存不当失去部分结晶水的草酸(H2C2O4.2H2O) 作基准物质来标定NaOH溶液的浓度,标定结果A. 偏高B. 偏低C. 准确D. 不确定( ) 11.CaO(s) +H2O(l) = Ca(OH)2(s),在298K及标准状态下反应自发进行,高温时其逆反应为自发,这表明该反应的类型是A. △rHmθ< O ,△rSmθ< OB. △rHmθ< 0 ,△rSmθ>0C. △rHmθ>O ,△rSmθ>0D. △rHmθ>0 ,△rSm θ< O( ) 12. 反应B→A ,B→C 的恒压热效应分别为△H1,△H2则反应C→A的恒压热效应为:A.△H1+△H2 B △H1-△H2 C.△H2-△H1 D.2△H1-2△H2( ) 13. 已知化学反应2H2(g) +2NO(g) = 2H2O(g) +N2(g) 速率方程式为V=KPH2P2NO. 则该反应的级数为A.1B.2C.3D.4( ) 14. 在恒压下,任何温度时都可自发进行的反应是A. △Hθ> 0 △Sθ< 0B.△Hθ< 0 △Sθ> 0C. △Hθ> 0 △Sθ> 0D.△Hθ< 0 △Sθ<0()15. A+B =C+D 是吸热的可逆反应,其中正反应的活化能为Ea(正), 逆反应的活化能为Ea(逆),则下列表述正确的是A.Ea(正) > Ea(逆)B.Ea(正) = Ea(逆)C.Ea(正) <Ea(逆)D.无法确定( ) 16. 下列物质中, 可用作基准物质的是A. NaOH(分析纯)B.HCl(分析纯)C. K2Cr2O7(化学纯)D.Na2B4O710H2O(分析纯)() 17. 在Pθ和373K 时H2O(g)→H2O(l) 体系中应是A.△H=0B. △S=0C.△G=0D.△U=0( ) 18.CuCl2(S) +Cu(S) =2 CuCl(S) △rHmθ=170kJ/molCu(s) +Cl2(g) = CuCl2(s) △rHmθ=206kJ/mol则CuCl(s) 的△fHmθ应为:A.36KJ/molB.18kJ/molC.-18KJ/molD.-36KJ/mol( ) 19.水的汽化热44.0KJ/mol则1.00mol水蒸气在100℃时凝聚为液态水的熵变A.118Jmol-1k-1B. 0C. -118Jmol-1k-1D.-59Jmol-1.k-1.( ) 20.一般说温度升高,反应速率明显增加,主要原因在于A. 反应物浓度增大B. 反应物压力增加C.活化能降低D. 活化分子百分率增加()21.PCl5分解反应为PCl5 PCl3 + Cl2在200℃达到平衡时,PCl5 有48℅分解;在300℃平衡时有97℅分解.则此反应是A. 放热反应B.吸热反应C. 既不放热也不吸热D. 可计算平衡常数为2( ) 22.对于一个确定的化学反应来说.下列说法正确的是A △rGmθ越负, 反应速率越快 B.△rHmθ越负,反应速率越快C.活化能越大, 反应速率越快D. .活化能越小, 反应速率越快( ) 23.反应2NO(g) +2H2 (g) →N2(g) +2H2O(g) 速率常数K的单位为L2.mol-2s-1则反应级数n是A. 0B. 1C. 2D.3( ) 24.下列叙述正确的是A. 非基元反应是有若干个基元反应组成的B. 凡速率方程中各物质浓度的指数等于反应式中其计量系数时,反应必为基元反应C. 反应级数等于反应物在方程式中计量系数之和D. 反应速率与反应物浓度成正比( ) 25.标准压力下,石墨燃烧反应△rHmθ=-393.7 KJ /mol 金刚石燃烧反应的焓变-395.6KJ/mol.则石墨转化为金刚石时反应的焓变为A. -789.3 KJ/molB. 0C. 1.9KJ/molD.- 1.9 KJ/mol二、简答题1. 可采用什么方法提高水的沸点?2. 为什么海水较河水难结冰?3. 海水鱼能生活在淡水中吗?为什么?4. 为什么施肥过多会将作物“烧死”?5. 凡是稀溶液的沸点都比纯溶剂高吗?为什么?为什么明矾能净水?7. 举例说明什么是状态函数,它的基本特征是什么?8. 热力学第一定律的适用条件是什么?9. 何谓化学反应热?定容热和定压热的关系如何?10. 什么是盖斯定律?盖斯定律在热化学中有何重要意义?11. 什么是吉布斯—亥姆霍兹方程,该方程对于判断反应的自发性有何意义。


反渗透技术原理是在高于溶液渗透压的作用下,依据其他物质不能透过半透膜而将这些物质和水分离开来。
反渗透膜的膜孔径非常小,因此能够有效地去除水中的溶解盐类、胶体、微生物、有机物等。
系统具有水质好、耗能低、无污染、工艺简单、操作简便等优点。
反渗透系统优点:1、连续运行,产水水质稳定2、无须用酸碱再生,不会因再生而停机,节省了反冲和清洗用水3、以高产率产生超纯水(产率可以高达95%)4、无再生污水,不须污水处理设施5、应用于预除盐处理也取得较好的效果,能使离子交换树脂的负荷减轻松90%以上,树脂的再生剂用量也可减少90%6、使用安全可靠,避免工人接触酸碱7、减低运行及维修成本8、安装简单、安装费用低廉主要品牌反渗透膜国内现主要应用国外反渗透膜品牌,具体品牌有:海德能膜HYDRANAUTICS 陶氏膜DOW 东丽膜TORAY 日东电工膜NittoDenko 世韩膜SAEHAN等用于反渗透法中制备纯水的半透膜。
一般用高分子材料制成。
如醋酸纤维素膜、芳香族聚酰肼膜、芳香族聚酰胺膜。
表面微孔的直径一般在0.5~10nm之间,透过性的大小与膜本身的化学结构有关。
有的高分子材料对盐的排斥性好,而水的透过速度并不好。
有的高分子材料化学结构具有较多亲水基团,因而水的透过速度相对较快。
因此一种满意的反渗透膜应具有适当的渗透量或脱盐率。
反渗透膜应具有以下特征:(1)在高流速下应具有高效脱盐率;(2)具有较高机械强度和使用寿命;(3)能在较低操作压力下发挥功能;(4)能耐受化学或生化作用的影响;(5)受pH值、温度等因素影响较小;(6)制膜原料来源容易,加工简便,成本低廉。
反渗透膜的结构,有非对称膜和复合膜两类。
当前使用的膜材料主要为三醋酸纤维素和芳香聚酰胺类。
其组件有中空纤维式、卷式、板框式和管式。
可用于分离、浓缩、纯化等化工单元操作,主要用于纯水制备和水处理行业中。
离子交换树脂原理:离子交换树脂是一种聚合物,带有相应的功能基团。
实验1 植物组织渗透势的测定(质壁分离法)一、实验目的观察植物组织在不同浓度溶液中细胞质壁分离的产生过程及其用于测定植物组织渗透势的方法。
二、实验原理当植物组织细胞内的汁液与其周围的某种溶液处于渗透平衡状态,植物细胞内的压力势为零时,细胞汁液的渗透势就等于该溶液的渗透势。
该溶液的浓度称为等渗浓度。
当用一系列梯度浓度溶液观察细胞质壁分离现象时,细胞的等渗浓度将介于刚刚引起初始质壁分离的浓度和尚不能引起质壁分离的浓度之间的溶液浓度。
代入公式即可计算出渗透势。
三、实验仪器、试剂、材料等显微镜;载玻片及盖玻片;镊子;刀片配成0.5—0.1mol/L梯度浓度的蔗糖溶液各50ml。
称34.23g蔗糖用蒸馏水配成100ml,其浓度为1m0le/L(母液)。
再配制成下列各种浓度:0.50mol/L:吸母液25ml+水25ml0.45mol/L:吸母液22.5ml+水27.5ml0.40mol/L:吸母液20.0ml+水30.0ml0.35mol/L:吸母液17.5ml+水32.5ml0.30mol/L:吸母液15.0ml+水35.0ml0.25mol/L:吸母液12.5ml+水37.5ml0.20mol/L:吸母液10.0ml+水40.0ml0.15mol/L:吸母液7.5ml+水42.5ml0.10mol/L:吸母液5.0ml+水45.0ml四、实验方法将带有色素的植物组织(叶片),一般选用有色素的洋葱鳞片的外表皮、紫鸭跖草、苔藓、红甘蓝或黑藻、丝状藻等水生植物,也可用蚕豆、玉米、小麦等作物叶的表皮。
撕取下表皮,迅速分别投入各种浓度的蔗糖溶液中,使其完全浸入,5—10分钟后,从0.5mol/L开始依次取出表皮薄片放在滴有同样溶液的载玻片上,盖上盖玻片,于低倍显微镜下观察,如果所有细胞都产生质壁分离的现象,则取低浓度溶液中的制片作同样观察,并记录质壁分离的相对程度。
实验中必须确定一个引起半数以上细胞原生质刚刚从细胞壁的角隅上分离的浓度,和不引起质壁分离的最高浓度。
附录:常用试剂配制及应用一、常用缓冲液、试剂的配制碳酸盐缓冲液(Carbonate-Bicarbonate Buffer)由于碳酸盐pH值偏碱,因此,常用于pH>9的缓冲液配制(附表1)。
附表1. 0.2 mol/L碳酸盐缓冲液(pH9.2~10.7)磷酸缓冲液(Phosphate Buffers,PB)磷酸盐是使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,PO4:pKa1=2.12,pKa2=7.21;所以用它们配制的缓冲液,pH 范围最宽。
NaH2HPO4:pKa1=7.21,pKa2=12.32。
Na2另外,磷酸盐还有钾盐分子形式,一般来说,低温时钠盐难溶,钾盐易溶,因此,配制细胞培养用试剂时常常添加钾盐试剂,但若配制十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳的缓冲液时,只能用钠盐而不能用钾盐,因为SDS会与磷酸钾生成难溶的十二烷基硫酸钾。
磷酸缓冲液的优点为:①可配制成不同离子强度的缓冲液;②适用pH缓冲范围较宽;③受温度影响缓冲液pH值变化较小;④离子强度对缓冲液pH影响较小,如0.1mol/L缓冲液稀释10倍其pH变化小于0.1。
磷酸缓冲液的缺点是:①磷酸盐易与钙离子(Ca2+)、镁离子(Mg2+)及重金属离子结合生成不溶的沉淀物;②可能干扰某些生物化学反应过程,如对某些酶的催化活性具有一定程度的抑制作用。
NaH2PO4的pH值偏酸性,可用作pH<4的缓冲液。
Na2HPO4的pH值偏碱性,可用作pH>10的缓冲液。
而pH=6~8的中性缓冲液是更常用的缓冲液,需要NaH2PO4与Na2HPO4两种磷酸盐混合配制(附表2)。
附表2. 0.2 mol/L磷酸盐缓冲液(pH5.7~8.2)磷酸盐缓冲溶液(Phosphate-buffered saline, PBS)磷酸盐缓冲液是在磷酸缓冲液基础上添加NaCl以维持溶液的渗透压,因此,PBS适用于做细胞缓冲液,常用PBS配制如下。