鲁教版九年级上册第三单元第一节溶液的形成
- 格式:ppt
- 大小:2.17 MB
- 文档页数:27

第三单元溶液第一节溶液的形成可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 Ca—40一、选择题1.以下是厨房中的常见物质,将其分散到水中不能形成溶液的是〔〕A. 花生油B. 纯碱C. 食盐D. 白糖2.以下有关溶液的说法正确的选项是〔〕A. 盐水的沸点比水的低B. 无色澄清的液体一定是溶液C. 只有固体能作溶质D. 溶液的各局部性质都相同3.学习完溶液的知识后,下面几位同学根据各自的理解分别配制了溶液,你认为能形成溶液的是〔〕4.即食即热型快餐的内层是用铝箔真空包装的食物,外层那么分别包装两包物质,使用时拉动预留在外的拉线,使这两种物质反响,便可对食物进行加热,这两包物质最适合的选择是〔〕A.硝酸铵晶体与水 B. 生石灰与水C. 浓硫酸与水D. 氯化钠与水5. 生活中的洗涤问题大多与化学知识有关。
以下有关说法不正确的选项是〔〕A. 厨房中的洗涤剂可使餐具上的油污乳化B. 汽油可溶解衣服上的油渍C. 食醋可用来除去热水瓶中的水垢D. 自来水可溶解铁栅栏上的铁锈6. 向如图试管里的水中参加下述某种物质后,原来U形管内在同一水平上的红墨水,右边液面降低了些,左边液面上升了些,那么参加的物质是〔〕A. 生石灰B. 硝酸铵C. 活性炭D. 氢氧化钠固体7.以下关于溶液的说法不正确的选项是 ( )A .外界条件不变时,放置时间稍长,溶质不会别离出来B.溶液不一定是无色的C .溶液的质量等于溶质和溶剂的质量之和D.溶液内部各局部的物理性质、化学性质可能不相同8. 以下溶液中,溶质是液体的为〔〕A.医用葡萄糖溶液 B.20%的氢氧化钠溶液C.75%的消毒酒精 D.0.9%的生理盐水9.以下物质不属于溶液的是〔〕A.碘酒 B.“雪碧〞汽水 C.冰、水混合物 D.生理盐水10.洗衣机减轻了人们的劳动强度。
以下说法中正确的选项是〔〕A.溶解洗涤剂的水温越高越好B.洗涤后衣服上一定没有残留洗涤剂C.洗涤后排出的液体一定是溶液D.洗涤时适当提高水温能加快洗衣粉的溶解速率11.欲将某温度下的硝酸钾饱和溶液转化为不饱和溶液,以下方法可行的是〔〕A.参加硝酸钾晶体B.加水C.降低温度 D.恒温蒸发水分12. 日常生活中除去油污的方法很多,以下现象不属于乳化的是〔〕A. 修车工用汽油洗去手上的油污B.洗发精洗去头发上的油脂C. 洗面奶洗去皮肤上的油脂D. 洗洁精洗去餐具上的油污13.以下物质中属于乳浊液的是〔〕14.名称中有“水〞字的物质可能是溶液,以下有“水〞字的物质属于溶液的是〔〕15. 室温下,向一定量的氯化钠溶液中参加10 g氯化钠固体,充分搅拌后,尚有局部固体未溶解,参加10 g水后,固体全部溶解,以下判断正确的选项是〔〕二、填空简答题16.指出以下溶液中的溶质和溶剂。

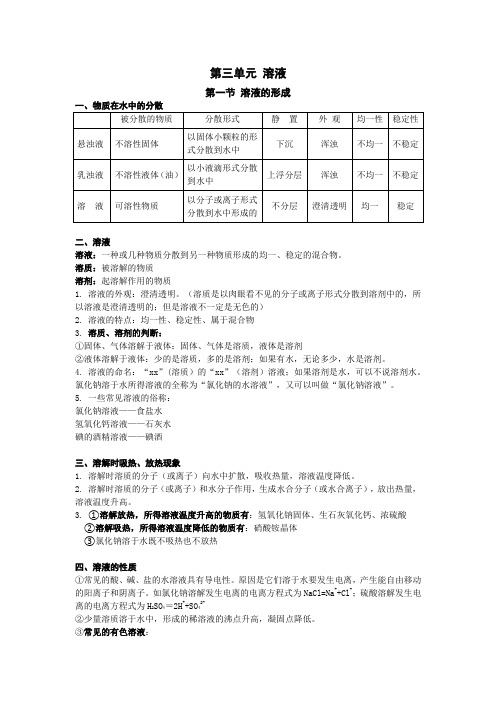
第三单元溶液第一节溶液的形成一、物质在水中的分散二、溶液溶液:一种或几种物质分散到另一种物质形成的均一、稳定的混合物。
溶质:被溶解的物质溶剂:起溶解作用的物质1.溶液的外观:澄清透明。
(溶质是以肉眼看不见的分子或离子形式分散到溶剂中的,所以溶液是澄清透明的;但是溶液不一定是无色的)2.溶液的特点:均一性、稳定性、属于混合物3.溶质、溶剂的判断:①固体、气体溶解于液体:固体、气体是溶质,液体是溶剂②液体溶解于液体:少的是溶质,多的是溶剂;如果有水,无论多少,水是溶剂。
4.溶液的命名:“xx”(溶质)的“xx”(溶剂)溶液;如果溶剂是水,可以不说溶剂水。
氯化钠溶于水所得溶液的全称为“氯化钠的水溶液”,又可以叫做“氯化钠溶液”。
5.一些常见溶液的俗称:氯化钠溶液——食盐水氢氧化钙溶液——石灰水碘的酒精溶液——碘酒三、溶解时吸热、放热现象1.溶解时溶质的分子(或离子)向水中扩散,吸收热量,溶液温度降低。
2.溶解时溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量,溶液温度升高。
3.①溶解放热,所得溶液温度升高的物质有:氢氧化钠固体、生石灰氧化钙、浓硫酸②溶解吸热,所得溶液温度降低的物质有:硝酸铵晶体③氯化钠溶于水既不吸热也不放热四、溶液的性质①常见的酸、碱、盐的水溶液具有导电性。
原因是它们溶于水要发生电离,产生能自由移动的阳离子和阴离子。
如氯化钠溶解发生电离的电离方程式为NaCl=Na++Cl-;硫酸溶解发生电离的电离方程式为H2SO4=2H++SO42-②少量溶质溶于水中,形成的稀溶液的沸点升高,凝固点降低。
③常见的有色溶液:蓝色溶液(含Cu 2+):硫酸铜溶液,氯化铜溶液,硝酸铜溶液浅绿色溶液(含Fe 2+):硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液黄色溶液(含Fe 3+):硫酸铁溶液,氯化铁溶液,硝酸铁溶液 紫红色溶液:高锰酸钾溶液 紫色溶液:石蕊溶液五、饱和溶液与不饱和溶液1. 定义:在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。



第三单元溶液第一节溶液的形成第1课时三维目标:1、知识与技能:(1)认识溶解现象,知道溶液、溶质、溶剂的概念。
(2)知道一些常见的乳化现象。
2、过程与方法:(1)学习科学研究和科学实验的方法,观察、记录、分析实验现象。
(2)采取对比的方法认识对相同问题不同的解决方法。
3、情感态度价值观:(1)增强学习化学的兴趣。
(2)树立勇于创新的精神。
重点:1、建立溶液的概念。
2、认识溶液、溶质、溶剂三者的关系。
难点:1、从微观上认识溶液。
2、理解溶质、溶剂的辨证关系。
导入新课:提问:生活中的纯净水是属于纯净物还是混合物?海水、河水、湖水以及矿泉水呢?新课:一、溶液探究思考:蔗糖与氯化钠两种物质形成溶液后有什么区别与联系?区别:蔗糖在水中是以分子形式存在(C11H22O11),而氯化钠则是以离子形式存在(Na+、Cl-)。
联系:两种溶液只要水分不被蒸发,温度不发生变化,蔗糖或氯化钠与水不会分离,取出其中任意一部分进行比较,它们的组成完全相同。
1、定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。
讨论:纯净水是否是溶液?早上清新的空气是否是溶液?合金是不是溶液?溶液都是无色的吗?练习:1、把少量下列物质分别放到水中,充分搅拌,可以得到溶液是的()A、食盐B、面粉C、植物油D、石灰石2、以下饮料和食品中,属于溶液的是()A、豆浆B、果酱C、矿泉水D、蔗糖水2、溶液的宏观特征:(1)均一性(2)稳定性练习1:烧杯中有100毫升NaCl溶液,请比较A处和B处密度的大小( )(图见大屏幕)A:ρA > ρB B:ρA < ρB C:ρA= ρB D:不能确定3、溶液的组成:溶剂与溶质能溶解其它物质的物质叫溶剂,被溶解的物质叫溶质。
m(液)= m(溶剂)+m(溶质)练习:1、将10g蔗糖溶于100g水中,完全溶解后形成溶液的质量是。
2、将50g食盐溶于100g水中,经过搅拌、静止、过滤,称量出滤渣的质量为30g,那么形成的溶液的质量是。
第三单元 溶液第一节 溶液的形成一、溶解的过程溶液(1)定义:一种或几种物质分散到另一种物质中形成的均一、稳定的混合物。
举例:氯化钠溶液、硫酸铜溶液、蔗糖溶液、氯化铁溶液等。
(2)特征:均一、稳定的混合物(3)组成:(1)溶质:被溶解的物质叫溶质。
固、液、气(2)溶剂:能溶解其它物质的物质。
通常为水(4)注意:a 、溶液不一定无色,如CuSO 4为蓝色 FeSO 4为浅绿色 Fe 2(SO 4)3为黄色b 、溶液的质量 = 溶质的质量 + 溶剂的质量溶液的体积 ≠ 溶质的体积 + 溶剂的体积c 、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)d 、固体、气体溶于液体:液体为溶剂,固体、气体是溶质。
液体溶于液体:有水,水为溶剂,其他为溶质;无水,量多的为溶剂,量少的为溶质。
(5)性质:(1)导电性:有些溶液能导电 如:酸、碱、盐溶液(2)混合物凝固点降低、沸点升高(3)溶液的温度升高或降低如:氢氧化钠溶于水后溶液温度升高,硝酸铵溶于水后溶液温度降低,氯化钠溶于水温度不变二、乳化现象:将难溶性的液体分散成细小的液滴,不能再聚集成大的液滴的现象。
乳化:举例:洗涤剂洗油污等三、饱和溶液与不饱和溶液1.定义---饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液。
2.转化:不饱和溶液−−−−−−−−→−变温度加溶质、蒸发溶剂,改饱和溶液−−−−−→−加溶剂、改变温度不饱和溶液3.浓、稀溶液与饱和、不饱和溶液之间的关系饱和溶液不一定是浓溶液;不饱和溶液不一定是稀溶液;在一定温度时,同一溶质的饱和溶液一定比它的不饱和溶液浓。
典型例题1.下列叙述中,正确的是( )A .悬浊液、乳浊液、溶液都是混合物B .溶液里溶质只能有一种C .溶质可以是固体、液体、气体,但溶剂只能是液体D .透明、澄清的液体都是溶液2.下列溶液中的溶剂不是水的是( )A..碘酒 B .医用酒精 C .生理盐水 D .葡萄糖溶液3.溶液是自然界中常见的物质.下列有关溶液的说法正确的是( )A.溶液的上层浓度小,下层浓度大B.溶液蒸干后,均能得到固体溶质C.溶液中只有一种溶质时,溶液为纯净物D.溶解得到溶液的过程中,通常有放热或吸热的现象4.当两种液体互相混合形成溶液时()A.无所谓哪一个是溶质B.只能将量多的一种叫溶剂,量少的一种叫溶质C.只能将量少的一种叫溶剂,量多的一种叫溶质D.通常将量多的一种叫溶剂,量少的一种叫溶质5.如下图所示,向小试管中分别加入下列一定量的物质,右侧U型管中的液面未发生明显变化,该物质是()A.浓硫酸B.氢氧化钠固体C.蔗糖固体D.氧化钙固体6.下列关于溶液的说法中,正确的是()A.极稀的溶液可能是饱和溶液B.饱和溶液是不能再溶解溶质的溶液C.不饱和溶液降温后可能变成饱和溶液D.饱和溶液升高温度后一定变成不饱和溶液7.在相同条件下,不同质量的同种物质的饱和溶液中,所含溶质的质量是()A.一定相同B.一定不同C.可能相同D.无法判断8.在20℃时,要使接近饱和的石灰水变为饱和的石灰水,应采取的措施为()A.升温至刚有Ca(OH)2析出B.降温至刚有Ca(OH)2析出C.加水D.加水9.饱和溶液用水稀释变成不饱和溶液的过程中,保持不变的是()A.溶质的质量B.溶剂的质量C.溶液的质量D.溶质与溶剂的质量比10.在一定温度下,使固体物质的饱和溶液变为不饱和溶液最可靠的方法是()A.加入溶质或蒸发溶剂B.加入溶剂C.都采用升高温度的方法D.都采用降低温度的方法中考链接第二节溶液组成的定量表示溶质的质量分数1、公式:溶质质量溶质质量溶质的质量分数= ×100% = ×100%溶液质量(溶质质量+溶剂质量)2、配制一定溶质质量分数的溶液(1)用固体配制:①步骤:计算、称量、溶解、装瓶存放②仪器:天平、药匙、量筒、滴管、烧杯、玻璃棒(2)用浓溶液稀释(稀释前后,溶质的质量不变)①步骤:计算、量取、稀释、装瓶存放②仪器:量筒、滴管、烧杯、玻璃棒典型例题1.配制90g10%的NaNO3溶液后,向其中加入10gNaNO3搅拌至完全溶解,所得溶液中NaNO3质量分数是()A.19%B.10%C.9%D.无法计算2.把40g5%的CaCl2溶液溶质质量分数增大到10%,应采用的方法是()A.把溶剂蒸发掉一半B.加入2gCaCl2固体C.加入40g15%的CaCl2溶液D.把溶剂蒸发掉20g3.配制5000g20%的盐酸,需要38%的盐酸(密度为1.19g/cm3)的体积为()A.2211mLB.1000mLC.2200mLD.2632mL4.一份2%的NaCl溶液蒸发掉40g水后,溶质质量分数变为10%,则原溶液中溶质质量为()A.1gB.2gC.5gD.8g5. 某同学配制60g溶质质量分数为5%的NaCl溶液,准备了下列实验用品.回答下列问题:(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④______(填步骤名称).(2)配制过程还缺少的一种玻璃仪器是__________(填名称).(3)计算所需NaCl的质量为________g,称量时,NaCl应放在托盘天平的________(填“左盘”、“右盘”)上.(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用________(填仪器名称)滴加蒸馏水至刻度线.如图该同学观察方式正确的是__________(填序号).若用C观察方式量取水的体积,所配制溶液的溶质质量分数会______(填“偏大”、“偏小”或“无影响”).8. 将20克NaOH固体完全溶解在80毫升水中(水的密度为1g/cm3),所配溶液中溶质的质量分数为_____________.某同学在配制过程中,量取水时仰视读数,其所配氢氧化钠溶液中溶质的质量分数将_________________ .(填“偏大”或“偏小”),另一位同学称取NaOH时,由于操作不熟练,花了较长时间,那么,他所配氢氧化钠溶液中溶质的质量分数将__________________.(填“偏大”或“偏小”).中考链接。