电解质溶液和离子平衡东华大学共91页文档
- 格式:ppt
- 大小:1.81 MB
- 文档页数:77




第三章电解质溶液和离子平衡第一节强电解质在溶液中的状况一、离子氛的概念1923年,德拜(P. J. W.Debye)和休格尔(E. Hückel)提出强电解质理论。
其要点:①强电解质在水中是完全电离的如离子型化合物:NaCl、KCl、NaOH、KOH等强极性键化合物:HCl,H2SO4(H+ + HSO4-)等②离子之间相互作用,使离子的行动并不自由。
离子在溶液中的运动受离子氛的牵制。
离子氛示意图在导电性实验中,决定导电性强弱有两个因素:①溶液中离子的多少②离子的迁移速度。
离子迁移速度的变慢,因此,根据溶液的导电度测得的电离度就降低了,这时测得的电离度称为表观电离度。
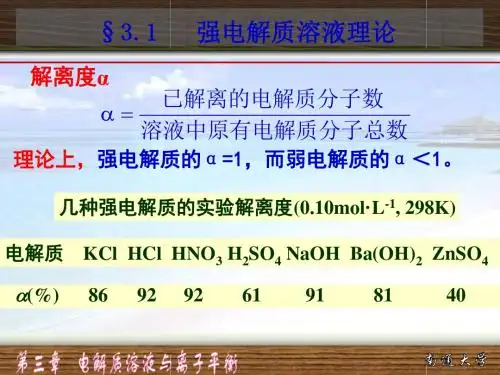
电解质电离式表观电离度/%氯化钾KCl→K++Cl-86硫酸锌ZnSO→Zn2++SO42-40盐酸HCl→H++Cl-92硝酸HNO→H++NO-92硫酸H2SO4→H++HSO4- 61氢氧化钠NaOH→Na++OH- 91氢氧化钡Ba(OH)2→Ba2++2OH- 81二、活度和活度系数由于离子间的相互牵制,离子的行动并不完全自由,使离子的有效浓度比实际的计算浓度要低。
1907年,Lewis(路易斯)提出了离子活度的概念a = f × C (f < 1)有效浓度“折扣”计算浓度活度活度系数对强电解质来讲,而弱电解质或难溶电解质,离子浓度小,离子间的影响也小,f →1第二节水的电离和溶液的PH值本节以平衡原理为依据,讨论弱电解质中的电离平衡。
一、水的离子积实验表明,纯水也有微弱的导电性K = [H+][OH-]/[H2O]∵H2O的电离极弱,电离掉的水分子数与总的水分子数相比微不足道,故水的浓度可视为常数,合并入平衡常数。
∴[H+][OH-] = K[H2O] = Kw Kw:常数∴在一定温度下,[H+][OH-]为一常数,25℃纯水中,[H+] = 10-7mol/L = [OH-]∴ Kw = [H+][OH-] = 10-14对纯水或在纯水中加入酸、碱或其它物质(浓度较稀)都适用。






3 电解质溶液和离子平衡【本章学习要求】(1)熟悉弱电解质、强电解质以及难溶电解质的特点;(2)熟练掌握一元弱酸和一元弱碱的电离平衡及有关计算,了解多元弱酸的电离平衡;(3)初步掌握酸碱质子理论;(4)掌握同离子效应的概念及缓冲溶液的组成和作用原理;(5)掌握盐类的水解及其有关计算;(6)理解沉淀溶解平衡的特点,熟练掌握溶度积规则及有关计算。
许多化学反应是在水溶液中进行的,尤其是酸、碱、盐的相关反应。
本章以化学平衡及其移动原理为基础,着重讨论溶液中的离子平衡。
包括:弱电解质的离解平衡,水的离解平衡,盐类的水解平衡以及难溶电解质的沉淀-溶解平衡。
对强电解质溶液及质子理论仅作简单介绍。
3.1 强电解质溶液电解质是在水溶液中或在熔融状态下能够导电的化合物。
其导电原因是在水溶液中或在熔融状态下解离成自由移动的离子。
强电解质:⑴定义:在水溶液中能够全部离解成离子,导电能力强的物质叫做强电解质。
⑵包括:具有强极性键或典型离子键的化合物,例如强酸(HCl、HNO3等)、强碱(NaOH、KOH等)和大多数的盐类(KCl、Na2SO4等)。
BaSO4等难溶盐,但溶于水的那部分能完全离解,也是强电解质。
⑶离解方程式:用“=”或“→”弱电解质:⑴定义:在水溶液中只一部分离解,导电能力弱的物质叫做弱电解质。
⑵包括:一些弱极性键化合物,例如弱酸(HAc、HCN)、弱碱(NH3·H2O)、水等。
⑶离解方程式:用“≒”电解质在水溶液中都是以水合离子(或分子)形式存在,如水合离子H3O+,有时用H+来表示水合了的氢离子,为简便起见,本书仍用简单离子书写,如H+、OH-、Na+等。
强电解质在水溶液中理论上应是100%离解成离子。
但是根据溶液导电性的实验所测得的强电解质的离解度都小于100%。
这种由实验测得的离解度称为表观离解度。
如表3-1中列出了几种强电解质的表观离解度。
表3-1 强电解质溶液的表观理解度(25℃,0.1mol/L)1923年,德拜(Debye ,1884~1966)和休格尔(Hucke ,1896~ )提出强电解质溶液离子互吸理论,强电解质在水溶液中是完全离解的,但不完全“自由”,在溶液中存在着暂时的组合“离子氛”(见图3-1)。