01 溶液和胶体
- 格式:ppt
- 大小:644.00 KB
- 文档页数:47

第二章溶液和胶体溶液和胶体是物质的不同存在形式,在自然界中普遍存在,与工农业生产以及人类生命活动过程有着密切的联系。
广大的江河湖海就是最大的水溶液,生物体和土壤中的液态部分大都为溶液或胶体。
溶液和胶体是物质在不同条件下所形成的两种不同状态。
例如NaCl溶于水就成为溶液,把它溶于酒精则成为胶体。
那么,溶液和胶体有什么不同呢?它们各自又有什么样的特点呢?要了解上述问题,需要了解有关分散系的概念。
2.1分散系及其分类2.1.1 分散系的概念一种或几种物质分散在另一种物质里所形成的系统称为分散系统,简称分散系。
例如粘土分散在水中成为泥浆,水滴分散在空气中成为云雾,奶油、蛋白质和乳糖分散在水中成为牛奶等都是分散系。
在分散系中,被分散的物质叫做分散质(或分散相),而容纳分散质的物质称为分散剂(或分散介质)。
在上述例子中,粘土、水滴、奶油、蛋白质、乳糖等是分散质,水、空气就是分散剂。
分散质和分散剂的聚集状态不同,分散质粒子大小不同,分散系的性质也不同。
我们可以按照物质的聚集状态或分散质颗粒的大小将分散系进行分类。
2.1.2分散系的分类物质一般有气态、液态、固态三种聚集状态,若按分散质和分散剂的聚集状态进行分类,可以把分散系分为九类,见表2-1。
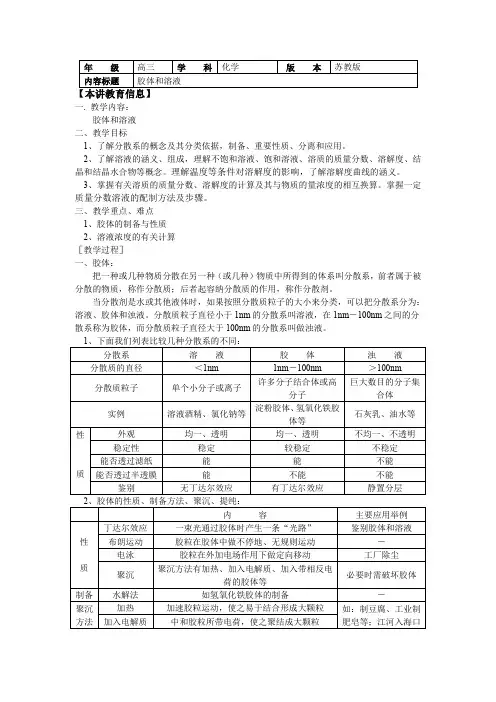
表2-1 分散系分类(一)若按分散质粒子直径大小进行分类,则可以将分散系分为三类,见表2-2。
表2-2 分散系分类(二)分子与离子分散系统中,分散质粒子直径<1nm,它们是一般的分子或离子,与分散剂的亲和力极强,均匀、无界面,是高度分散、高度稳定的单相系统。
这种分散系统即通常所说的溶液,如蔗糖溶液、食盐溶液。
胶体分散系中,分散质粒子直径为1~100nm,它包括溶胶和高分子化合物溶液两种类型。
一类是溶胶,其分散质粒子是由许多一般的分子组成的聚集体,这类难溶于分散剂的固体分散质高度分散在液体分散剂中,所形成的胶体分散系称为溶胶。
例如氢氧化铁溶胶、硫化砷溶胶、碘化银溶胶、金溶胶等。







一. 教学内容:胶体和溶液二、教学目标1、了解分散系的概念及其分类依据,制备、重要性质、分离和应用。
2、了解溶液的涵义、组成,理解不饱和溶液、饱和溶液、溶质的质量分数、溶解度、结晶和结晶水合物等概念。
理解温度等条件对溶解度的影响,了解溶解度曲线的涵义。
3、掌握有关溶质的质量分数、溶解度的计算及其与物质的量浓度的相互换算。
掌握一定质量分数溶液的配制方法及步骤。
三、教学重点、难点1、胶体的制备与性质2、溶液浓度的有关计算[教学过程]一、胶体:把一种或几种物质分散在另一种(或几种)物质中所得到的体系叫分散系,前者属于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。
当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。
分散质粒子直径小于1nm的分散系叫溶液,在1nm-100nm之间的分散系称为胶体,而分散质粒子直径大于100nm的分散系叫做浊液。
说明:(1)胶体区别于其他分散系的本质特征是:分散质粒子直径在1nm-100nm之间;(2)胶体可通过滤纸而不能透过半透膜,证明滤纸上的小孔大于半透膜上的小孔,因此,可用过滤法分离胶体和浊液,用渗析法分离胶体和溶液。
(3)丁达尔效应是用来鉴别胶体和溶液的最有效、最简单的方法。
(4)胶体具有介稳性的原因是由于同种胶粒吸附相同的离子,带有同种电荷,同种电荷相互排斥,因此胶粒之间不能相互聚集在一起形成颗粒较大的粒子沉降下来。
但整个胶体是呈电中性的,不显电性。
(5)一般说来,金属氢氧化物、金属氧化物的胶粒吸附阳离子带部分正电荷,非金属氧化物、金属硫化物等胶粒吸附阴离子带部分负电荷,同种胶粒吸附相同的离子带同种电荷。
(6)胶体聚沉的原因是由于破坏了胶粒所带电荷之间的相互排斥,从而使胶粒之间可以相互聚集在一起形成颗粒较大的粒子沉降,加入电解质和带相反电荷的胶体,都可以破坏胶体内部的电荷平衡,使胶体聚沉,同时加热、加入酸碱等也可以使胶体聚沉。

第一章溶液与胶体习题1.是非判断题1-1状态相同的体系不一定是单相体系。
1-2根据相的概念可知,由液态物质组成的系统中仅存在一个相。
1-3所有非电解质的稀溶液,均具有稀溶液的依数性。
1-4难挥发非电解质稀溶液的依数性不仅与溶质种类有关,而且与溶液的浓度成正比。
1-5难挥发非电解质溶液的蒸汽压实际上是溶液中溶剂的蒸汽压。
1-6有一稀溶液浓度为C,沸点升高值为ΔT b,凝固点下降值为ΔT f,则ΔT f必大于ΔT b 。
1-7溶液在达到凝固点时,溶液中的溶质和溶剂均以固态析出,形成冰。
1-8纯净的晶体化合物都有一定的熔点,而含杂质物质的熔点一定比纯化合物的熔点低,且杂质越多,熔点越低。
1-9体系的水溶液随着温度不断降低,冰不断析出,因此溶液的浓度会不断上升。
1-10纯溶剂通过半透膜向溶液渗透的压力叫渗透压。
1-11溶剂通过半透膜进入溶液的单方向扩散的现象称作渗透现象。
1-12 将10% 葡萄糖溶液用半透膜隔开,为使渗透压达到平衡,必须在某侧溶液液面上加一压强,此压强就是该葡萄糖溶液的渗透压。
1-13将浓溶液和稀溶液用半透膜隔开,欲阻止稀溶液的溶剂分子进入浓溶液,需要加到浓溶液液面上的压力,称为浓溶液的渗透压。
1-14 0.3mol·kg-1的蔗糖溶液和0.3mol·kg-1的甘油溶液的渗透压相等。
1-15 在相同温度时,凝固点为-0.52℃的泪水与0.81% NaCl水溶液具有相同的渗透压,互为等渗溶液。
1-16人血浆在37℃的渗透压为780Kpa,因此血红细胞在1.2% NaCl溶液中皱缩而沉降。
1-17用渗透压法测定胰岛素的摩尔质量,将101mg胰岛素溶于10.0mL水中,测得25℃渗透压为4.34Kpa,则胰岛素的摩尔质量为5760g·mol-1。
1-18反渗透是外加在溶液上的压力超过了渗透压时,溶液中的溶剂向纯溶剂方向流动的过程。
1-19渗透压较高的溶液其物质的量浓度一定较大。
溶液和胶体的直径一、引言溶液和胶体是化学中两个非常重要的概念,它们在我们的日常生活中也有着广泛的应用。
其中一个关键的参数就是它们的直径。
本文将围绕这一主题展开深入探讨。
二、溶液的直径1. 溶液的定义溶液是由两种或更多种物质混合而成的均匀透明液体,其中溶解物称为溶质,溶剂则是将其溶解的物质。
2. 溶液中分子间距离和直径在理想情况下,溶液中分子间距离可以用下式计算:d = (V/n)^(1/3)其中d表示分子间距离,V表示体积,n表示分子数。
如果知道了体积和分子数,就可以计算出分子间距离。
然而,在实际情况下,这个计算公式并不适用于所有情况。
在高浓度下,分子之间会发生相互作用,从而导致实际上它们之间并没有那么远。
3. 溶液中颗粒直径的测量方法目前常用来测量颗粒直径的方法有以下几种:(1) 光散射法:利用光的散射来测量颗粒的直径。
(2) 动态光散射法:在样品中加入溶剂,使颗粒悬浮在其中,然后利用光的散射来测量颗粒的直径。
(3) 静态光散射法:将样品放置在一个固定位置,然后利用光的散射来测量颗粒的直径。
三、胶体的直径1. 胶体的定义胶体是一种介于分子和宏观物质之间的物质,具有均匀分布、互不溶解和稳定性等特点。
2. 胶体中颗粒直径的测量方法与溶液不同,胶体中存在着大量微小颗粒。
测量胶体中颗粒直径需要采用不同于溶液的方法。
目前常用来测量胶体中颗粒直径的方法有以下几种:(1) 透射电子显微镜法:通过电子束穿过样品来观察胶体中微小颗粒。
(2) 激光多角度动态光散射法:利用激光束照射样品,然后测量光的散射来确定颗粒的直径。
(3) 原子力显微镜法:通过扫描样品表面来观察胶体中微小颗粒。
3. 胶体中颗粒直径的影响因素胶体中颗粒直径的大小对其性质有着重要的影响。
一般来说,随着颗粒直径的增大,胶体的稳定性会降低,而沉淀和凝聚的可能性会增加。
颗粒直径还会影响胶体中物质的扩散速率和表面活性等特性。
四、结论溶液和胶体是化学中非常重要的概念,在我们的日常生活中也有着广泛应用。
分离胶体和溶液的方法
,
通过分离胶体和溶液可以将胶体和溶液之间的有机物或无机物分离开来,胶体
具有若干特性,它们被称为胶体的物理性质。
分离技术是利用这些特性将溶液中的物质或物质分离出来。
为了能有效地分离离子和微粒,可以使用沉淀、沉淀型过滤、或沉淀的方法;沉降法利用沉淀剂的重力将离子从溶质中分离出来。
像水银离子这样的常见沉淀剂是有效的,尤其是在低温或增加滤液质量时。
沉淀型过滤是利用沉淀物在滤纸上加载来将离子从溶质中分离出来,这是一种有效的分离胶体和溶液的方法。
另一方面是沉降,它可以利用沉淀物的重力将离子从溶质中分离出来。
沉淀电泳和电极净化也是有效的分离胶体和溶液方法。
沉淀电泳是一种电化学
的分离方法,利用溶液中的电荷质子来将这些离子质子斥开,让它们沉积到电极上。
电极净化是一种利用电荷转化分子的方法,该方法可将分子的离子质子结合起来,使其转化为含有其他电荷的分子,从而将溶液中的某些物质进行净化。
通过使用以上分离技术,可以安全、有效地将胶体和溶液中的有机物或无机物
分离开来,从而为实验室提供有价值的数据和信息。
实验室总是需要对这些物质进行分类和分析,以便对对应的物质进行检测和研究,以期达到有效研究和生产的目的。