URS模板
- 格式:docx
- 大小:43.21 KB
- 文档页数:8

制药行业计算机化系统的URS模板
引言
1.1 目的
1.2 背景
1.3 范围
2. 总体概述
2.1 系统概述
2.2 目标和目标用户
2.3 主要功能和特性
2.4 非功能需求
2.5 系统接口
2.6 性能要求
2.7 安全性和合规性需求
3. 功能需求
3.1 功能说明
3.2 功能优先级
3.3 功能限制和约束
4. 数据需求
4.1 数据存储要求
4.2 数据处理要求
4.3 数据安全要求
5. 用户界面需求
5.1 用户界面设计
5.2 用户交互要求
6. 安全性需求
6.1 访问控制和权限管理6.2 数据保护和备份
6.3 安全审计跟踪
7. 可靠性和可用性需求7.1 故障恢复和备份要求7.2 可用性和可靠性要求
8. 性能需求
8.1 响应时间要求
8.2 吞吐量要求
8.3 扩展性和可配置性要求
9. 维护和支持需求
9.1 系统维护要求
9.2 技术支持要求
10. 验收标准和测试要求
10.1 功能验收标准
10.2 性能验收标准
10.3 数据完整性和安全性测试要求
11. 附录
11.1 术语表
11.2 参考文献
可以根据具体的需求和项目进行调整和修改,在编写URS时,确保详细描述系统功能、数据、用户界面、安全性、可靠性和性能的具体要求。
用户需求书起草审核批准修订历史纪录目录1. 概述 (5)2. 参考法规和指南 (5)3. 缩写和定义 (5)4. 设备系统描述 (6)4.1 基本描述 (6)4.2 工艺描述 (6)5. 技术要求 (7)5.1 总体要求 (7)5.2生产和控制要求 (8)5.3 环境、健康和安全要求 (8)6. 文件和培训 (9)6.1 文件要求 (9)6.2 培训要求 (9)7. 参考条件 (9)8. 相关系统 (9)1. 概述1.1本用户需求书所列技术要求适用于**********车间HVAC系统。
该车间主要生产:**********产品。
主要的生产操作房间有:**********。
1.2本URS描述了该生产线HVAC系统的基本需求,包括:工作性能需求、关键技术参数要求、安全要求、符合中国及FDA、欧盟GMP法规要求及其他要求。
同时,这份用户要求文件也是开展后续相关验证工作的基础。
1.3在本URS中用户仅提出基本的技术要求,并未涵盖和限制有更高的设计与制造标准1.4 HVAC系统工程包括如下主要工程内容;1.4.1 生产线送风、回风、排风风管制作安装施工;1.4.2 生产线风管阀门安装工程;1.4.3生产线单向层流系统的安装;1.4.4生产线的高效过滤器安装;1.4.5生产线风管保温材料施工;2. 参考法规和指南以下为在本用户需求书中涉及的参考规范、标准:1. GB50300《建筑工程施工质量验收统一标准》2. GB50591-2010《洁净室施工及验收规范》3. GB50243《通风与空调工程施工质量验收规范》4. GB50457-2008《医药工业洁净厂房设计规范》5.GEP《良好工程管理规范》6. ISO-14644 《洁净室标准》;7. ISO-14698《生物污染控制》;8. GB/T16292-2010《医药工业洁净室(区)悬浮粒子的测试方法》;9.GBT16293-2010《医药工业洁净室(区)浮游菌的测试方法》;10.GBT16293-2010《医药工业洁净室(区)沉降菌的测试方法》;11. GB50231-2009《机械设备安装工程施工及验收通用规范》;12. 中国GMP:《药品生产质量管理规范及指南》;13. US GMP:美国《药品生产质量管理规范及指南》。
深圳市海滨制药有限公司Shenzhen Haibin Pharmaceutical Co., Ltd编码/Code:11-WS-CVP/R-004-01文件名称/Document Name:五车间无菌分装生产线培养基清洗验证方案Cleaning Validation Protocol of Sterile Filling Line For Media(workshop 5)文件类别/ Document Category:其它文件/Other Document:生效日期/Effective Date:页码/ Page No.:1/11机用户需求标准你的签名表明你已清楚了解本文件及附件内容,充分理解并认可本文件的所有条款。
Prepared by / 编制者部门:签名/日期:Reviewed by / 审核者部门:签名/日期:部门:签名/日期:部门:签名/日期:部门:签名/日期:Authorized by / 批准者部门:签名/日期:本文件根据需要应分发于以下部门:01质量部、02 生产技术部、03设备计量室质量部颁发任何对本文件及其附件的目的、内容或标准进行的改变或修正都必须起到改善的作用,并详细记录本文件的修订及变更历史,并且在执行以前必须取得批准。
版本号修订日期修订原因文件变更控制号1.0 新订N/A目录1.目的 (4)2.范围 (4)3.术语及定义 (4)3.1GMP:药品生产质量管理规范 (4)3.2URS:用户需求说明 (4)3.3FAT:工厂验收测试 (4)3.4SAT:现场验收测试 (4)3.5DQ:设计确认 (4)3.6IQ:安装确认 (4)3.7OQ:运行确认 (4)3.8PQ:性能确认 (4)3.9GAMP:良好自动化生产规范 (4)3.10PLC:程序控制器 (4)4.职责 (4)4.1需求方职责 (4)4.2供应商职责 (4)5.项目概述 (4)5.1项目简介及背景 (5)5.2主要用途 (5)5.3工艺流程 (5)5.4主要生产产品 (5)6.供货范围(主要设备及数量) (5)7.法规与标准 (5)7.1药品法规要求 (5)7.2国家标准要求 (5)7.3行业标准要求 (6)7.4公司管理制度要求 (6)8.用户需求标准 (6)8.1生产/运行能力 (6)8.2性能/系统要求 (6)8.3GMP要求 (7)8.4EHS要求 (7)8.5控制系统要求 (8)8.6安全/断电及恢复 (8)8.7清洁要求 (9)8.8所需文件 (9)8.9转运要求 (10)8.10安装/验收要求 (10)8.11培训要求 (11)8.12售后服务 (11)8.13对供应商要求 (11)8.14其它 (12)9.附件 (12)时间控制表 (12)10.客户反馈表 (12)1. 目的该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
目的:建立XX模具用户需求标准。
适用范围:适用于XX模具的用户要求。
责任者:使用部门、生产部门负责人、设备维修部门负责人、质量管理部门负责人、质量管理负责人。
内容:1 文件说明1.1 起草人由实际使用部门人员担任。
1.2 审核人1.2.1 审核人A:生产部门负责人;1.2.2 审核人B:质量管理部门负责人;1.2.3 审核人C:设备维修部门负责人。
1.3 批准人:质量管理负责人。
2 背景介绍为了满足病人新的需求,公司计划紧急采购一批XXX片剂产品的高速压片冲模。
这批冲模预计于2010年3月以前完成设备安装及相关验证并投入试用。
3 目的本文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
4 范围本文件为×××公司的 XXX 片剂冲模用户要求文件。
5 法规和国家标准5.1 cGMP 法规该冲模用于药品的制造,因此必须符合cGMP的要求,主要包括:5.1.1 《药品生产质量管理规范(2010年修订)》5.1.2 欧洲GMP,EU Pharmaceutical legislation, Directive 75/319/EEC. GMP Regulation, Directive 91/356/EEC Volume 4 and applicable annexes: GMP Guideline.5.1.3 FDA - 21 CFR Part 210, 211 Good Manufacturing Practice for Finished Pharmaceuticals.5.2 法规和行业标准5.2.1 JB/T 20080.2-2007 中华人民共和国制药机械行业标准《高速压片冲模尺寸与片形标准》5.2.2 ISO 18084 International Standard 《Press tools for tablets—punches and dies》5.2.3 Tableting Specification Manual (Previously refered to as the IPT standard specification for Tableting tools)5.3 ×××公司政策5.3.1 ××××URS管理规程5.3.2 设备管理规程5.3.3 质量方针6 项目介绍6.1 项目描述 XX固体制造车间计划购置一批XXX片剂冲模(欧标浅凹),以满足病人及市场新的要求。

药厂实验室URS(用户需求书)模板起草、审核与批准姓名部门职务签名日期起草人质量部经理审核人GMP办公室经理审核人生产部经理审核人公用工程部经理审核人总经理办副总经理净化施工单位确认签收公司名称职务签名日期确认人版本历史版本. 日期编写人变更描述00 起草01 修订目录1. 目的2.范围3.适用的法规和指南4. 定义和缩写5. 化验室改造工程描述6. 相关时间规定7. 化验室改造工程内容8. 系统URS描述9. 验证要求10. 文件方面的要求11. 质保期和售后服务12. 附件附件1各供应商按照我公司提供的平面图,自行设计并提供上述1-35项文件附件2品牌一经确认,施工时不可要求更换品牌,前期亦可提供更优质的材质,需提供样品。
1. 目的本用户需求说明(URS)的目的是为了规定######有限公司质量部化验室微生物实验区、理化实验区和辅助区等功能区的净化工程、围护结构(隔板和吊顶)、水电系统、地面、实验台柜、通风系统、排水等技术要求,为该系统的招标提供技术依据,并作为后续验证工作的基础。
在本URS中用户仅提出基本的技术要求和系统的基本要求,并未涵盖和限制供应方更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。
投标方应在满足本URS的前提下提供供应方能够达到的更高标准和功能的高质量设备及其相关服务。
供应方的设备应满足中国有关设计、制造、安全、环保等规程、规范和强制性标准要求。
如遇与供应方所执行的标准发生矛盾时,应按较高标准执行(强制性标准除外)。
该URS在移交给服务商之后,将意味着所有指定的要求被涵盖在服务商的供应范围之内。
本文件的解释权由海南利能康泰制药有限公司GMP小组负责。
2. 范围本文件的范围涉及到#########化验室项目的最低要求,服务商应以URS作为详细设计以及报价的基础。
服务商在设计、施工、调试、验证时必须要按照URS来执行。
本项目初步设计由########有限公司完成。
机用户需求标准你的签名表明你已清楚了解本文件及附件内容,充分理解并认可本文件的所有条款。
Prepared by / 编制者部门:签名/日期:Reviewed by / 审核者部门:签名/日期:部门:签名/日期:部门:签名/日期:部门:签名/日期:Authorized by / 批准者部门:签名/日期:本文件根据需要应分发于以下部门:质量部01质量部、02 生产技术部、03设备计量室颁发任何对本文件及其附件的目的、内容或标准进行的改变或修正都必须起到改善的作用,并详细记录本文件的修订及变更历史,并且在执行以前必须取得批准。
版本号修订日期修订原因文件变更控制号1.0 新订N/A目录1.目的 (4)2.范围 (4)3.术语及定义 (4)3.1GMP:药品生产质量管理规范 (4)3.2URS:用户需求说明 (4)3.3FAT:工厂验收测试 (4)3.4SAT:现场验收测试 (4)3.5DQ:设计确认 (4)3.6IQ:安装确认 (4)3.7OQ:运行确认 (4)3.8PQ:性能确认 (4)3.9GAMP:良好自动化生产规范 (4)3.10PLC:程序控制器 (4)4.职责 (4)4.1需求方职责 (4)4.2供应商职责 (4)5.项目概述 (4)5.1项目简介及背景 (5)5.2主要用途 (5)5.3工艺流程 (5)5.4主要生产产品 (5)6.供货范围(主要设备及数量) (5)7.法规与标准 (5)7.1药品法规要求 (5)7.2国家标准要求 (5)7.3行业标准要求 (6)7.4公司管理制度要求 (6)8.用户需求标准 (6)。
目录一、简介 (3)二、工程符合的标准及规范 (5)三、工程内容及范围 (5)四、工程技术要求 (10)4.1 总体要求 (10)4.2 堆垛机技术要求 (10)4.3 码垛机器人技术要求 (11)4.4 货架技术要求 (11)4.5 穿梭车技术要求 (12)4.6 出入库输送、分拣系统技术要求 (13)4.7 控制系统软硬件技术要求 (13)4.8 设备维护要求 (14)4.9 设备表面处理及色彩要求 (15)4.10 电气技术要求 (15)4.11 EHS、安全要求 (16)4.12 文件要求 (16)五、服务要求 (17)5.1 测试服务 (17)5.2 备品备件要求 (17)5.3 包装运输要求 (17)5.4 培训及服务 (17)六、改版信息 (18)一、简介:1.本用户需求标准(URS)是为了规定XXXXXX有限公司自动化仓库系统的技术要求,为该系统的招标提供技术依据,并作为后续验证工作的基础。
2.使用功能:成品的储存和供货。
建筑面积:主体库房的空间尺寸为120(M)长×62(M)宽×22(M)高(见CAD 图)。
各投标方可根据情况做出最佳设计3.功能分区:生产车间区、联廊输送区、机器人码垛区、自动库区、入库整理区、出库整理区、月台区4.货位要求及规划:本工程规划分两期完成,第一期先完成4条巷道,约4巷*2*79列*13层=8216 个托盘位。
每层货架高度1500MM,仓库屋顶最低处22M高。
5.货型尺寸:1200MM*1400MM*(1290)MM(长*宽*高)( 高度请根据情况设计)。
6.货物重量(含托盘):MAX1200KG/PL。
7.托盘尺寸:1200MM*1400MM*170MM(长*宽*高)。
8.环境要求:常温2-30℃,相对湿度20%-80%。
9.运作模式:所有的物料都采用WMS系统进行管理、通过堆垛机系统、输送系统共同协作完成进出库工作。
10.管理软件系统:WMS系统完成对自动库所有管理工作。

洁净室尘埃粒子在线监测系统用户需求书日期: 2010年11月1.总则1.1 本用户需求书所列技术要求适用于药品生产关键区域的尘埃粒子在线环境监测系统的采购。
新引进的设备在设计、制造技术及性能上达到国际先进水平, 符合中国、欧盟和FDA的GMP要求。
1.2 本URS描述了该粒子计数器的基本需求, 包括:工作性能需求、关键技术参数要求、安全要求、符合中国、欧盟和FDA的GMP要求和安装及其他要求。
同时, 这份用户要求文件也是开展后续相关验证工作的基础, 包括SAT草案和报告、IQ草案和报告、OQ草案和报告、PQ草案和报告。
1.3 在本URS中用户仅提出基本的技术要求和设备的基本要求, 并未涵盖和限制卖方设备具有更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。
投标方应在满足本URS的前提下提供卖方能够达到的更高标准和功能的高质量设备及其相关服务。
卖方的设备应满足中国有关设计、制造、安全、环保等规程、规范和强制性标准要求。
如遇与卖方所执行的标准发生矛盾时, 应按较高标准执行(强制性标准除外)。
1.4供货范围1.4.1一套尘埃粒子在线环境监测系统及软件(系统具有浮游菌在线采样的扩展能力);1.4.2尘埃粒子传感器;1.4.3一用一备自动切换的真空泵系统;1.4.4控制柜, 控制器及相关A/D转换模块;1.4.5声光报警系统;1.4.6符合21 CFR Part 11关于电子签名、电子记录要求的控制软件系统;1.4.7监控电脑采用知名品牌,数据采用热备份设计, 保证数据安全性;1.4.8须提供良好的服务器设计, 保证系统运行的稳定性和可靠性;1.4.9 提供能满足两年正常运作要求的备品备件。
1.5投标人资质投标人应有行业内大型制药企业粒子在线监测系统的项目经验, 以及施工经验;企业应通过ISO9001认证或相应的质量认证, 并提供证书报告。
2.适用的法规和指南(1)本URS中系统设备应符合的标准:(2)FDA cGMP,工业指导意见;(3)中国: 最新版GMP附录一无菌药品的生产等;(4)欧盟: GMP 2008 Annex1;软件系统须符合21CFR Part 11 电子记录, 电子签名;ISO14644, ISO14698。

纯化水储存分配系统用户需求User Requirement Specifications版次:A编号:URS-MF-009生效日期: 2011-05-23审核批准注:本文件共14页,所描述为原料楼纯化水储存分配系统的工艺技术要求,请文件审核和批准人员仔细阅读每一页后,将意见和建议单独附页在本文件后,在本页签名即代表已审阅并批准本文件的每一页。
目录1.简介 (2)1.1项目介绍 (2)1.2目的 (2)1.3文件概述 (2)1.4供应范围 (2)1.5项目标准 (2)1.6简写 (2)1.7参考书目 (3)2.总则 (3)2.1总体要求 (3)3.纯化水管道分配系统 (3)3.1纯化水贮罐 (4)3.2纯化水分配泵 (4)3.3 换热器 (5)3.4 循环分配管道 (5)3.5在线清洗(CIP)、在线消毒 (6)3.6 仪器、仪表 (6)4.控制系统(纯化水分配系统) (8)5.验证 (9)6.文件 (9)7.公用工程 (10)8.噪音水平 (10)9.质量控制 (10)10.维修 (11)11.售后服务及培训 (11)12.变更记录 (11)13.附录 (11)正文1.简介1.1项目介绍本项目为***********制药有限公司原料车间纯化水储存和洁净管道分配系统。
所有设备的设计、制造、材质、检查和测试、包装和交付、SAT(现场接收测试)部分将由双方人员共同实施并签署各项有关报告,以上活动必须严格按照本采购要求和相关的标准与规范来进行。
1.2目的●本文旨在描述***车间对公用工程洁净管道系统的总的要求,描述设计常规功能、外观及能力方面。
●文件旨在为供应商提供信息以找出技术解决方法。
1.3文件概述●本文旨在为供应商提供设计所需要的信息以找出技术解决方法●本文旨在描述用户洁净管道系统的设计、材料、安装、检查和测试、调试、文件和交付的说明和最低要求。
●本文包括但不限于对洁净管道基本的技术要求、工艺要求、技术要求、卫生要求、自动控制要求、法规和规范的符合性要求。
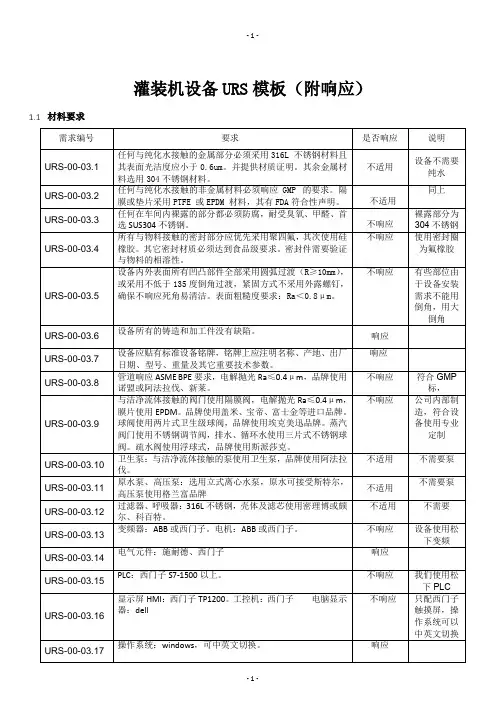
灌装机设备URS模板(附响应)材料要求需求编号要求是否响应说明URS-00-03.1 任何与纯化水接触的金属部分必须采用316L 不锈钢材料且其表面光洁度应小于0.6um。
并提供材质证明。
其余金属材料选用304不锈钢材料。
不适用设备不需要纯水URS-00-03.2 任何与纯化水接触的非金属材料必须响应GMP 的要求。
隔膜或垫片采用PTFE 或EPDM 材料,其有FDA符合性声明。
不适用同上URS-00-03.3 任何在车间内裸露的部分都必须防腐,耐受臭氧、甲醛、首选SUS304不锈钢。
不响应裸露部分为304不锈钢URS-00-03.4 所有与物料接触的密封部分应优先采用聚四氟,其次使用硅橡胶。
其它密封材质必须达到食品级要求。
密封件需要验证与物料的相溶性。
不响应使用密封圈为氟橡胶URS-00-03.5 设备内外表面所有凹凸部件全部采用圆弧过渡(R≥10mm),或采用不低于135度倒角过渡,紧固方式不采用外露螺钉,确保不响应死角易清洁。
表面粗糙度要求:Ra<0.8μm。
不响应有些部位由于设备安装需求不能用倒角,用大倒角URS-00-03.6 设备所有的铸造和加工件没有缺陷。
响应URS-00-03.7 设备应贴有标准设备铭牌,铭牌上应注明名称、产地、出厂日期、型号、重量及其它重要技术参数。
响应URS-00-03.8 管道响应ASME BPE要求,电解抛光Ra≤0.4μm,品牌使用诺盟或阿法拉伐、新莱。
不响应符合GMP标,URS-00-03.9 与洁净流体接触的阀门使用隔膜阀,电解抛光Ra≤0.4μm,膜片使用EPDM。
品牌使用盖米、宝帝、富士金等进口品牌。
球阀使用两片式卫生级球阀,品牌使用埃克美迅品牌。
蒸汽阀门使用不锈钢调节阀,排水、循环水使用三片式不锈钢球阀。
疏水阀使用浮球式,品牌使用斯派莎克。
不响应公司内部制造,符合设备使用专业定制URS-00-03.10 卫生泵:与洁净流体接触的泵使用卫生泵,品牌使用阿法拉伐。
安装需求:
1、设备支承座采用耳式支座
2、设备安装水平,水平尺测量,气泡位于中央。
3、设备的安装位置应有足够空间进行维修、清洗等操作。
4、搅拌安装与减速机架支撑面垂直,跟温度内盘管、温度计套管、釜底的距离适当,不能相碰。
5、内外观要求
内表面光滑,无死角和盲区,易观察、易清洁。
外表面光滑、整洁,造型美观,过渡处倒角和圆角处理。
保温平整冷热保。
6、设备的基本要求
设备、管路静密封结合处应无泄漏。
罐体、罐盖、夹套无明显变形缺陷。
管件、管线、阀门、机座及其它零部件齐全,安装应符合工艺要求。
基础、支座紧固可靠。
瓷面(包括罐体、罐盖、温度计套管、搅拌)应无损坏及崩瓷,局部损伤应有防腐措施。
设备运转部分零件相对公差,满足实际生产工艺要求。
罐内进行气密实验时,机械密封处泄漏量能满足生产工艺要求。
缸盖密封垫应符合工艺要求,罐卡子要均匀,拧紧力相同,无渗漏。
R-EG-1043-00-01。
文件内容1 范围 (2)2 参考标准 (2)3 目的 (2)4 定义 (2)5 管理机构及职责 (2)6 URS与确认的关系 (3)7 管理流程 (5)8 前提条件 (7)9 URS编制 (7)10 相关文件及记录 (21)11 变更登记 (22)发放范围:质量管理部产品制造部设备保障部技术发展部采购供应部技改工程部文件审批:1 范围本规程应包括URS用途、编写原则、编写规定和文件模版,适用于本公司工艺设备/设施、检验设备/仪器、仪表购置前提出的用户需求标准.本规程适用于本公司工艺设备/设施、检验设备/仪器、仪表购置的管理人员、技术人员。
2 参考标准《药品生产质量管理规范》(2010年修订版)《药品生产质量管理规范指南》(2010版)《中华人民共和国药典》(2010版)(ISPE)新建和改造的工厂医药工程指南.良好自动化生产实践指南第五版PIC/S指南:计算机化系统GMP指南;PIC/S备忘录:药品质量控制实验室检查;以上所列法律、法规及标准为最新版本且根据实际需要增加3 目的本规程为公司内公用系统、设施、工艺设备和实验室检测仪器的用户需求(URS)的编写提供依据.4 定义URS:即用户需求说明,是指使用方对设备、厂房、硬件设施系统等提出的自己的期望使用需求说明,这个需求综合根据自己的使用目的、环境、用途等提出自己具体的方案,设备供应商依据客户提供的URS方案进行设备设计(或确认自己已经完成设计的设备能符合需方的要求),待客户完成DQ(设计确认)后,再进行设备的制造。
公用系统:指制药生产线中所需要的水、冷、气/汽、电、压缩空气、真空等系统设施的统称。
设施:指制药企业中与生产、检验、仓储、工程等相关的车间、实验室和仓库等功能房间的统称。
工艺设备和检测设备:指制药企业中与生产工艺和质量检验相关的关键设备。
项目:一个要在一定时间内、利用有限资源(人力,物力,财力等)完成的、要满足一系列特定目标(性能,质量,数量,技术指标)的有限任务。
机用户需求标准你的签名表明你已清楚了解本文件及附件内容,充分理解并认可本文件的所有条款。
任何对本文件及其附件的目的、内容或标准进行的改变或修正都必须起到改善的作用,并详细记录本文件的修订及变更历史,并且在执行以前必须取得批准。
目录1. 目的 (5)2. 范围 (5)3. 术语及定义 (5)3.1 GMP:药品生产质量管理规范 (5)3.2 URS:用户需求说明 (5)3.3 FAT:工厂验收测试 (5)3.4 SAT:现场验收测试 (5)3.5 DQ:设计确认 (5)3.6 IQ:安装确认 (5)3.7 OQ:运行确认 (6)3.8 PQ:性能确认 (6)3.9 GAMP:良好自动化生产规范 (6)3.10 P LC:程序控制器 (6)4. 职责 (6)4.1 需求方职责 (6)4.2 供应商职责 (6)5. 项目概述 (6)5.1 项目简介及背景 (5)5.2 主要用途 (5)5.3 工艺流程 (5)5.4 主要生产产品 (5)6. 供货范围(主要设备及数量) (5)7. 法规与标准 (7)7.1 药品法规要求 (7)7.2 国家标准要求 (7)7.3 行业标准要求 (6)7.4 公司管理制度要求 (6)8. 用户需求标准 (6)8.1 生产/运行能力 (6)8.2 性能/系统要求 (6)8.3 GMP要求 (7)8.4 EHS要求 (7)8.5 控制系统要求 (8)8.6 安全/断电及恢复 (8)8.7 清洁要求 (9)8.8 所需文件 (9)8.9 转运要求 (10)8.10 安装/验收要求 (10)8.11 培训要求 (11)8.12 售后服务 (11)8.13 对供应商要求 (11)8.14 其它 (12)9.附件 (12)时间控制表 (12)10. 客户反馈表 (12)1. 目的该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
生物安全柜用户需求(URS)
目录
1目的 (3)
2范围 (3)
3依据及参考文件 (3)
4职责 (3)
5缩写和定义 (3)
6用户及系统要求 (3)
6.1URS01:总体要求 (3)
6.2URS02:性能要求 (3)
6.3URS03:技术要求 (4)
6.4URS04:服务要求 (5)
6.5URS05:文件要求 (6)
7变更历史 (6)
8附件 (6)
8.1《URS响应信息表》 (6)
1目的
1.1本URS旨在阐述生物安全柜的用户需求,该URS将作为生物安全柜设备功能要求规范的
基础,并用作设备采购确认的基础资料。
2范围
2.1本URS描述了生物安全柜的基本需求。
3依据及参考文件
3.1YY0569-2005生物安全柜、药品生产质量管理规范2010版。
4职责
4.1设备使用部门负责起草此文件,质量部和工程部负责审核,管理者代表负责批准。
4.2设备采购部门负责执行此文件。
5缩写和定义
6用户及系统要求
6.1URS01:总体要求
6.2URS02:性能要求
6.3URS03:技术要求
6.4URS04:服务要求
6.5URS05:文件要求
7变更历史
8附件
8.1《URS响应信息表》
URS响应信息表
确认/日期:。