九年级化学过氧化钠的基本性质
- 格式:docx
- 大小:148.88 KB
- 文档页数:3

过氧化钠的化学性质详案好,同学们上课了。
前面我们学习了过氧化钠的相关性质。
老师现在来考考大家。
看同学们掌握得怎么样。
当实验室的过氧化钠着火时,我们能用水来灭火吗?不能。
为什么呢?因为过氧化钠能与水反应。
是的,因为过氧化钠能与水发生反应,并且产生助燃剂氧气,同时放出大量的热量,会加速过氧化钠的燃烧。
好,现在我请一位同学上台来完成这个反应方程式。
我们来看一下,这们同学写得对不对。
既然我们不能用水来灭火,那我们可以用泡沫灭火器来灭火吗?有的同学说可以,有的同学说不可以。
我们都知道泡沫灭火器能产生二氧化碳,隔绝可燃物与氧气的接触,从而达到灭火的目的。
那么看来泡沫灭火器是可以灭火的。
其实啊,当实验室的过氧化钠着火时,我们不能用泡沫灭火器来灭火。
因为,过氧化钠能与二氧化碳反应。
今天我们主要来学习过氧化钠与二氧化碳的反应。
现在,我们来做实验看过氧化钠与二氧化碳到底生成了什么。
这是一瓶过氧化钠。
大家看到了什么?纸燃烧起来了。
是的,我们看到纸燃烧起来了。
我们知道可燃物燃烧必需满足两个条件,第一个是,,,,第二个。
、、、我们从第一个可以看出这是一个放热反应。
我们从第二个可以看出产生了一种气体,并且这种气体就是氧气。
因为刚刚老师是把过氧化钠包起来的,里面有很少的氧气。
而这个反应燃烧得很剧烈,需要大量的氧气。
而这个反应就刚好提供了燃烧所需的氧气。
除了生成了氧气还生成了什么呢?请位同学上台来.观察,我们可以看见有白色的固体出现。
这个白色的固体就是实验室很常见的碳酸钠。
我们看这瓶过氧化钠,瓶子周围也有白色的固体,那就是因为过氧化钠与空气中的二氧化碳反应生成了碳酸钠的缘固。
好,我们现在写出了这个反应的反应产物。
现在请同学们根据氧化还原反应的判定方法分析,这个化学反应是氧化还原反应吗?是是的,它是氧化还原反应。
我们现在来标化合价。
看来,在这个反应中,反应前后只有氧元素的化合价发生了变化。
这个反应类似于过氧化钠与水的反应。
过氧化钠同时作氧化剂和还原剂。


过氧化钠Na2O2一般指过氧化钠过氧化钠是钠在氧气或空气中燃烧的产物之一,纯品过氧化钠为白色,但一般见到的过氧化钠呈淡黄色,原因是反应过程中生成了少量超氧化钠。
过氧化钠易潮解、有腐蚀性,应密封保存。
过氧化钠具有强氧化性,可以用来漂白纺织类物品、麦杆、羽毛等。
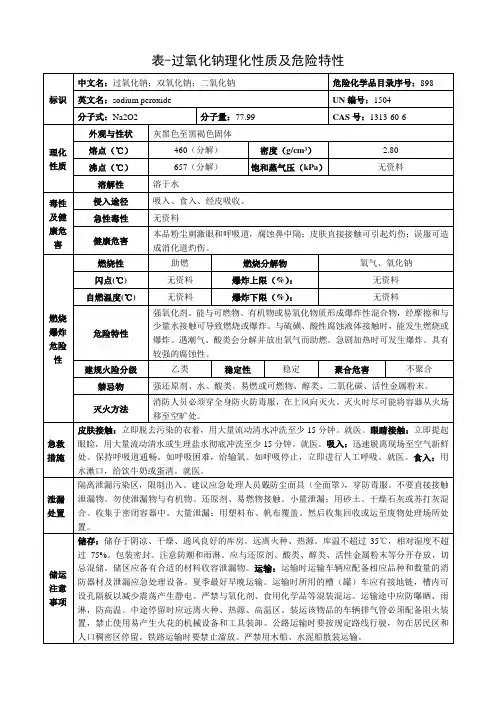
中文名过氧化钠英文名Sodium peroxide化学式Na2O2分子量79.7983CAS登录号1313-60-6EINECS登录号215-209-4[1]熔点460℃[1]沸点657℃[1]水溶性与水剧烈反应[1]密度2.8 g/cm3外观白色至黄色粉末应用氧气发生剂、漂白剂[2]安全性描述S:S7/8-S37/39[1]危险性符号R:R7-R14-R26/27/28-R29-R41[1]危险性描述强氧化性、与水反应比热容89.37 J/mol K[1]标准熵值95 J·mol−1·K−1[3]标准生成热−515 kJ·mol−1[3]吉布斯自由能-446.9 kJ/mol1理化性质物理性质固体(粉末)纯的过氧化钠为白色,易吸潮,溶于乙醇、水和酸(本质是与其发生反应),难溶于碱。
燃烧法制备的过氧化钠其中常含有10%的超氧化钠而显淡黄色,密度为2.805g/cm3,熔点为460℃[4],沸点657℃[1]。
其水合物有Na2O2‧2H2O和Na2O2‧8H2O两种。
化学性质过氧化钠是离子化合物,其中氧元素显-1价,钠元素显+1价,可以把过氧化钠溶解在低温的硫酸中,然后减压蒸馏即可得到过氧化氢(H2O2):过氧化钠可与水、酸反应,生成氢氧化钠和过氧化氢(过氧化氢会分解成水和氧气),也能与二氧化碳反应生成碳酸钠和氧气。
[2] 过氧化钠还能氧化一些金属。
例如,熔融的过氧化钠能把铁氧化成高铁酸根;能将一些不溶于酸的矿石共熔使矿石分解。
在碱性环境中,过氧化钠可以把化合物中+3价的砷(As)氧化成+5价,把+3价的铬(Cr)氧化成+6价。

过氧化钠的化学式
过氧化钠的化学式是Na2O2。
下面对过氧化钠的性质、制备、用途等方面进行详细介绍。
一、性质
1.物理性质
过氧化钠是无色至浅黄色晶体或粉末,密度为2.805 g/cm³,在水中溶解度较高,在25℃时溶解度为64 g/100 mL水。
2.化学性质
过氧化钠是一种强氧化剂,可以与许多物质发生反应,例如能与硝酸银反应,产生沉淀。
在水中分解为氧气和氢氧化钠。
二、制备
1.饱和透氧化氢水溶液法
将饱和透氧化氢水溶液与碳酸钠或氢氧化钠反应,可以得到过氧化钠。
2.电解法
将饱和氯化钠溶液电解制备出碳酸钠,再将碳酸钠与过氧化氢反应,制备出过氧化钠。
三、用途
1.漂白剂
过氧化钠是一种常用的漂白剂,可以用于纸浆、纺织品、食品等的漂白处理,也可以用于水处理中的漂白。
2.氧化剂
过氧化钠是一种强氧化剂,可以用于有机合成反应中的氧化剂,例如可用于苯乙烯的氧化反应。
3.防火剂
过氧化钠可以作为防火剂使用,可添加到聚合物中,能够增加其抗燃性。
4.医药用途
过氧化钠还具有一定的消毒、杀菌效果,在医药方面也有一定的应用。
例如可以用于牙齿漂白、口腔清洁等方面。
总之,过氧化钠作为一种常用的漂白剂和氧化剂,在工业生产和生活中有着广泛的应用。

三氧化硫和过氧化钠一、三氧化硫和过氧化钠的物理和化学性质三氧化硫(SO3)是一种无色固体,熔点为16.8℃,沸点为44.8℃。
它在室温下易与水反应生成硫酸,是火柴、硝石、硫磺等物品的强烈氧化剂。
过氧化钠(Na2O2)是一种淡黄色的固体,密度为2.86 g/cm³。
它在水中溶解时会释放出氧气,是强氧化剂。
二、三氧化硫和过氧化钠的反应1.三氧化硫与过氧化钠的反应当三氧化硫与过氧化钠反应时,会生成硫酸钠和氧气。
这个反应可以用化学方程式表示为:2Na2O2 + 2SO3 → 2Na2SO4 + O2。
在这个反应中,过氧化钠中的氧原子被氧化成氧气,而三氧化硫中的硫原子被还原成硫酸根离子。
2.三氧化硫与水的反应当三氧化硫与水反应时,会生成硫酸和氧气。
这个反应可以用化学方程式表示为:2H2O + SO3 → H2SO4 + O2。
在这个反应中,水中的氢原子被氧化成氧气,而三氧化硫中的硫原子被还原成硫酸根离子。
三、三氧化硫和过氧化钠的应用1.三氧化硫在工业上的应用由于三氧化硫具有强烈的氧化性,因此在工业上可以用于制造硫酸等酸性物质。
此外,三氧化硫还可以用于纸浆的漂白。
2.过氧化钠在工业上的应用过氧化钠具有强氧化性,因此可以用于漂白织物、丝毛织品以及治理废水等。
此外,过氧化钠还可以用于制备高纯度二氧化硅等无机物。
四、三氧化硫和过氧化钠的安全性1.三氧化硫的安全性由于三氧化硫具有强烈的腐蚀性和毒性,因此在操作时应穿戴防护服和化学防护眼镜,并使用化学防护手套。
如果不慎接触到三氧化硫,应立即用大量清水冲洗接触部位,并及时就医。
2.过氧化钠的安全性过氧化钠具有强氧化性和腐蚀性,因此在操作时应穿戴化学防护服、化学防护眼镜和化学防护手套。
如果不慎接触到过氧化钠,应立即用大量清水冲洗接触部位,并及时就医。
总结:本文主要介绍了三氧化硫和过氧化钠的物理和化学性质、反应、应用以及安全性等方面的内容。
虽然三氧化硫和过氧化钠都具有强氧化性和腐蚀性,但它们在工业生产和科学实验中都具有广泛的应用前景。

过氧化钠的性质过氧化钠是一种强氧化剂,其化学式为Na2O2,由于其具有强氧化性,所以它在生产和实验室中应用非常广泛。
物理性质:过氧化钠呈无色到灰白色的结晶或粉末,在空气中易吸收水分,有较强的腐蚀性。
它的密度为2.80 g/cm3,熔点为460℃,沸点为无明显沸点。
化学性质:1.强氧化性:过氧化钠是一种非常强的氧化剂,可以将很多物质氧化为高价态。
例如,它可以氧化二氧化锰生成高价态的四氧化三锰:2Na2O2+3MnO2→2Na2O+2Na2MnO42.还原性:在水溶液中,过氧化钠呈现还原性,并且能还原到氢氧化钠。
例如,它可以还原高氧化态的锰为二氧化锰:Na2O2+2MnO4-+2H2O→2Na+ +2MnO2+4OH-3.水解性:过氧化钠在水中迅速水解形成氧和氢氧化钠。
例如,Na2O2+2H2O→2NaOH+O24.缓蚀性:过氧化钠能被各种有机化合物缓蚀,例如羟基甲基纤维素和丙烯酸乙二酯共聚物等。
5.爆炸性:过氧化钠极易爆炸,甚至在微量杂质的情况下也会发生剧烈反应。
因此,在储存和使用过氧化钠时应严格遵循安全操作规程。
应用:1.漂白剂:过氧化钠在工业中常用作漂白剂,能够漂白织物、纸张和食品等。
2.杀菌剂:过氧化钠在医疗、农业等领域中也有着广泛的应用,它可以清除和杀灭微生物和有机物。
3.氧化剂:过氧化钠是一种强的氧化剂,可以用于有机物的氧化反应。
4.催化剂:过氧化钠还可以用作催化剂,通过增强反应过程中的自由基的生成和稳定来提高反应的速率。
总之,过氧化钠是一种非常重要的化学品,具有强氧化性、还原性、水解性、缓蚀性等化学性质。
在工业、科研、医疗、农业等领域都有广泛应用。
在使用和储存时,应严格遵循安全规程,以免发生意外事故。

《过氧化钠》讲义一、过氧化钠的基本性质过氧化钠,化学式为 Na₂O₂,是一种淡黄色的固体粉末。
它具有强氧化性,在化学反应中常常表现出独特的性质。
过氧化钠的熔点约为 460℃,沸点约为 657℃。
相对密度为 2805。
在常温下,过氧化钠能与二氧化碳、水等物质发生反应。
二、过氧化钠的化学性质1、与水的反应过氧化钠与水反应是一个非常重要的化学过程,化学方程式为:2Na₂O₂+ 2H₂O = 4NaOH + O₂↑。
在这个反应中,过氧化钠既表现出氧化性,又表现出还原性。
过氧化钠中的氧元素,一部分从-1 价变为-2 价,生成氢氧化钠;另一部分从-1 价变为 0 价,生成氧气。
这个反应会放出大量的热,使周围环境温度升高。
同时,产生的氧气可以使带火星的木条复燃。
2、与二氧化碳的反应过氧化钠与二氧化碳反应的化学方程式为:2Na₂O₂+ 2CO₂=2Na₂CO₃+ O₂。
在这个反应中,过氧化钠同样既表现出氧化性,又表现出还原性。
它将二氧化碳转化为碳酸钠,并释放出氧气。
这一性质使得过氧化钠在呼吸面具和潜水艇中被广泛应用,用于吸收人体呼出的二氧化碳并提供氧气。
3、与酸的反应过氧化钠与酸反应,生成相应的盐、水和氧气。
例如,与盐酸反应的化学方程式为:2Na₂O₂+ 4HCl = 4NaCl + 2H₂O + O₂↑。
4、强氧化性过氧化钠具有强氧化性,能够氧化许多物质。
例如,它可以将亚铁离子氧化为铁离子,将二氧化硫氧化为硫酸根离子等。
三、过氧化钠的制备方法过氧化钠通常可以通过钠在空气中燃烧来制备。
将金属钠加热至熔化,然后在空气中迅速燃烧,生成淡黄色的过氧化钠。
反应的化学方程式为:2Na + O₂= Na₂O₂(条件:点燃)在制备过程中,需要注意控制反应条件,以确保产物的纯度和产率。
四、过氧化钠的用途1、供氧剂由于过氧化钠能够与二氧化碳和水反应生成氧气,所以在呼吸面具、潜水艇和航天器等密闭环境中,过氧化钠被用作供氧剂,为人员提供必要的氧气。

单质钠、过氧化钠的性质一、钠单质的性质(一)、物理性质钠单质很软,可以用小刀切割。
切开外皮后,可以看到钠具有银白色的金属光泽,很快就会被氧化失去光泽。
钠是热和电的良导体,具有较好的导磁性,钾钠合金(液态)是原子堆导热剂。
钠的密度是0.97g/cm3,比水的密度小,比煤油密度大。
钠的熔点是97.81℃,沸点是882.9℃。
钠单质还具有良好的延展性,硬度也低,能够溶于汞和液态氨,溶于液氨形成蓝色溶液。
(二)、化学性质钠原子的最外层只有1个电子,很容易失去,所以有强还原性。
因此,钠的化学性质非常活泼,在与其他物质发生氧化还原反应时,作还原剂,都是由0价升为+1价。
钠单质的金属性强,其离子Na+氧化性弱。
1、与O2反应常温时:4Na+O2=2Na2O (白色粉末)点燃时:2Na+O2====Na2O2 (淡黄色粉末)(钠在空气中点燃时,迅速熔化为一个闪亮的小球,发出黄色火焰,生成过氧化钠(Na2O2)和少量超氧化钠(Na2O4)。
)★Na2O2比Na2O稳定,Na2O可以和O2化合成为Na2O2,化学方程式为:2Na2O+O2=2Na2O22、钠能与卤素、硫、磷、氢等非金属直接发生反应,生成相应的化合物(以下反应常温下均反应),如:2Na+Cl2=2NaCl (放出大量热,生成大量白烟)2Na+S=Na2S(硫化钠) (钠与硫研磨会发生爆炸)2Na+Br2=2NaBr(溴化钠)(溴化钠可以用作镇静剂)2Na+H2====2NaH2、与水反应在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块钠放入水中。
为了安全应在烧杯上加盖玻璃片。
反应方程式:2Na+2H2O=2NaOH+H2↑观察到的现象及由现象得出的结论有:(1)钠浮在水面上(钠的密度比水小);(2)钠熔成一个闪亮的小球(钠与水反应放出热量,钠的熔点低);(3)钠在水面上四处游动(有气体生成);(4)发出嘶嘶的响声(生成了气体,反应剧烈);(5)事先滴有酚酞试液的水变红(有碱生成)。

过氧化钠开放分类:化学药品、钠的化合物、过氧化物过氧化钠过氧化钠之一氧元素为-1价。
②物理性质:淡黄色固体(粉末)。
③化学性质:过氧化钠不是碱性氧化物,但也可与水、二氧化碳,酸反应,反应过程中均有氧气放出,化学方程式分别为:2Na2O2 +2H2O ══ 4NaOH +O2↑2Na2O2 +2CO2 ══ 2Na2CO3 +O22Na2O2 +4HCl ══ 4NaCl +2H2O +O2↑与次高价非金属氧化物发生氧化还原反应,生成盐,但不放出氧气,如:Na2O2 +CO ══ Na2CO3Na2O2 +SO2 ══ Na2SO4④过氧化钠的用途:可做供氧剂,强氧化剂,具有漂白性。
过氧化钠之二化学式Na2O2,淡黄色粉末,密度2.805g/cm3。
它具有强氧化性,在熔融状态时遇到棉花、炭粉、铝粉等还原性物质会发生爆炸。
因此存放时应注意安全,不能与易燃物接触。
它易吸潮,遇水或稀酸时会发生反应,生成O2。
2Na2O2 + 2H2O ══ 4NaOH + O2↑2Na2O2 + 2H2SO4(稀)══ 2Na2SO4 + O2↑+ 2H2O反应放热。
它能与CO2作用,放出O2。
2Na2O2 +2CO2 ══ 2Na2CO3 +O2根据这个性质,可将它用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用。
它还可以用于消毒、杀菌和漂白。
过氧化钠之三[-O-O-]2-过氧离子,在[-O-O-]2-中,氧与氧之间是共价键。
是淡黄色粉末,商品常制成圆形小颗粒。
熔点约为675℃,相对密度为2.805,有二水合物和八水合物。
具有强氧化性,能强烈地氧化一些金属,例如能盐与乙醇,与其他易燃品放置在一起发生燃烧。
在熔融状态,几乎不分解,但遇到棉花、炭粉或铝粉时可发生爆炸,使用时要小心。
易吸潮,与水或稀酸作用时,生成过氧化氢,并猛烈放热。
生成的过氧化氢不稳定。
立即分解放出氧气,故加热过氧化钠水溶液则放出氧气。
过氧化钠与水的离子反应方程式过氧化钠与水的离子反应方程式1. 引言过氧化钠是一种强氧化剂,它与水发生离子反应时会产生怎样的化学反应呢?本文将通过对过氧化钠与水的离子反应方程式进行深入探讨,以期帮助读者更好地理解这一化学过程。
2. 过氧化钠与水的基本性质过氧化钠是一种无机化合物,化学式为Na2O2,常见的形式是白色结晶固体。
在水中溶解后,过氧化钠会产生氧气和氢氧根离子,是一个强氧化剂,在许多领域都有重要应用。
3. 过氧化钠与水的离子反应方程式过氧化钠与水的离子反应方程式为:2Na2O2 + 2H2O → 4NaOH + O2↑4. 反应机理当过氧化钠溶解在水中时,会发生水解反应,产生氢氧根离子和氧气。
具体来说,过氧化钠分解生成氢氧根离子和氧气的离子反应方程式为2Na2O2 + 2H2O → 4NaOH + O2↑。
5. 个人观点和理解对于过氧化钠与水的离子反应,我认为其反应机理清晰简单,但又蕴含着深刻的化学原理。
通过深入研究和了解这一反应方程式,不仅可以帮助我们更好地掌握化学知识,还能拓展我们对化学反应的认识,有助于我们在实践中更好地运用化学知识。
6. 总结通过本文的深入探讨,我们对过氧化钠与水的离子反应方程式有了更深入的了解。
掌握这一基础的化学知识,能够为我们日常生活中遇到的化学问题提供更好的解决思路。
结语在化学领域,过氧化钠与水的离子反应方程式是一个基础且重要的知识点,掌握它有助于我们更好地理解化学反应的机理。
希望本文能够为读者提供有益的信息,帮助大家更好地学习和应用化学知识。
过氧化钠与水的离子反应方程式是化学中的一个基础知识点,它展示了化合物在水中溶解时产生的化学反应过程。
通过深入研究和理解这一反应方程式,我们可以更好地掌握化学原理,并在实践中应用这些知识。
让我们再次回顾一下过氧化钠与水的离子反应方程式:2Na2O2 +2H2O → 4NaOH + O2↑。
这个方程式显示了过氧化钠在水中分解生成氢氧根离子和氧气的过程。
过氧化钠和二氧化硫反应的化学方程式
摘要:
一、引言
二、过氧化钠和二氧化硫的化学性质
三、过氧化钠和二氧化硫反应的化学方程式
四、反应过程的简要解释
五、结论
正文:
一、引言
过氧化钠(Na2O2)和二氧化硫(SO2)是两种常见的氧化剂,它们在许多化学反应中发挥着重要作用。
本文将详细介绍这两种氧化剂之间的反应过程,以及相关的化学方程式。
二、过氧化钠和二氧化硫的化学性质
1.过氧化钠:过氧化钠是一种白色固体,具有强氧化性,能与水、酸和有机物反应。
2.二氧化硫:二氧化硫是一种无色气体,具有还原性,能与氧气、水、碱等反应。
三、过氧化钠和二氧化硫反应的化学方程式
过氧化钠和二氧化硫反应生成硫酸钠(Na2SO4)和氧气(O2)。
化学方程式如下:
2 Na2O2 + 2 SO2 → 2 Na2SO4 + O2
四、反应过程的简要解释
1.过氧化钠和二氧化硫在反应中起到氧化剂和还原剂的作用。
过氧化钠中的氧原子氧化状态为-1,而二氧化硫中的氧原子氧化状态为+4。
2.在反应过程中,过氧化钠中的氧原子被还原为-2 价,生成氧气;二氧化硫中的氧原子被氧化为+6 价,生成硫酸钠。
3.反应生成的氧气以气态释放,而硫酸钠则以固态形式存在。
过氧化钠的化学式
过氧化钠是一种常见的化学物质,其化学式为Na2O2。
有关过氧化钠的化学知识有很多,这一节将对其进行更具体介绍。
从最基本的化学式来看,过氧化钠是由两个氧原子和两个钠原子组成的。
它的分子量为61.98g/mol,构成这种盐的三个原子的原子质量分别为23.0g/mol、16.00g/mol和22.99g/mol。
它的分子结构呈平面构型,但是氧原子与钠原子之间存在化学键,这使得它不能被完全理解为一个平面构型。
过氧化钠具有高折射率、低表面张力和气体较易扩散等特性,因此在制作柔软膏体和涂料方面具有重要作用。
过氧化钠也可以用于水处理,作为一种可以有效抑制水中有害物质溶解的活性材料。
此外,过氧化钠还用于制作消毒剂,作为肥皂和医药中的辅料,广泛应用于日常生活中。
过氧化钠的反应是一种单步反应,反应后产物为过氧化钠和水,反应方程式为:Na2O2 + H2O ---> 2NaOH。
反应过程以水解反应来完成,反应速率很快,通常用于水处理中。
过氧化钠广泛应用于物理和化学领域,其优异的物理性能和化学性能对人类有着重要的作用。
过氧化钠的化学式Na2O2的知识对理解和应用它的特性有重要的意义。
希望本文能够帮助读者对过氧化钠的化学知识有更深入的认识。
- 1 -。
过氧化钠
•过氧化钠(Na2O2)的基本性质:
淡黄色固体,较稳定,可用作供氧剂、漂白剂
(1)与水反应:2Na2O2+2H2O==4NaOH+O2↑
(2)与CO2反应:2Na2O2+2CO2==2Na2CO3+ O2
(3)与HCl反应:2Na2O2+4HCl==4NaCl+2H2O+ O2↑
•过氧化钠的特性及计算:
1.过氧化钠的强氧化性
2.Na2O2与CO2、H2O(g)反应的重要关系
(1)气体体积差的关系
2Na2O2+2CO2===2Na2CO3+O2气体体积差①
2 1 ΔV=1
2Na2O2+2H2O(g)===4NaOH+O2气体体积差②
2 1 ΔV=1
由此可见,若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,即为生成氧气的量。
(2)先后顺序关系
一定量的Na2O2与一定量的CO2和H2O(g)的混合物反应,可视为Na2O2首先与CO2反应,
剩余的Na2O2再与H2O(g)反应。
(3)电子转移关系
当Na2O2与CO2或H2O反应时,每产生1molO2就转移2mol电子。
(4)固体质量变化关系
①足量过氧化钠与水、CO2反应的计算
所以,有ag通式符合(CO)m(H2)n(m=0,1,2,3…,n=0,1,2,3…)的物质(包括纯净物和混合物)在氧气中燃烧,将其通过足量过氧化钠,反应完毕后,固体增重ag。
•特别提醒:
(1)用脱脂棉包裹住过氧化钠,滴加少量水时脱脂棉可以燃烧,不仅可以说明Na2O2与H2O反
应生成O2,还可以说明该反应放热。
(2)Na2O2与H2O反应时H2O既不是氧化剂也不是还原剂。
方法技巧:Na2O与Na2O2的结构与性质
(1)Na2O中只含离子键,Na2O2中既含离子键,又含非极性键。
(2)等物质的量的Na2O与Na2O2分别于等量且足量的H2O反应,所得溶液的成分浓度相同。