初三化学专题复习 离子符号与化合价符号的异同点
- 格式:ppt
- 大小:173.50 KB
- 文档页数:10

初中化学化合价知识点归纳初中化学化合价知识点归纳在初中化学课堂上,我们将会认识一系列的化学元素,了解很多有趣的化学现象、那么你知道化合价是什么吗?关于化合价的内容你知道多少呢?下面是店铺为大家整理的初中化学重要知识点,希望对大家有用!初中化学化合价知识点归纳1化合价含义:由于形成化合物的元素有固定的原子个数比,所以化学上就用“化合价”来表示原子之间相互化合的数目化合价的表示方法化合物中各元素的化合价通常是在化学式中各元素符号或原子团的正上方标记,一般把“+”“-”写在前,价数写在后。
如元素化合价与离子表示方法的区别和联系化合价的一般规律① 单质中,元素的化合价为0,在化合物中,正、负化合价代数和为0② 在化合物中,氢元素的化合价通常为+1价,氧元素的化合价通常显示-2价③ 金属元素在化合物里显正价,非金属元素在和金属元素化合时,通常显负价④ 一些元素在不同物质中可显不同的化合价,如Fe有+2、+3价,S有-2、+4、-6价备注:这里介绍两种化合价口诀供给同学们记忆:口诀1:一价钾钠氯氢银;二价氧钙钡镁锌;三铝四硅五价磷;二三铁,二四碳,二四六硫都齐全,铜汞二价最常见。
莫忘单质为零价口诀2:钾钠银氢正一价,钙镁钡锌正二价;氟氯溴碘负一价,通常氧是负二价;铜正一二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四和正。
化学式的计算(1)某物质的相对分子质量的计算将化学式中所有的原子的相对原子质量相加之和,即是该物质的相对分子质量(2)计算化合物中的原子个数之比在化学式中,元素符号右下角的数字就是表示该元素原子的个数,因此这些数字的比值就是化合物中的原子个数之比,如:Fe2O3中,铁原子与氧原子个数比就是2 :3(3)计算化合物中各元素质量之比化合物中,各元素质量之比就是各元素的原子个数与它的相对原子质量积之间的.比值(4)计算化合物中某一元素的质量分数(5)计算一定质量的物质中某元素的质量某元素的质量=物质的质量×该元素在物质中的质量分数初中化学化合价知识点归纳2一、氧气的性质【物理性质】密度略大于空气的密度。

初中化学离子式知识点归纳离子式是化学中表示离子化合物组成的一种方式。
化学中的离子式通过符号表示出化合物中不同元素的种类和数量,并用上下标表示离子的电荷。
掌握离子式的知识对于初中化学学习是非常重要的,下面将对初中化学离子式的知识点进行归纳和总结。
一、离子的概念离子是由于失去或获得电子而带电的原子或原子团。
正离子是失去一个或多个电子而成为带正电荷的离子,称为阳离子;负离子是获得一个或多个电子而成为带负电荷的离子,称为阴离子。
二、离子符号及电荷的表示1. 正离子的符号只写元素符号,例如氧离子的符号为O2+;2. 负离子的符号在元素符号后添加一个“-”符号,然后写电荷的绝对值,例如氯离子的符号为Cl-。
三、简单离子式的写法和规则1. 由单个离子组成的化合物的离子式为离子的符号,例如氯离子的离子式为Cl-,氧离子的离子式为O2+;2. 由多个离子组成的化合物的离子式需要根据离子的数目和电荷来写。
当阴离子和阳离子的电荷数相等时,只需将它们的符号写在一起即可,例如氯离子和钠离子结合成的氯化钠的离子式为Na+Cl-;3. 当阴离子和阳离子的电荷数不相等时,需要通过交叉法则来确定它们的相对数目。
首先确定阳离子的电荷数和阴离子的电荷数的最小公倍数,然后根据最小公倍数确定它们的相对数目,最后将它们的符号写在一起即可,例如氧离子和钠离子结合成的氧化钠的离子式为Na2O。
四、多原子离子的离子式多原子离子是由多个原子组成的带电离子。
常见的多原子离子有氢氧根离子(OH-)、碳酸根离子(CO3^2-)等。
多原子离子的离子式写法与简单离子式类似,只需将离子的符号写在一起即可。
例如氢氧根离子的离子式为OH-,碳酸根离子的离子式为CO3^2-。
五、离子式的使用离子式不仅可以表示离子的组成,还可以用来表示化合物的化学方程式。
在化学方程式中,离子式用来表示反应物和生成物的种类和数量。
例如氯化钠溶解在水中的化学方程式为NaCl(s) + H2O(l) -> Na+ + Cl-。

课题4化学式与化合价【知识要点回顾】一、化学式、 二、化合价1.化合价的含义:化学上用“化合价”来表示不同种元素的原子之间相互化合的数目。
2.化合价的表示方法:在元素符号的标出元素的化合价,写在前,写在后。
如。
【:元素化合价的表示应与离子符号的书写相区别,不可混淆。
如:氧化镁中镁元素的化合价为+2 价可表示 1.化学式的概念:用 和 的组合表示物质组成的式子叫做化学式。
纯净物具有固定的组成,每种物质的化学式只能有一个。
2.化学式的意义:由分子构成的物质,其化学式的意义(以 H 2O 为例)为 ,镁离子的符号可表示为 。
3.化合价规则:化合物中,元素正负化合价的代数和为。
4.在许多化学反应中常作为一个整体参加的原子集团,叫做原子团,也叫做。
原子团的化合价与对应离子2-所带的电荷数值相等,符号相同。
如:“硫酸根离子(S O4合物中的化合价通常表现为 价。
5.化合价规律:)”带 2 个单位的负电荷,所以硫酸根原子团(SO 4)在化【: ①由分子构成物质的化学式前加系数,化学式失去宏观意义,只表示分子的个数“2H 2O ”表示 。
②元素符号右下角的数字表示一个分子中该元素的原子个数 如:CO 2 中“2”表示 。
3.化学式的写法 (1)单质化学式的写法 ①直接用 表示,包括由原子直接构成的金属和稀有气体,以及常温下大部分为固态的非金属单质。
如: ①化合物中,H 元素通常显+1 价,O 元素通常显-2 价;②化合物中,K ,Na ,Ag +1 价,Al +3,亚铁+2,铁+3,其余金属通常显+2 价;③硫酸根(SO 4)、碳酸根(CO 3)-2 价;硝酸根(NO 3)、氢氧根(OH )-1 价,铵根(NH 4)+1 价; ④氯化物中,Cl 元素显-1 价;⑤化合物中,元素正负化合价的代数和为 0(化合价规律)。
四、根据化学式的计算铁的化学式表示为,氦气化学式表示为,红磷化学式表示为。
1.相对分子质量:化学式中各原子的总和,就是物质的相对分子质量(符号为M r)。

初中化学化合价知识点归纳通用4篇初中化学化合价知识点归纳 1化合价口诀:+1价钾钠银铵氢,+2价钡钙镁铜汞锌二三铁、二四碳,三铝四硅五价磷,氟、氯、溴、碘-1价氧硫-2要记清。
氢氧根、硝酸根(OH、NO3 )-1价,硫酸根、碳酸根(SO4 、CO3 )-2价,化合物各元素化合价代数和为零,单质元素化合价是零。
注:铵是NH4原子团;+2价的铁叫“亚铁”;+1价的铜叫“亚铜”无氧时S为-2价,跟氧结合时+4或+6价。
SO32-原子团叫“亚硫酸根”无氧时Cl为-1价,跟氧结合时+1、+3、+5或+7价上面对化合价口诀知识点的总结内容,相信同学们已经能很好的掌握了,希望同学们考试成功。
化学会考知识点总结:实验室制取气体的思路同学们对实验室制取气体的思路知识还熟悉吧,下面我们一起来学习哦。
初中化学化合价知识点归纳 21、化学方程式左写反应物,右边写生成;写对化学式,系数来配平; 中间连等号,条件要注清;生成沉淀气,箭头来标明。
一找元素见面多,二将奇数变成偶;三按连锁先配平,四用观察配其它;有氢找氢无氢找氧,奇数配偶变单成双;出现分数去掉分母,调整系数使支配平。
2、离子方程式客观事实要遵从,书写形式分异同;生成符号要写对,质量电荷要守恒。
3、干燥气体酸干酸,碱干碱,氧化不能干还原,中性干燥剂,使用较普遍,只有不反应,干燥就能成。
4、空气组成空气组成别忘记,主要成分氮氧气;氮七八氧二一,零点九四是稀气;还有两个零点三,二氧化碳和杂气;体积分数要记清,莫要当成质量比;还要注意防污染,环保意识要树立。
5、碳硫磷铁在氧气中燃烧的现象红热木炭剧烈燃烧,发出白光温度很高;燃硫入氧燃烧变旺,火焰紫色美丽漂亮,生成气体气味够“呛”;燃磷入氧现象难忘,浓厚白烟冷却粉状;铁丝燃烧火星四射,生成熔物固态黑色。
6、氧中燃烧的特点氧中余烬能复烯,磷燃白色烟子漫,铁烯火星四放射,硫蓝紫光真灿烂。
7、氯中燃烧的特点磷燃氯中烟雾茫,铜燃有烟呈棕黄,氢燃火焰苍白色,钠燃剧烈产白霜。

易错点04 元素与化合价【易错分析】1. 某物质只含有一种元素, 则该物质可能是单质(如O2 )或混合物(如O2和O3混合后物质) , 绝不可能是化合物。
2. Na(钠原子)和Na +(钠离子)性质不同的原因:最外层电子数不同。
3. 元素的种类由原子所含质子数决定,不同种元素的本质区别是质子数不同;4. 元素的化学性质由原子的最外层电子数决定。
最外层电子数相同,元素化学性质相似。
5. 食品和饮料的标签中标有X(元素符号)的含量,这个X指的是元素而不是原子,更不是单质。
6. 地壳中氧的含量位于首位,但空气中不是。
7. 地壳中含量最多的金属是铝而不是铁,人体内含量最多的金属是钙而不是钠,海水中含量最多的金属是钠而不是钾。
8. 元素符号有两种意义,表示一种元素,表示该元素的一个原子。
但有些元素符号有三种意义,如:Cu表示铜元素,表示一个铜原子,还表示单质铜;Si表示硅元素,表示一个硅原子,还表示单质硅;Ne表示氖元素,表示一个氖原子,还表示氖气。
9. 元素只能组成物质,而不能构成某个分子或原子。
10.①同种元素的原子或离子,质子数一定相同,如Na与Na+;而质子数相同的粒子不一定属于同种元素,如Na+与NH4+。
②同种元素的粒子因所带的电荷数不同,性质也不同,如Fe2+与Fe3+。
11. 如果在元素符号前加数字,该符号就只有微观意义,如2Fe只表示两个铁原子。
12. 元素是组成物质的基本成分,某物质含有什么,常指元素而非单质,如人体缺钙易得佝偻病,人体缺铁易患贫血病,此处的“钙”、“铁”指钙元素、铁元素,而不是钙单质、铁单质。
13. 在化学反应前后,元素种类不变,元素不会新生也不会消亡。
14. 由一种元素组成的物质不一定是单质,可能是混合物,如将氧气和臭氧混合装入一集气瓶中的物质显然是混合物,但只含一种元素。
15. 化合物中各元素化合价的代数和为0,原子团中,各元素化合价的代数和为其电荷数(注意正负)。

中考化学复习知识点总结中考化学复习知识点总结总结是对取得的成绩、存在的问题及得到的经验和教训等方面情况进行评价与描述的一种书面材料,通过它可以正确认识以往学习和工作中的优缺点,让我们一起来学习写总结吧。
总结一般是怎么写的呢?下面是店铺帮大家整理的中考化学复习知识点总结,希望对大家有所帮助。
中考化学复习知识点总结1知识点一:空气的成分空气是一种混合物,按体积分数计算,大约是氨气78%,氧气21%,稀有气体0.94%,二氧化碳0.03%,其他气体和杂质0.03%,所以空气的主要成分是氨气和氧气,这个百分数可理解为100L空气中,含氮气78L,氧气21L(1)空气的发现(2)空气的污染有害物质大致分为粉尘和气体两大类,其中排放到空气中的气体污染物较多的是二氧化硫、一氧化氮、二氧化氮。
这些气体主要来源于矿物燃料的燃烧和工厂的废气及汽车形成的烟雾等。
(3)空气中氧气体积分数的测定实验室用红磷在一密闭容器里燃烧,生成固体物质五氧化二磷(P2O5),消耗了空气中的氧气使容器内的压强降低,通过进入到容器里的水的体积来确定空气中氧气的体积分数。
知识点二:氮气的性质及其用途(1)氮气的性质:氮气是一种无色、无味的气体,它的熔点和沸点都很低。
熔点-209.8℃,沸点-195.8℃,密度1.250g/L,难溶于水。
氮气的化学性质很不活泼,通常情况下不燃烧,也不支持燃烧,不能供呼吸。
(2)氮气的用途:①氮气是制硝酸和氮肥的重要原料;②由于氮气的性质不活泼,所以用它做为常用的保护气,在氮气中焊接金属,可以防止金属氧化;灯泡充氮气可以延长使用寿命;食用包装里充氮气可以防止腐烂;医疗上在液氮冷冻麻醉条件下做手术;超导材料在液氮的低温环境下显示超导性能。
知识点三:稀有气体的性质及用途稀有气体包括氦气(He)、氖气(Ne)、氩气(Ar)、氪气(Kr)、氙气(Xe)等几种气体。
(1)稀有气体的性质:都是无色、无味的气体,性质很不活泼,很难与其他物质发生化学反应,曾叫惰性气体。
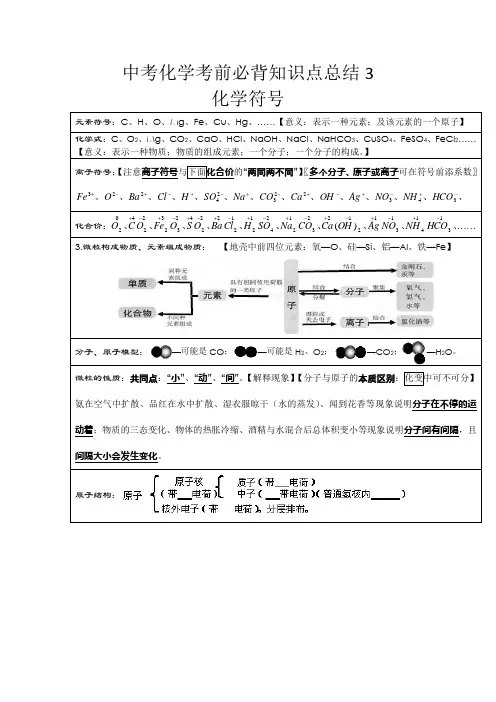
中考化学考前必背知识点总结3 化学符号 元素符号:C 、H 、O 、Mg 、Fe 、Cu 、Hg 、……【意义:表示一种元素;及该元素的一个原子】 化学式:C 、O 2、Mg 、CO 2、CaO 、HCl 、NaOH 、NaCl 、NaHCO 3、CuSO 4、FeSO 4、FeCl 2……【意义:表示一种物质;物质的组成元素;一个分子;一个分子的构成。
】离子符号:【注意离子符号与下面化合价的“两同两不同”】〖多个分子、原子或离子可在符号前添系数〗、、、、、、、、、、、、、、-+-+-+-+-+-+-+34322324223HCO NH NO Ag OH Ca CO Na SO H Cl Ba O Fe化合价:⋯⋯-+-+-+-+-+-+-+-+-+、、、、、、、、、、131413112223122412122224233222402)(HCO NH NO Ag OH Ca CO Na SO H Cl Ba O S O Fe O C O 3.微粒构成物质、元素组成物质: 【地壳中前四位元素:氧—O 、硅—Si 、铝—Al 、铁—Fe 】分子、原子模型:—可能是CO ;—可能是H 2、O 2;—CO 2;—H 2O 。
微粒的性质:共同点:“小”、“动”、“间”。
【解释现象】【分子与原子的本质区别:化变中可不可分】 氨在空气中扩散、品红在水中扩散、湿衣服晾干(水的蒸发)、闻到花香等现象说明分子在不停的运动着;物质的三态变化、物体的热胀冷缩、酒精与水混合后总体积变小等现象说明分子间有间隔,且间隔大小会发生变化。
原子结构:4.原子(离子)结构示意图:图A中,核电荷数为11,质子数为11,电子数为11,电子层数为3,最外层电子数为1。
图A~E中属于同种元素的是A与D。
【元素种类由核电荷数(即质子数)决定】微粒化学性质相似的是C、D 、E。
【化学性质由最外层电子数决定】〖元素化性不一定相同〗属于原子的是A、B、C;【质子数= 核外电子数】属于阳离子的是D;【质子数>核外电子数】属于阴离子的是E。

离子符号与化合价《离子符号与化合价》离子符号和化合价呀,可真是化学里挺有趣的东西呢。
先说离子符号吧,就像是化学世界里的小标签。
你看,那些原子们有时候就不安分,不是得到电子就是失去电子,然后就变成了离子。
像钠原子,它特别大方,很容易就把自己最外层的一个电子给丢出去了,这时候它就带了正电,变成了钠离子,它的离子符号就是Na⁺。
这个小符号可神奇了,就像是钠原子变身之后的新名片,告诉大家“我现在是带正电的钠离子啦”。
还有氯原子,它呢,就特别爱“捡便宜”,把钠原子丢的那个电子捡起来,自己就带了负电,变成了氯离子,符号是Cl⁻。
这一正一负的离子呀,就像磁铁的两极,很容易就相互吸引,然后就形成了氯化钠,也就是我们平常吃的盐。
再说说化合价吧。
化合价就像是每个原子在化合物里的价值体现呢。
比如说氧原子,在很多化合物里它的化合价是-2价。
这就好像是在一个化学的小社会里,氧原子有自己的固定价值。
氢原子呢,常常是+1价。
当氢原子和氧原子结合变成水(H₂O)的时候,你看,两个氢原子,每个是+1价,一个氧原子是-2价,这样加起来就正好电荷平衡啦。
就像大家一起合作,要讲究个平衡似的。
而且化合价这个东西呀,不是固定不变的,在不同的化合物里可能会有不同的化合价。
就像硫元素,有时候是-2价,在别的化合物里又可能是+4价或者+6价呢,感觉像个百变星君。
离子符号和化合价之间也是有着千丝万缕的联系的。
离子所带的电荷数和它的化合价数值是相关的。
比如钙离子Ca²⁺,它的化合价就是+2价。
这就像是它们在不同的角度描述同一个事情。
离子符号从微观的离子带电情况来说,化合价从原子在化合物里的结合能力和价值的角度来说。
我觉得离子符号和化合价虽然是化学里比较基础的概念,但它们特别重要。
就像盖房子的砖头一样,是构建化学知识大厦的基础。
要是搞不懂它们,那后面很多化学知识就像没有根基的大楼,摇摇欲坠。
对于我们学习化学来说,把离子符号和化合价弄明白,就像是拿到了打开化学世界大门的一把小钥匙。

一、化学式1.化学式的概念用元素符号和数字的组合来表示物质组成的式子。
注意:每种纯净物的组成是固定不变的,表示每种物质组成的化学式只有1个,是通过实验测定的,不能臆造。
2.化学式表示的意义化学式的意义以H 2O 为例①表示一种物质表示水这种物质宏观②表示该物质的元素组成表示水是由氢元素和氧元素组成的③由分子构成的物质的化学式可表示该物质的一个分子(又叫分子式)表示一个水分子微观④表示该物质的分子构成表示一个水分子是由两个氢原子和一个氧原子构成的3.化学式相关数字的意义(1)化学式前面的数字表示粒子(原子、分子)数目。
(2)离子符号前面的数字表示离子的数目。
(3)化学式右下角的数字表示一个某粒子中某原子或原子团的数目。
(4)离子符号右上角的数字表示该离子所带电荷数。
(5)元素符号(原子团)正上方的数字表示该元素(原子团)的化合价。
注意:化学式前面的化学计量数可变,化学式中各元素符号右下角的数字不能变。
4.元素符号与化学式的比较化学用语元素符号化学式宏观表示某种元素表示物质及其组成意义微观表示元素的一个原子表示物质的一个分子及分子的构成举例H①表示氢元素(宏观意义)②表示一个氢原子(微观意义)H 2①表示氢气(宏观意义)②表示氢气由氢元素组成(宏观意义)③表示一个氢分子(微观意义)④表示一个氢分子由两个氢原子构成(微观意义)说明若在元素符号前面添加数字则只能表示微观意义。
如2H 表示2个氢原子,不能说2个氢元素若在化学式前面添加数字则不再具有宏观意义。
如2H 2表示2个氢分子,不能说成2个氢气5.化学式的写法(1)22K Hg Zn Si He Ne Ar H O 金属单质:习惯上用元素符号表示,如、、等固态非金属单质:习惯上用元素符号表示,如C、等单质稀有气体单质:用元素符号表示,如、、等气体非金属单质:在元素符号右下角写上表示分子中所含原子数的数字,如、等⎧⎪⎪⎨⎪⎪⎩说明:稀有气体和金属是由原子直接构成的,因此可用元素符号来表示它们的化学式;固态非金属单质,它们的结构非常复杂,因此化学式也用元素符号来表示。

初三化学化合价及化学式的书写知识精讲化合价及化学式的书写1. 概念解释:化合价是元素之间化合时所具有的一种性质,表现为“一定数目”。
即:一种元素一定数目的原子只能跟其它元素一定数目的原子化合。
“一定数目”的确定取决于元素的原子结构,主要取决于原子最外层电子排布。
化合价法则:化合物中正负化合价代数和为零。
4. 化合价及离子符号的表示及区别。
①元素化合价的标法:a b ..位置:元素符号正上方正负号在前,数值在后⎧⎨⎩例:Na ClC O M g Ca O H +-+-+-+1142221202() ②离子符号的表示:a b ..位置:元素符号的右上角数字在前,正负号在后(注:电荷为时,“”省略不写)11⎧⎨⎩例:NaMg O Al Cl ++-+-223 5. 常见元素化合价口决:钾钠氢银正一价,钙镁锌钡正二价; 氟氯溴碘负一价,通常氧为负二价; 铜汞正二铝三价,铁有正二和正三; 碳有正二和正四,硫有负二正四六。
常见原子团化合价为:OH NO CO SO NH ----+112213344,,,, 6. 化合价与化学式的关系:化合价法则是建立化合价与化学式关系的依据。
化合价已知未知未知已知化学式根据化合价法则根据化合价法则−→−−−−−←−−−−−−⎧⎨⎪⎩⎪⎫⎬⎪⎭⎪7. 化合物化学式的书写。
书写原则:根据化合价法则,即:在化合物里,正负化合价的代数和为零。
书写方法:a. 排元素(或根)的顺序:正价左,负价右b. 标元素(或根)的化合价c. 正、负化合价数值交叉约简定原子个数d. 写出化学式e. 用化合价法则检查化学式的正误 例如:硫酸铁的化学式的书写步骤为:FeSO Fe SO Fe SO Fe SO a b c d 442432433322−→−−→−−→−++--()()()()()()在初中化学里学习到的物质中,只有乙炔和双氧水(过氧化氢)的化学式C H 22和H O 22,不能约简为CH 和HO 。

九年级化学离子知识点总结归纳离子是化学反应中不断转移电荷的粒子。
在化学学科中,理解离子的性质和反应机制对于学习化学非常重要。
在九年级的化学学习中,我们涉及了许多有关离子的知识点。
本文将对九年级化学中的离子知识点进行总结和归纳。
一、离子的定义和基本概念离子是指原子或分子失去或获得一个或多个电子而形成的带电粒子。
离子可以是阳离子(正离子)或阴离(负离子)。
阳离子是指原子或分子失去一个或多个电子后带正电荷的离子,而阴离子是指原子或分子获得一个或多个电子后带负电荷的离子。
二、离子的命名和化学式离子的命名和化学式是化学中表示离子的方式。
阳离子命名时,通常是将原子名称后面加上“离子”二字,如氢离子(H+)。
阴离子则根据元素名称的特点加上“-ide”、“-ate”、“-ite”等后缀,如氧化物离子(O2-)、硝酸根离子(NO3-)、亚硝酸根离子(NO2-)等。
化学式则是表示离子的符号,以阴离子在前,阳离子在后的形式表示,如NaCl表示氯化钠。
三、离子的价态和化合价离子的价态是指离子带有的电荷数,用+$n$或-$n$表示,其中$n$代表电荷数。
离子的化合价则指离子在化合物中所表现出的价态,可以根据元素的周期性和元素的电子构型推导出来。
化合价反映了元素的活泼性和化合能力,有助于理解元素之间的反应机制和化学性质。
四、离子反应和离子方程式离子反应是指离子之间发生的反应,包括溶液中的离子溶解、离子的沉淀反应、酸碱中的离子反应等。
离子方程式则是表示离子反应的化学方程式,其中用离子形式写出反应物和生成物。
离子方程式直观地展示了离子的转化和反应过程,对于理解离子反应有很大的帮助。
五、离子的溶解度和溶液浓度离子的溶解度是指在一定温度下,溶质在溶剂中溶解的最大程度。
离子溶解度与离子间的相互作用力、温度和压力等因素密切相关。
溶解度限制了离子在溶液中的存在形式和反应的进行。
另外,离子的溶解度也涉及到溶液的浓度问题,溶液浓度通常用溶质的摩尔浓度表示。
化学式与化合价 学习目标 1.了解化学式及其意义,知道常见元素及原子团的化合价。2.根据物质的化学式,会求出物质中某元素的化合价;根据物质中各元素的化合价,写出该物质的化学式。3.了解相对分子质量的含义,并能利用相对原子质量和相对分子质量计算物质的组成。4.能看懂某些商品标签或说明书上标示的物质成分和含量。
知识要点 1.化合价 含义:化合价是原子之间相互化合的数目。 规律:①化合价是元素相互化合时表现出的一种性质,有 价和 价之分。 ②在化合物中,氧通常显 价,氢通常显 价。 ③金属元素一般显正价,非金属元素与金属元素化合时,显 价,与氧化合时显 价。 ④某些元素在不同物质中可表现不同的化合价。 ⑤在化合物中,元素正负化合价代数和为 。 ⑥在单质中,元素化合价为 。 ⑦原子团也有一定的化合价。 表示方法:通常在元素符号的 方用+n或-n表示。 与离子符号区别:化合价书写时写在元素符号的 方,正负号在 ,化合价数在 ,(1不省略);离子符号书写时在元素符号的 先写其所带电荷数(1要省略),后标电性。 2.化学式 定义:用元素符号和数字的组合表示物质的组成的式子。 涵义:宏观:①表示 ;②表示 。 微观:①表示 ;②表示 。 (如果在前面附加了数字,则只能表示粒子的数目) 化学式的写法 单质化学式的写法 (1)金属单质和非金属的固体单质,用 表示它们的化学式。稀有气体是单原子分子,通常也用 表示它们的化学式。 (2)非金属气体单质如氧气、氢气、氮气等一个分子里含有两个原子,单质的化学式的写法是在元素符号右下角写上“2”,如氧气 、氮气 、氢气 等。 化合物化学式的写法 +在前,-在后,化合价,记在头;对角线,交叉走,先约分,后写数;写完之后验总数(为0)。 (当化学式中原子团有多个时,应先用括号括起,再在括号外的右下角标明数字。当原子团为一个时,括号及数字均省略。) 读法:①固态单质一般读成元素名称,气态单质一般在元素名称后加“气”字。 ②由两种元素组成的化合物一般由后往前读成“某化某”或“几某化几某”。 3.相对分子质量及根据化学式的计算 定义:化学式中各原子的相对原子质量的总和叫做相对分子质量 单位和符号:国际单位为1,符号为Mr +2 根据化学式的计算: (1)求元素化合价:依据化合物中元素的化合价代数和为零。 (2)关于相对分子质量的计算: ①计算相对分子质量: 。 ②计算化合物中元素的质量比:化合物中元素的质量比等于各元素的相对原子质量总和之比。 ③计算化合物中某元素的质量分数:化合物中某元素的质量分数就是该元素的质量与组成物质的元素总质量之比:
化合价(讲义)化合价(讲义)一、知识点睛1.化学上用化合价来表示________之间相互化合的数目。
2.化合价口诀(1)常见元素的化合价(“□”中为负价)三铝四硅五价磷二三铁、二四碳铜汞二价最常见(2)常见原子团的化合价原子团的化合价为各元素正负化合价的_________。
负一氢氧硝酸根负二硫酸碳酸根负三记住磷酸根正一价的是铵根3.化合价表示方法在元素符号或原子团的______依次标出“+”或“-”和价数。
4.离子符号与化合价的比较离子符号:H+Mg2+F-O2-NH4+OH-化合价:1H+2Mg+1F-2O-14NH+1OH-(1)相同点化合价与离子所带电荷,数值_____,符号_____。
(2)不同点离子符号中,___左___右(1省略),写在______;化合价中,___左___右(1不省略),写在______。
5.化合价一般规律(1)在化合物里,正负化合价的代数和为______;(2)氢元素通常显_______价,氧元素通常显______价;(3)金属元素与非金属元素化合时,金属元素显_____价,非金属元素显______价;(4)一些元素在不同物质中可显_______的化合价;(5)在单质里,元素的化合价为______。
6.化合价的应用依据:____________________________________________。
(1)已知化学式,求某元素的化合价。
①标出___________的化合价;②设出___________的化合价;③列____________,求解。
(2)已知化合价,确定化学式(十字交叉法)。
__________、__________、__________、__________写化学式时需注意:a.原子或原子团的个数为____时,1省略不写;b.含原子团的物质,原子团的个数不为____时,要用括号将_________括起来,括号右下角写上原子团的个数。
二、精讲精练1.标出下列元素在化合物中常见的化合价。
初中要点复习(一)一、分子和原子的认识(一)分子的认识1、分子的基本性质(1)分子是构成物质的一种粒子,其质量、体积都非常小。
自然界中大多数的物质是由分子构成的。
(2)分子在不断地做无规则运动。
温度越高,分子的运动速度就越快。
(3)分子之间有一定的间隔:气态>液态>固态(4)同种分子的化学性质相同;不同种分子的化学性质不同2、分子的概念:保持物质化学性质的最小粒子3、应用分子的观点认识:(1)纯净物、混合物:纯净物混合物纯净物:由分子构成的物质中,由同一种分子构成的。
如冰、水共存物实际为纯净物,因为其中的构成粒子只有一种——水分子。
混合物:由不同种分子构成的是混合物。
如红磷和白磷的混合体,区分纯净物和混合物的关键是把握“物质的种类”或“分子的种类”是否相同。
(2)物理变化、化学变化水蒸发是发生了物理变化,而水分解是发生了化学变化水蒸发时,水分子本身没有变化,变化的只是分子间的间隔。
水的化学性质也没有改变。
水分解时,水分子变成了氢分子和氧分子。
分子变了,生成的氢分子和氧分子不具有水分子的化学性质。
注意:在化学变化中,分子的组成一定改变,分子的数目可能改变。
(二)原子的认识1、原子定义:化学变化中的最小微粒2、化学反应的实质:化学变化中分子分裂成原子,原子重新组合成新分子。
3、分子、原子的主要区别:在化学反应中,分子可分,原子不可分4、分子、原子的相互关系:5、原子的基本性质:(1)原子也是构成物质的一种粒子,其质量、体积都非常小。
(2)原子同分子一样,也是时刻不停地做高速的无规则运动。
温度越高,能量越大,运动速度就越快。
(3)原子之间也有一定的间隔原子:分子:例1、国家游泳中心—“水立方”的设计灵感源于一个“方盆子”,许多“水泡泡”、许多“水分子”。
下列关于水分子的说法正确的是A、水分子是极小的水滴B、1个水分子由1个氢分子和1个氧原子构成C、1个水分子由2个氢原子和1个氧原子构成D、水分子不能再分(1)构成原子的粒子在原子里:核电荷数=质子数=核外电子数=元素序号,原子不显电性。