高一化学认识原子核
- 格式:pdf
- 大小:876.86 KB
- 文档页数:8

高一化学必修一第一单元知识点总结一、概览高一化学必修一第一单元是化学学习的基础,为学生们打开了探索化学世界的门户。
本单元的知识点总结涉及了化学的基本概念、理论和实验基础,为学生后续深入学习化学知识打下坚实的基础。
本单元的重点在于原子和分子的概念。
学生需要理解原子是构成物质的基本单位,包括质子、中子和电子的组成及其相互作用。
分子则是由两个或多个原子通过化学键连接而成的,其性质和结构决定了物质的性质。
这些基础概念的掌握对于理解化学反应的本质至关重要。
本单元还涉及了元素周期表的应用。
元素周期表是化学学习的重要工具,学生需要掌握如何根据元素在周期表中的位置,推断其原子结构、性质和化学反应。
这对于预测未知元素的性质以及理解元素之间的相互作用具有重要意义。
化学反应的类型也是本单元的重点内容。
学生需要了解常见的化学反应类型,如化合反应、分解反应、置换反应等,并理解其反应机理。
这些反应类型的掌握有助于理解化学反应的过程和结果,为后续的化学学习打下基础。
实验基础也是本单元不可或缺的部分。
化学是一门实验科学,学生需要通过实验来验证理论知识,并培养实验技能和科学素养。
本单元的实验基础包括实验室安全规则、实验仪器的使用以及基本的实验操作等。
高一化学必修一第一单元的知识点总结是化学学习的基础,涉及面广且深入。
学生需要认真掌握这些知识点,为后续深入学习化学打下坚实的基础。
1. 介绍化学的重要性和学习化学对于高中生的意义。
作为一门研究物质组成、结构、性质以及变化规律的基础自然科学,在高一的学习旅程中占据了举足轻重的地位。
对于刚刚踏入高中校门的学生来说,掌握化学的基础知识不仅是对学业的要求,更是对未来个人发展的有力投资。
化学的重要性不言而喻。
在现代社会,化学知识已经渗透到我们生活的方方面面。
从医药研发、材料科学到环境保护、能源利用,无一不依赖于化学的进步。
化学知识不仅帮助我们理解自然界的奥秘,还为众多行业的创新和发展提供了源源不断的动力。


高一化学一第一章知识点高一化学一第一章主要介绍了化学的基本概念和化学反应的基本原理。
在本章中,我们将学习有关原子结构、元素周期表、化学键、化学方程式等方面的知识。
一、原子结构在化学中,原子是构成物质的基本单位。
原子由原子核和电子组成,原子核由质子和中子组成。
质子带正电荷,中子不带电荷,而电子带负电荷。
原子的质子数等于电子数,因此原子呈电中性。
二、元素周期表元素周期表是按照元素的原子序数排列的一张表格。
元素周期表将元素按照一定的规律分组,使得相似性质的元素排在一起。
元素周期表根据元素的原子序数、电子结构和化学性质进行了系统的分类。
元素周期表可以分为周期和族。
周期指的是元素周期表中横行的行数,周期表共有7个周期。
族指的是元素周期表中的列数,根据元素的化学性质,族可以分为八个主族和八个副族。
三、化学键化学键是原子之间相互结合而形成的连接。
化学键类型包括共价键、离子键和金属键。
共价键是由两个非金属原子共用电子形成的,其特点是电子密度较高。
离子键是由金属离子和非金属离子间的静电作用形成的,其特点是带正电荷和带负电荷的离子之间相互吸引。
金属键是由金属原子之间的电子云形成的,其特点是金属离子之间形成的电子云能够自由移动。
四、化学方程式化学方程式是用化学符号表示化学反应的过程。
一个完整的化学方程式包括反应物、生成物和反应条件。
在化学方程式中,我们使用箭头表示反应的方向,反应物位于箭头的左侧,生成物位于箭头的右侧。
化学方程式中的化学符号表示原子或离子的种类和数量。
化合物的化学式用来表示化合物中不同元素的种类和原子数目。
总结:高一化学一第一章主要介绍了原子结构、元素周期表、化学键和化学方程式等基础知识。
通过学习本章内容,我们可以了解物质的组成结构和化学反应的基本原理。
这些基础知识为我们后续学习化学的更深层次的知识打下了坚实的基础。

原子核分子的介绍
原子是物质的基本结构单位,由原子核和围绕其运动的电子组成。
原子核位于原子的中心,是由质子和中子组成的紧密团簇。
质子带正电荷,中子带零电荷,由强相互作用力将它们牢牢束缚在一起。
原子核的半径大约等于 1.2×10^(-15)米,非常小但质量却占据整个原子质量的99.9%以上。
原子核内部极其致密,平均密度约为10^17千克/立方米,是常见物质密度的数十亿倍。
分子是由两个或更多原子通过共价键结合而成的微粒。
分子内部原子是通过共享外层电子的方式形成稳定结构。
分子的性质主要取决于其内部原子的排列和化学键的类型。
分子可以是同种原子组成的单质分子,如氧气(O2)、氮气(N2)等;也可以是由不同种类原子组成的化合物分子,如水(H2O)、二氧化碳(CO2)等。
气体、液体和固体物质中均存在大量的分子。
原子核和分子是自然界普遍存在的两种基本微观结构,对构成物质的各种形式、性质和现象起着决定性的作用。
了解原子核和分子的结构、组成和规律,对科学研究和生产实践都具有重要意义。
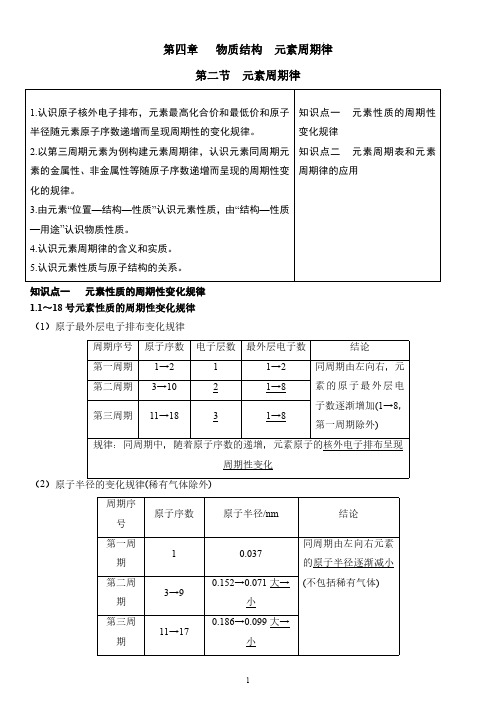
第四章物质结构元素周期律第二节元素周期律1.认识原子核外电子排布,元素最高化合价和最低价和原子半径随元素原子序数递增而呈现周期性的变化规律。
2.以第三周期元素为例构建元素周期律,认识元素同周期元素的金属性、非金属性等随原子序数递增而呈现的周期性变化的规律。
3.由元素“位置—结构—性质”认识元素性质,由“结构—性质—用途”认识物质性质。
4.认识元素周期律的含义和实质。
5.认识元素性质与原子结构的关系。
知识点一元素性质的周期性变化规律知识点二元素周期表和元素周期律的应用知识点一元素性质的周期性变化规律1.1~18号元素性质的周期性变化规律(1)原子最外层电子排布变化规律(2周期序号原子序数原子半径/nm结论第一周期10.037同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)第二周期3→90.152→0.071大→小第三周期11→170.186→0.099大→小规律:同周期中,随着原子序数的递增,元素的原子半径呈现周期性变化3.元素的主要化合价周期序号原子序数主要化合价结论第一周期1→2+1→0①同周期由左向右,元素的最高正价逐渐升高(+1→+7,O和F无最高正价);②元素的最低负价由第ⅣA族的-4价逐渐升高至第ⅦA族的-1价;③最高正价+|最低负价|=8第二周期3→9最高价+1→+5(不含O、F)最低价-4→-1第三周期11→17最高价+1→+7最低价-4→-1规律:同周期中,随着原子序数的递增,元素的主要化合价呈现周期性变化4.实验探究:金属性的递变规律(1)Na、Mg元素金属性强弱比较原理金属与水反应置换出H2的难易程度操作现象镁条表面附着少量气泡剧烈反应,溶液变成浅红色化学反应-Mg+2H2OMg(OH)2+H2↑结论结合Na与水的反应的现象,Na与水反应置换H2比Mg 容易,则金属性:Na>Mg(2)Mg、Al元素金属性强弱比较原理金属的最高价氧化物对应水化物的碱性强弱物质Al(OH)3Mg(OH)2操作现象A 中沉淀溶解B 中沉淀溶解C 中沉淀溶解D 中沉淀不溶解A 、B 、C 、D 试管中的离子方程式A :Al(OH)3+3H +===Al 3++3H 2O B :Al(OH)3+OH -===AlO -2+2H 2OC :Mg(OH)2+2H +===Mg 2++2H 2OD :不反应结论Al(OH)3是两性氢氧化物,其碱性弱于Mg(OH)2(中强碱),更弱于NaOH(强碱),则金属性:Na>Mg>Al5.非金属性的递变规律6.元素周期律(1)内容:元素的性质随着原子序数的递增而呈周期性的变化。

高一化学原子必背知识点化学是自然科学中的一门重要学科,它研究的是物质的组成、性质和变化规律。
而在化学的学习过程中,了解原子的结构和性质是非常重要的。
下面就让我们一起来探索一下高一化学中必背的原子知识点。
一、原子的基本概念原子是构成化学物质的最小粒子,是元素的基本单位。
它由电子、质子和中子组成。
质子带正电荷,中子不带电荷,电子带负电荷。
质子和中子组成原子的核,而电子则环绕在核的周围。
二、元素的标志元素是由具有相同原子序数(即质子数)的原子组成的纯物质。
元素的标志由元素符号表示,元素符号通常是元素的英文首字母缩写,如氢元素的符号为H,氧元素的符号为O。
三、质子数和中子数原子的质子数等于元素的原子序数,用Z表示。
原子的中子数是质子数和质量数(即原子核中质子数和中子数之和)之差,用N表示。
四、原子核的半径原子核半径很小,约为1.2×10^-15米。
与原子核相比,电子的半径要大约10^5倍。
这样,原子可以看作是一个由核和外层电子组成的类似于太阳系的结构。
五、电子的分布电子分布在不同的能级上,能级也称为电子壳。
第一能级最靠近原子核,最多容纳2个电子;第二能级次之,最多容纳8个电子;第三能级最外层,最多容纳18个电子。
电子在外层能级上的数量决定了元素的化学性质。
六、原子的同位素同位素是指原子核中质子数相同、中子数不同的原子。
同位素具有相同的化学性质,但有不同的物理性质。
例如,碳元素的同位素有碳-12、碳-13和碳-14。
七、原子的化合价原子的化合价是指其与其他元素结合时的价态,也称为原子的化合价。
多数元素的化合价与其最外层电子数有关。
例如,氢元素的最外层只有1个电子,因此它的化合价为1。
八、原子的周期表元素周期表是按照元素的原子序数(即质子数)顺序排列的。
它由周期和族组成。
周期是指元素的外层电子能级数,第一周期只有1个能级,第二周期有2个能级,以此类推。
族是指具有相同外层电子数的元素所组成的一列,如第一族是指外层只有1个电子的元素。
苏教版必修第一册第二专题第三单元人类对原子结构的认识第一课时人类认识原子结构的历程原子核的构成课题原子核的构成单元三学科化学年级高一【教学目标】1、通过对人类认识原子结构历程的了解,体验科学家探索原子结构的艰难过程,提升学生的科学探究能力与创新意识。
2、了解原子的构成,能根据原子(或离子)的表示符号并判断其中一些数量关系。
3、知道元素、核数与同位素的概念,知道同位素的应用。
【重点难点】1.熟悉并掌握原子(或离子)的表示符号并判断其中的数量关系。
2.学习并掌握核素与同位素的概念。
【教学过程】【第一课时】教学环节教师活动学生活动设计意图导入新课教师:投影一些常见的物质,如铜单质、氯化钠、水等,思考它们的构成认真倾听思考,了解一些常见物质的构成。
引出本节课内容。
图文并茂,能够较快地让学生进入本节课堂学习。
提高学习的兴趣和欲望。
教师:人类对原子结构的认识经历了漫长的过程,直到20世纪初,原子结构的奥秘才被揭示。
那么,人类对原子结构的认识过程是怎样的呢?请大家认识课本44-45页。
讲述人类认识原子结构的历程。
原子结构模型是科学家根据科学猜想和分析,通过对原子结构的形象和描摹而建构的揭示原子本质的认知模型。
教师:引出本节课学习内容——原子核的构成。
认真阅读教材,体会人类对原子结构的认识。
从宏观和微观结合的视角理解原子结构模型,并了解相关的证据。
体会人类认识原子的历史是漫长的,也是无止境的。
鼓励学生勇敢积极地面对学习的挑战,坚信必胜的信心。
讲授新课[温故知新]我们知道相对原子质量被定义为“某原子的质量与12C原子质量的1/12之比”你知道12C原子是指哪种碳原子吗?12代表什么意思?教师利用多媒体设备向学生投影出下面【新课讲解】原子结构教师:原子由原子核和核外电子构成,原子核由质子和中子构成。
整个原子是呈电中性的。
认真倾听,引发思考。
认真倾听。
思考原子呈电中性的原因。
记录笔记。
从对旧知识深度思考中引发探究学习。
高中化学原子核教案
教学内容:原子核的结构
教学目标:
1. 理解原子核的构成和性质;
2. 掌握原子核的重要概念和相关术语;
3. 能够解释原子核的稳定性和放射性的原因。
教学重点:原子核的组成和性质
教学难点:解释原子核的放射性
教学过程:
一、导入(5分钟)
通过展示一些具有放射性的物质或者核反应的实验视频,引出原子核的话题,让学生了解原子核的重要性和奥秘性。
二、讲解原子核的结构(15分钟)
1. 原子核由质子和中子组成,质子和中子的质量和电荷;
2. 原子核的大小和质量与整个原子的比较;
3. 原子核的核电荷和核子数的关系。
三、讨论原子核的稳定性(15分钟)
1. 什么是原子核的稳定性;
2. 为什么存在稳定的原子核和不稳定的原子核;
3. 通过示意图和具体的例子,让学生理解原子核的稳定性和放射性的原因。
四、实验探究(20分钟)
让学生进行仿真实验,通过模拟不同原子核的排列和组合,观察不同原子核的性质和稳定性,探索原子核的构成和性质。
五、总结和展望(5分钟)
通过讨论和总结,让学生重新回顾原子核的重要概念和性质,展望未来的研究方向和应用领域。
教学反思:在教学过程中,要引导学生充分思考和探索,激发他们对化学和核物理的兴趣和热情,提高他们的学习积极性和创新能力。
同时,要及时总结和提炼教学经验,不断完善教学内容和方法,提高教学效果和质量。
汝阳县实验高中2012——2013学年第二学期高一化学学案第一章第一节原子结构(第一课时)制作人:方尧瑶审核人:赵润豪包科领导:徐正武20131.学习重点1.了解原子的组成及同位素的概念;2.掌握原子序数、核电荷数、质子数、中子数、核外电子数等基本量间的相互关系;了解原子核外电子排布规律3.关于原子的组成及各粒子间的关系;分子、原子、离子核外电子数的比较;4。
同位素的质量数和平均相对原子质量,求同位素的原子个数比;粒子半径大小2.难点聚焦一、原子结构1.几个量的关系(AZ X)质量数(A)=质子数(Z)+中子数(N)质子数=核电荷数=原子序数=原子的核外电子数离子电荷数=质子数-核外电子数2.同位素⑴要点:同——质子数相同,异——中子数不同,微粒——原子。
⑵特点:同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
注意:同种元素的同位素可组成不同的单质或化合物,如H2O和D2O是两种不同的物质。
3.相对原子质量⑴原子的相对原子质量:以一个12C原子质量的1/12作为标准,其它原子的质量跟它相比较所得的数值。
它是相对质量,单位为1,可忽略不写。
⑵元素的相对原子质量:是按该元素的各种同位素的原子百分比与其相对原子质量的乘积所得的平均值。
元素周期表中的相对原子质量就是指元素的相对原子质量。
1.原子核(1)原子和原子核的组成①原子是由带正电的__________和带负电的__________所构成的。
②原子核一般是由__________(带正电荷)和__________(不带电荷)所构成的(_____原子除外,它的核内没有中子)。
③带电的原子或原子团称为__________。
(2)人类对微观世界的认识过程将下列科学家和其研究成果用直线连接起来:道尔顿··葡萄干面包模型汤姆孙··原子结构行星模型卢瑟福··近代原子论(3)同位素具有相同__________,不同__________的同一种元素的不同原子互称为同位素。