高考化学十年真题专题汇编解析-离子反应
- 格式:pdf
- 大小:1.10 MB
- 文档页数:32

专题二 离子反应(A卷)
一、选择题(每题5分,共50分)
1.(2018·安徽四校联考·8)下列有关Na2S溶液的叙述正确的是( )
A.该溶液中,SO2、Cl- K+、HCO3- 可以大量共存
B.和FeCl3溶液反应的离子方程式:S2- + Fe3+==Fe2+ + S
C.和少量盐酸反应的离子方程式:S2- + H+==HS-
D.1L0.1mol·L-1该溶液和足量硫酸铜溶液反应生成16.0克Cu2S
2.(2018·清华附中理科综合能力测试四·7)下列解释实验事实的方程式正确的是( )
A.氨水中滴入酚酞溶液,溶液变红:
NH3·H2O NH4+ + OH—
B.90℃时,测得纯水中c(H+)·c(OH—) =3.8×10—13:
H2O(l) H+(aq) + OH—(aq) H<0
C.FeCl3溶液中通入SO2,溶液黄色褪去:
2Fe3++SO2 +2H2O 2Fe2+ + SO42—+ 4H+
D.向苯酚钠溶液中通入CO2,溶液变浑浊:
2C6H5ONa+CO2+H2O → 2C6H5OH+Na2CO3
3.(2018·湖北省七市教科研协作体4月高三联考·13)25℃时在10mL 0.1mol•L﹣1Na2CO3溶液中逐滴加入0.1mol•L﹣1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
A. HCl溶液滴加一半时,溶液pH>7
B. 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol•L﹣1
C. 0.1 mol•L﹣1Na2CO3溶液中c(Na+)+c(H+)=c(OH﹣)+2c(CO32﹣)
+c(HCO3﹣)
D. 在M点:c(Na+)>c(CO32﹣)=c(HCO3﹣)>c(OH﹣)>c(H+)
4.(2018·苏锡常镇四市高三教学调研二·3)25℃时,下列各组离子在指定溶液中一定能大量共存的是

十年高考真题分类汇编(2010-2019) 化学
专题一 化学、STSE与化学用语
题型一、化学与STSE……………………………………………………………………………错误!未定义书签。
题型二、常见的化学用语正误判别……………………………………………………………6
题型一、化学与STSE
1.(2019全国Ⅰ)陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
2.(2019全国Ⅱ)“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是
A.蚕丝的主要成分是蛋白质
B.蚕丝属于天然高分子材料
C.“蜡炬成灰”过程中发生了氧化反应
D.古代的蜡是高级脂肪酸酯,属于高分子聚合物
3.(2019全国Ⅲ)化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池
B.铝合金大量用于高铁建设
C.活性炭具有除异味和杀菌作用
D.碘酒可用于皮肤外用消毒
4.(2019北京)下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
A.4.03米大口径碳化硅反射镜 B.2022年冬奥会聚氨酯速滑服 C.能屏蔽电磁波的碳包覆银纳米线 D.“玉兔二号”钛合金筛网轮
A.利用废弃的秸秆生产生物质燃料乙醇
B.利用石油生产塑料、化纤等高分子材料
C.利用基本的化学原料生产化学合成药物
D.利用反渗透膜从海水中分离出淡水
6.(2018全国II)化学与生活密切相关。下列说法错误的是 ( )
A.碳酸钠可用于去除餐具的油污
B.漂白粉可用于生活用水的消毒
C.氢氧化铝可用于中和过多胃酸

2019年高考真题专题汇编——离子反应
1.(2019江苏)室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L−1NaOH溶液:Na+、K+、23CO、2AlO
B.0.1 mol·L−1FeCl2溶液:K+、Mg2+、24SO、4MnO
C.0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D.0.1 mol·L−1H2SO4溶液:K+、4NH、3NO、3HSO
【答案】A
【解析】
【分析】
此题考的是离子共存问题,应从选项的条件获取信息,再从中判断在此条件的环境中是否有离子会互相反应,能大量共存就是没有可以互相发生反应的离子存在。
【详解】
A.是一个碱性环境,离子相互间不反应,且与OH-不反应,能大量共存;
B.MnO4-具有强氧化性,Fe2+具有还原性,两者会发生氧化还原反应而不能大量共存;
C.Ba2+可以与CO32-发生反应生成沉淀而不能大量存在;
D.酸性条件下H+与HSO3-不能大量共存,同时酸性条件下NO3-表现强氧化性会将HSO3-氧化而不能大量共存;
故选A。
2.(2019浙江)不能..正确表示下列变化的离子方程式是( )
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-2Mn2++5SO+4H+
B.酸性碘化钾溶液中滴加适量双氧水:2I−+2H++H2O2I2+2H2O
C.硅酸钠溶液和盐酸反应:SiO32-+2H+H2SiO3↓ D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe2Fe3++3Cu
【答案】D
【解析】
【详解】
D.Fe3+氧化性大于Cu2+,所以Cu2+只能将Fe氧化到Fe2+,因而硫酸铜溶液中加少量的铁粉的离子方程式为Cu2++FeFe2++Cu,D项错误。其他3个选项的离子方程式都是正确的。
故答案选D。
3.(2019课标II)下列化学方程式中,不能正确表达反应颜色变化的是( )
学习好资料欢迎下载专题12水溶液中的离子平衡
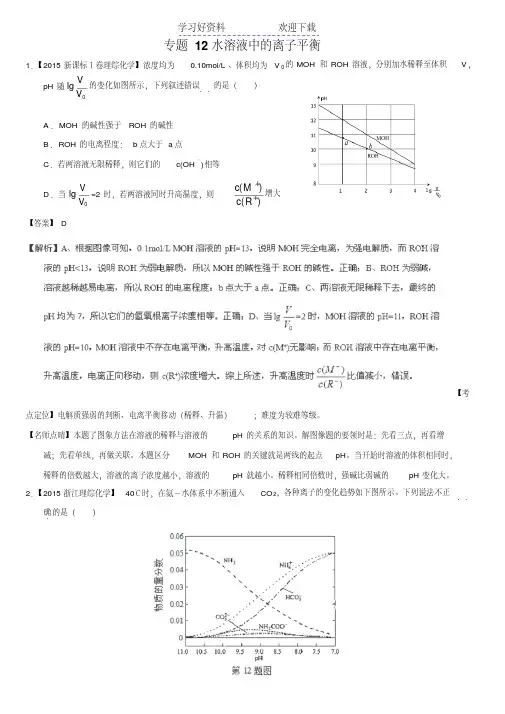
1.【2015新课标Ⅰ卷理综化学】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,
pH随0lgVV的变化如图所示,下列叙述错误..的是()
A.MOH的碱性强于ROH的碱性B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当0lgVV=2时,若两溶液同时升高温度,则)()(RcMc增大
【答案】D
【考
点定位】电解质强弱的判断、电离平衡移动(稀释、升温);难度为较难等级。
【名师点晴】本题了图象方法在溶液的稀释与溶液的pH的关系的知识。解图像题的要领时是:先看三点,再看增减;先看单线,再做关联。本题区分MOH和ROH的关键就是两线的起点pH。当开始时溶液的体积相同时,
稀释的倍数越大,溶液的离子浓度越小,溶液的pH就越小。稀释相同倍数时,强碱比弱碱的pH变化大。2.【2015浙江理综化学】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正..确.的是()
学习好资料欢迎下载
A.在pH=9.0时,c(NH4+)>c(HCOˉ3)>c(NH2COOˉ)>c(CO32-) B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ)
C.随着CO2的通入,c(OHˉ)c(NH3·H2O)不断增大
D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成【答案】C
【解析】A、在pH=9.0时,作直线垂直于横坐标,从图上可直接看得出:c(NH4+)>c(HCOˉ3)>c(NH2COOˉ)>c(CO32
-),A正确;B、根据电荷守恒可得:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COOˉ)+c(OHˉ),B正确;
C、c(OHˉ)c(NH3·H2O)=43244()()()()()bKcOHcNHcNHHOcNHcNH,Kb不变,c(NH4+)不断增大,则比值不断减小,C不正

1.(2021·河北真题)高分子材料在生产生活中应用广泛。下列说法错误的是
A.芦苇可用于制造黏胶纤维,其主要成分为纤维素
B.聚氯乙烯通过加聚反应制得,可用于制作不粘锅的耐热涂层
C.淀粉是相对分子质量可达几十万的天然高分子物质
D.大豆蛋白纤维是一种可降解材料
2.(2021.1·浙江真题)下列说法不正确...的是
A.甘氨酸和丙氨酸混合,在一定条件下可生成4种二肽
B.乙酸、苯甲酸、乙二酸(草酸)均不能使酸性高锰酸钾溶液褪色
C.纤维素与乙酸酐作用生成的醋酸纤维可用于生产电影胶片片基
D.工业上通常用植物油与氢气反应生产人造奶油
3.(2021·广东真题)劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 社区服务:用84消毒液对图书馆桌椅消毒 含氯消毒剂具有氧化性
B 学农活动:用厨余垃圾制肥料 厨余垃圾含N、P、K等元素
C 家务劳动:用白醋清洗水壶中的水垢 乙酸可由乙醇氧化制备
D 自主探究:以油脂为原料制肥皂 油脂可发生皂化反应
4.【2019新课标Ⅲ】化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池
B.铝合金大量用于高铁建设 专题01 化学常识 化学与生活 C.活性炭具有除异味和杀菌作用
D.碘酒可用于皮肤外用消毒
5.【2019北京】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
A.4.03米大口径碳化硅反射镜 B.2022年冬奥会聚氨酯速滑服 C.能屏蔽电磁波的碳包覆银纳米线 D.“玉兔二号”钛合金筛网轮
6.【2018新课标2卷】化学与生活密切相关。下列说法错误的是 A.碳酸钠可用于去除餐具的油污 B.漂白粉可用于生活用水的消毒 C.氢氧化铝可用于中和过多胃酸 D.碳酸钡可用于胃肠X射线造影检查 7.【2018新课标3卷】化学与生活密切相关。下列说法错误的是
A.泡沫灭火器可用于一般的起火,也适用于电器起火

第 1 页 2021全国高考化学?离子反响?专题集训
一、选择题:〔每题有1-2个选项符合题意〕
1.以下物质属于非电解质的是( )
A.NH3 B.(NH4)2SO4 C.Cl2 D.CH3COOH
2.以下各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl晶体、BaSO4 B.铜、二氧化硫
C.液态的醋酸、酒精 D.熔融的KNO3、硫酸溶液
3.某消毒液的主要成分为NaClO,还含有一定量的NaOH。以下用来解释事实的方程式中,不合理的是( )〔:饱和NaClO溶液的pH约为11〕
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH―==ClO―+Cl―+H2O
B.该消毒液的pH约为12:ClO―+H2OHClO+OH―
C.该消毒液与结厕灵〔主要成分为HCl〕混用,产生有毒Cl2:2H++Cl―+ClO―==Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO―==HClO+CH3COO-
4.以下指定反响的离子方程式正确的选项是( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C.酸性溶液中KIO3与KI反响生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O。
5.以下有关NaClO和NaCl混合溶液的表达正确的选项是( )
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反响的离子方程式为:

1 专题10 水溶液中的离子平衡
1.[2019新课标Ⅰ]NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2−的导电能力之和大于HA−的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
【答案】C
【解析】
【分析】邻苯二甲酸氢钾为二元弱酸酸式盐,溶液呈酸性,向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中离子浓度增大,导电性增强,邻苯二甲酸钾和邻苯二甲酸钠为强碱弱酸盐,邻苯二甲酸根在溶液中水解使溶液呈碱性。
【详解】A项、向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中Na+和A2—的浓度增大。由图像可知,溶液导电性增强,说明导电能力与离子浓度和种类有关,故A正确;
B项、a点和b点K+的物质的量相同,K+的物质的量浓度变化不明显,HA—转化为A2—,b点导电性强于a点,说明Na+和A2—的导电能力强于HA—,故B正确;
C项、b点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成邻苯二甲酸钾和邻苯二甲酸钠,邻苯二甲酸钾为强碱弱酸盐,A2—在溶液中水解使溶液呈碱性,溶液pH>7,故C错误;
D项、b点邻苯二甲酸氢钾溶液与氢氧化钠溶液恰好完全反应生成等物质的量的邻苯二甲酸钾和邻苯二甲酸钠,溶液中c(Na+)和c(K+)相等,c点是继续加入氢氧化钠溶液后,得到邻苯二甲酸钾、邻苯二甲酸钠、氢氧化钠的混合溶液,则溶液中c(Na+)>c(K+),由图可知,a点到b点加入氢氧化钠溶液的体积大于b点到c点加入氢氧化钠溶液的体积,则溶液中c(K+)>c(OH—),溶液中三者大小顺序为c(Na+)>c(K+)>c(OH—),故D正确。 2 故选C。

.
高考真题分类汇编(化学):专题5 离子反应
一.单选题
1.(2017•海南)能正确表达下列反应的离子方程式为( )
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3 =Al2(CO3)3↓
D.
用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-= + + H2O
2.(2017•海南)在酸性条件下,可发生如下反应: +2M3++4H2O= +Cl-+8H+ , 中M的化合价是( )
A. +4 B. +5 C. +6 D. +7
二.综合题
3.(2017•天津)(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题.
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是________.
(2)由图1和图2判断使用硫杆菌的最佳条件为________.若反应温度过高,反应速率下降,其原因是________.
. (3)方法2:在一定条件下,用H2O2氧化H2S
随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同.当n(H2O2)/n(H2S)=4时,氧化产物的分子式为________.

化学
第 1 页 共 10 页
化学
1.【2017江苏卷】下列指定反应的离子方程式正确的是
A.钠与水反应:Na +2H2ONa++2OH– + H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2OH2↑+Cl2↑+2OH–
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2+++OH–CaCO3↓+H2O
【答案】B
【名师点睛】判断指定反应的离子方程式是否正确,通常从以下几个方面进行:①从反应原理进行判断,如反应是否能够发生、反应能否生成所给产物、反应是否可逆等。②从物质存在形态进行判断,如电解质的拆分是否正确、是否正确表示了难溶物和气体等。③从守恒角度进行判断,如是否遵循电荷守恒、质量守恒、氧化还原反应中电子转移守恒等。④从反应条件进行判断,如是否标注了必要的条件,是否关注了反应物的量对参加反应的离子种类及其反应产物的影响(如本题D选项中的足量石灰水)等。⑤从反应物的组成及反应物之间的配比进行判断,如本题中C选项硫酸和氢氧化钡分别为二元酸和二元碱。
2.【2017江苏卷】常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.=1×10 −12的溶液中:K+、Na +、、
C.c(Fe2+) =1 mol·L−1的溶液中:K+、、、
D.能使甲基橙变红的溶液中:Na+、、、
【答案】B
【解析】A.Fe3+和SCN−会发生反应生成血红色的配合物,A错误;B.根据KW可以求出c(OH−)=0.1mol/L,溶液显碱性,这4种离子可以大量共存,B正确;C.Fe2+还原性较化学
第 2 页 共 10 页
化学
强,氧化性较强,两者因发生氧化还原反应而不能大量共存,C错误;D.使甲基橙变红的溶液显酸性,不能在酸性溶液中大量共存,D错误。
【名师点睛】本题考查学生对溶液中离子的性质和离子反应的实质的认识,并将其应用到具体情境中分析问题、解决问题。解题时要特别关注以下几点:①溶液中离子存在的条件,如、ClO−、OH−等只能大量存在于碱性溶液,在酸性溶液中不能大量存在;Fe3+、Al3+、等只大量存在于酸性溶液,在碱性溶液中不能大量存在;既不能大量存在于酸性溶液,也不能大量存在于强碱性溶液,在弱碱性溶液中可以大量存在。②溶液中离子的性质,如Fe2+、I−、S2−、等有较强的还原性,与强氧化性物质不能大量共存;、ClO−、Fe3+等具有较强的氧化性,与强还原性物质不能大量共存。③题干及选项中的隐蔽条件,如溶液的颜色、酸碱指示剂的变色范围等,特别强调一下,透明不一定是无色的,所有的水溶液都是澄清透明的。

1.【2017江苏卷】下列指定反应的离子方程式正确的是
A.钠与水反应:Na +2H2ONa++2OH– + H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2OH2↑+Cl2↑+2OH–
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ + BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2+++OH–CaCO3↓+H2O
【答案】B
【名师点睛】判断指定反应的离子方程式是否正确,通常从以下几个方面进行:①从反应原理进行判断,如反应是否能够发生、反应能否生成所给产物、反应是否可逆等。②从物质存在形态进行判断,如电解质的拆分是否正确、是否正确表示了难溶物和气体等。③从守恒角度进行判断,如是否遵循电荷守恒、质量守恒、氧化还原反应中电子转移守恒等。④从反应条件进行判断,如是否标注了必要的条件,是否关注了反应物的量对参加反应的离子种类及其反应产物的影响(如本题D选项中的足量石灰水)等。⑤从反应物的组成及反应物之间的配比进行判断,如本题中C选项硫酸和氢氧化钡分别为二元酸和二元碱。
2.【2017江苏卷】常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.=1×10 −12的溶液中:K+、Na +、、
C.c(Fe2+) =1 mol·L−1的溶液中:K+、、、
D.能使甲基橙变红的溶液中:Na+、、、
【答案】B
【解析】A.Fe3+和SCN−会发生反应生成血红色的配合物,A错误;B.根据KW可以求出c(OH−)=0.1mol/L,溶液显碱性,这4种离子可以大量共存,B正确;C.Fe2+还原性较强,氧化性较强,两者因发生氧化还原反应而不能大量共存,C错误;D.使甲基橙变红的溶液显酸性,不能在酸性溶液中大量共存,D错误。
【名师点睛】本题考查学生对溶液中离子的性质和离子反应的实质的认识,并将其应用到具体情境中分析问题、解决问题。解题时要特别关注以下几点:①溶液中离子存在的条件,如、ClO−、OH−等只能大量存在于碱性溶液,在酸性溶液中不能大量存在;Fe3+、Al3+、等只大量存在于酸性溶液,在碱性溶液中不能大量存在;既不能大量存在于酸性溶液,也不能大量存在于强碱性溶液,在弱碱性溶液中可以大量存在。②溶液中离子的性质,如Fe2+、I−、S2−、等有较强的还原性,与强氧化性物质不能大量共存;、ClO−、Fe3+等具有较强的氧化性,与强还原性物质不能大量共存。③题干及选项中的隐蔽条件,如溶液的颜色、酸碱指示剂的变色范围等,特别强调一下,透明不一定是无色的,所有的水溶液都是澄清透明的。

1 / 6 2012年高考化学试题分类解析汇编:离子共存 离子反应
1.[·江苏化学卷3]常温下,下列各组离子在制定溶液中一定能大量共存的是
A.0.1 mol·L-1的NaOH溶液:K+、Na+、SO42-、CO32-
B.0.1 mol·L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C.0.1 mol·L-1FeCl3溶液:K+、NH4+、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
A 解析:本题以溶液中离子共存的方式考查学生对Fe3+的氧化性、其硫氰酸盐的难电离性、碘离子的还原性、碳酸钡的难溶性、次氯酸的弱酸性及难电离性等相关知识的理解程度,考查学生综合运用所学化学知识解决相关化学问题的能力。
2.[·江苏化学卷9]下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I 2+6OH-
B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++6OH-NH3↑+H2O
C.将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++3NO3-=Ag++NO↑+H2O
C 解析:本题是基本概念中离子方程式判断正误的考查,选题以元素化合物基础和生活内容为背景。
A.一定要注意酸性溶液中不能出现OH-。
B.NH4HCO3溶液HCO3-也能与NaOH反应。
C.过量二氧化硫气体入冷氨水只能酸式盐。
D.得失电子不守恒。
【备考提示】高考常设置的错误形式有:离子反应不符合客观事实;各物质化学式拆分错误;不符合“三个守恒”(质量、电荷、电子);不符合有机物官能团性质;反应环境与产物的矛盾;改写是否正确(注意区别胶体与沉淀);隐含的反应是否遗漏(生成物与反应物不共存、隐含的氧化性物质等);方程式与所给的“量”的条件是否切合“过量”,“适量”,“足量”,“少量”等
专题03 离子反应
1.[2019新课标Ⅱ]下列化学方程式中,不能正确表达反应颜色变化的是
A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4Cu+ZnSO4
B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2CaCO3↓+H2O
C.Na2O2在空气中放置后由淡黄色变为白色:2Na2O22Na2O+O2↑
D.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl32Fe(OH)3+3MgCl2
【答案】C
【解析】A.金属活动性顺序:Zn>Cu,则向硫酸铜溶液中加入足量锌粉,会发生置换反应,其反应的方程式为:Zn+CuSO4=ZnSO4+Cu,使溶液的蓝色消失,A项正确;
B. 澄清石灰水久置以后会与空气中的二氧化碳反应而生产碳酸钙白色沉淀,其反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,B项正确;
C. 过氧化钠在空气中放置,会与空气中的水蒸气及二氧化碳发生反应,最终生成白色且稳定的碳酸钠,涉及的转化关系有:Na2O2→NaOH→Na2CO3·10H2O→Na2CO3,C项错误;
D.向氢氧化镁悬浊液中滴加足量氯化铁溶液,会发生沉淀的转化,化学方程式为:3Mg(OH)2 +
2FeCl3= 2Fe(OH)3+ 3MgCl2,D项正确;
答案选C。
2.[2019新课标Ⅲ]离子交换法净化水过程如图所示。下列说法中错误的是
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的3NO 、24SO、Cl−通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低 D.阴离子树脂填充段存在反应H++OH−H2O
【答案】A
【解析】离子交换树脂净化水的原理是:当含有Na+、Ca2+、Mg2+等阳离子及SO42-、Cl-、NO3-等阴离子的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交换的阳离子H+则被交换到水中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水再通过阴离子交换树脂时,水中的阴离子也为树脂所吸附,树脂上可交换的阴离子OH-也被交换到水中,同时与水中的H+离子结合成水,则
高考热点专题训练--离子反应、离子方程式
(五年高考真题精练)
考点1 离子方程式正误判断
解此类题应该注意以下几个方面的问题:
一、离子方程式书写原则:即“分离原则”确定准哪些写成离子式,哪些写成化学式。
1、强酸、强碱和易溶于水的盐改写成离子形式,难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式。
例1.氢氧化铁与盐酸反应OH-+H+=H2O (错) 应为:
例2.石灰石与盐酸反应CO32-+2H+=CO2↑+H2O 错) 应为:
例3.纯碱与醋酸反应CO32-+2H+=CO2↑+H2O (错) 应为:
2、微溶物作为反应物,若是澄清溶液写离子符号,若是悬浊液写化学式。微溶物作为生成物,一般写化学式(标↓号),如石灰水和石灰乳石灰水写成离子式而石灰乳则写化学式。
3、氨水作反应物写NH3·H2O;作生成物,若有加热条件或浓度很大时,可写NH3 (标↑号)。
4、固体之间反应不能写离子方程式,如氯化铵与氢氧化钙的反应;浓H2SO4与固体反应不能写离子方程式。
例:氯化钠固体和浓硫酸加强热制氯化氨 H++Cl-强热HCl↑(错)应为:
5、可溶性多元弱酸酸式盐的酸式根一律保留酸式根的形式,如NaHCO3溶液中应拆成Na+和HCO3- (NaHSO4溶液中应拆成Na+ 和H+ 和SO4- )
6、正确把握与“量”有关的反应原则
①CO2和Ca(OH)2按不同比例的反应(酸性氧化物与碱):
②FeBr2+Cl2按不同比例反应(两种或两种以上离子被一种物质氧化或还原):
③NaHCO3+ Ca(OH)2按不同比例的反应(酸式盐与碱):
④Ba(OH)2与KAl(SO4)2按不同比例的反应:
专题03 离子反应
1.[2019新课标Ⅱ]下列化学方程式中,不能正确表达反应颜色变化的是
A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4Cu+ZnSO4
B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2CaCO3↓+H2O
C.Na2O2在空气中放置后由淡黄色变为白色:2Na2O22Na2O+O2↑
D.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl32Fe(OH)3+3MgCl2
【答案】C
【解析】A.金属活动性顺序:Zn>Cu,则向硫酸铜溶液中加入足量锌粉,会发生置换反应,其反应的方程式为:Zn+CuSO4=ZnSO4+Cu,使溶液的蓝色消失,A项正确;
B. 澄清石灰水久置以后会与空气中的二氧化碳反应而生产碳酸钙白色沉淀,其反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,B项正确;
C. 过氧化钠在空气中放置,会与空气中的水蒸气及二氧化碳发生反应,最终生成白色且稳定的碳酸钠,涉及的转化关系有:Na2O2→NaOH→Na2CO3·10H2O→Na2CO3,C项错误;
D.向氢氧化镁悬浊液中滴加足量氯化铁溶液,会发生沉淀的转化,化学方程式为:3Mg(OH)2 + 2FeCl3=
2Fe(OH)3+ 3MgCl2,D项正确;
答案选C。
2.[2019新课标Ⅲ]离子交换法净化水过程如图所示。下列说法中错误的是
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的3NO 、24SO、Cl−通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH−H2O
【答案】A
【解析】离子交换树脂净化水的原理是:当含有Na+、Ca2+、Mg2+等阳离子及SO42-、Cl-、NO3-等阴离子的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交换的阳离子H+则被交换到水中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水再通过阴离子交换树脂时,水中的阴离子也为树脂所吸附,树脂上可交换的阴离子OH-也被交换到水中,同时与水中的H+离子结合成水,则
2014年普通高等学校招生全国统一考试化学试题分类汇编
专题十一 水溶液中的离子平衡
1.(2014·重庆理综化学卷,T3)下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2
D.25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
【答案】D
【解析】A、浓氨水和FeCl3溶液反应产生Fe(OH)3沉淀,不会产生胶体,A错误;B、加入浓盐酸,使平衡CH3COO-+H+CH3COOH向正方向移动,()c3CHCOO减小;C、反应的化学方程式为Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O,C错误;D、Cu(OH)2的沉淀溶解平衡的方程式为Cu(OH)2Cu2++2OH-,在Cu(NO3)2中,会使平衡向逆方向移动,导致溶解度减小,D正确。
2.(2014·浙江理综化学卷,T12)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O HClO + H+ +Cl- K2=10-3.4
HClO H+ + ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是
A.Cl2(g)+ H2O 2H+ + ClO- + Cl- K=10-10.9
B.在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
2009-2013年高考化学试题分类解析汇编:离子共存 离子反应
(2013大纲卷)11、能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H20+SO22NH4++SO32-+H2O
B.氯化钠与浓硫酸混合加热:H2SO4+2Cl-SO2↑+Cl2↑+H2O
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-3Fe3++NO↑+3H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-2BaSO4↓+Al(OH)3↓
【答案】 A
【解析】B错在不是离子反应;C错在磁性氧化铁不能拆写;D错在此时氢氧根过量(不是2:3,而是2:4)溶液中会有偏铝酸根,不是沉淀。
[2013高考∙重庆卷∙1]在水溶液中能大量共存的一组离子是
A.Na+、Ba2+、Cl—、NO3— B.Pb2+、Hg2+、S2—、SO42—
C.NH4+、H+、S2O32—、PO43— D.Ca2+、Al3+、Br—、CO32—
答案:A
【解析】Na+、Ba2+、Cl-、NO3-离子间不能发生反应,在同一溶液中可以大量共存,A项正确;Pb2+与SO42-可生成PbSO4沉淀、Pb2+、Hg2+可与S2-形成沉淀,B项错误;H+与S2O32-在溶液中发生歧化反应生成S与SO2,C项错误;Ca2+可与CO32-形成CaCO3沉淀、此外Al3+与CO32-可发生双水解反应而不能共存,D项错误。
(2013安徽卷)9.下列分子或离子在指定的分散系中能大量共存的一组是
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br-
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
1.(2019·全国Ⅲ)高考化学十年真题专题汇编-离子反应离子交换法净化水过程如图所示。下列说法中错误的是
A.经过阳离子交换树脂后,水中阳离子的总数不变
B
.水中的
、、Cl−通过阳离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH−H
2O
【答案】A
【解析】本题考查离子交换法的净水原理,考查的核心素养是证据推理与模型认知。结合上
述分析及电荷守恒可知,经过阳离子交换树脂后,水中阳离子总数增多,A错误;水中的
NO3-、SO42-、Cl-被阴离子树脂吸附除去,B正确;经过净化处理后,水中的离子浓度降
低,水的导电性减弱,C正确;阳离子交换树脂吸附交换时产生的H+通过阴离子交换树
脂时与OH-反应生成H2O,离子方程式为:H++OH−H
2O,D正确。
【知识拓展】离子交换法净化水是利用离子交换树脂活性基团上具有离子交换能力的H+和
OH-与水中阳、阴离子杂质进行交换,将水中阳、阴离子杂质截留在树脂上,进入水中的
H+和OH-重新结合成水而达到纯化水的目的。凡能与阳离子起交换作用的树脂称为阳离子
交换树脂,与阴离子起交换作用的树脂称为阴离子交换树脂。2.(2019·江苏)室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1mol·L-1NaOH溶液:Na+、K+、CO32-、AlO2-
B.0.1mol·L-1FeCl
2溶液:K+、Mg2+、SO42-、MnO4-
C.0.1mol·L-1K
2CO3溶液:Na+、Ba2+、Cl-、OH-
D.0.1mol·L-1H
2SO
4溶液:K+、NH4+、NO3-、HSO3-
【答案】A
【解析】本题考查离子共存。A项,题给四种离子在碱性条件下均能大量存在,正确;B项,
MnO
4-可以氧化Fe2+,错误;C项,CO32-与Ba2+会发生反应生成BaCO3沉淀,错误;D项,
H+可以与HSO3-反应生成SO2,且酸性条件下NO
3-会氧化HSO3-生成SO42-,错误。
3.(2018·江苏卷)室温下,下列各组离子在指定溶液中能大量共存的是()
A.0.1mol·L−1KI溶液:Na+、K+、ClO−、OH−
B.0.1mol·L−1Fe
2(SO
4)
3溶液:Cu2+、NH4+、NO3−、SO42−
C.0.1mol·L−1HCl溶液:Ba2+、K+、CH3COO−、NO3−
D.0.1mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
【答案】B
【解析】A项,I-具有强还原性,ClO-具有强氧化性,I-能与ClO-发生氧化还原反应,I-与ClO-
不能大量共存;B项,在Fe2(SO
4)
3溶液中离子相互间不反应,能大量共存;C项,CH
3COO-
能与H+反应生成CH3COOH,在HCl溶液中CH
3COO-不能大量存在;D项,Mg2+、HCO3-都能
与OH-反应,Mg2+、HCO3-与OH-不能大量共存;答案选B。
4.(2017·江苏)常温下,下列各组离子在指定溶液中能大量共存的是()
A.无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B
.=1×10−12的溶液中:K+、Na+
、
、
C.c(Fe2+)=1mol·L−1的溶液中:K+
、
、
、
D.能使甲基橙变红的溶液中:Na+
、
、
、
【答案】B
【解析】A.Fe3+和SCN−会发生反应生成血红色的配合物,A错误;B.根据KW可以求出
c(OH−)=0.1mol/L,溶液显碱性,这4种离子可以大量共存,B正确;C.Fe2+
还原性较强,
氧化性较强,两者因发生氧化还原反应而不能大量共存,C错误;D.使甲基橙变红的溶液
显酸性,不能在酸性溶液中大量共存,D错误。
5.(2016·江苏)制备(NH
4)
2Fe(SO
4)
2·6H
2O的实验中,需对过滤出产品的母液(pH<1)进行处理。
室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
()
A.通入过量Cl
2:Fe2+、H+、NH4+、Cl–、SO42–
B.加入少量NaClO溶液:NH
4+、Fe2+、H+、SO42–、ClO–
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42–、OH–
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42–、Cl–、ClO–、OH–
【答案】D
【解析】A.Cl2具有强氧化性,能将Fe2+氧化为Fe3+,Fe2+不存在,错误;B.ClO-具有强氧
化性,能将Fe2+氧化为Fe3+,Fe2+不存在,错误;C.Fe2+和OH-反应生成氢氧化亚铁沉淀,
NH
4+、与OH-反应生成一水合氨,Fe2+、NH4+不存在,错误;D.组内离子可能在溶液中存
在,正确。
6.(2016·四川)下列关于离子共存或离子反应的说法正确的是()
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.Fe2+与H2O
2在酸性溶液中的反应:2Fe2++H
2O
2+2H+=2Fe3++2H
2O
D.稀硫酸和Ba(OH)
2溶液反应:H++SO
42-+Ba2++OH-=BaSO
4↓+H
2O
【答案】C
【解析】A、水溶液中MnO4-呈紫色,H+、MnO4-和Cl-发生氧化还原反应,不能大量共存,
错误;B、硅酸根离子和氢离子反应生成硅酸沉淀,不能电离共存,错误;C、满足质量守
恒、电子守恒和电荷守恒,正确;D、正确的离子方程式应为
2H++SO
42-+Ba2++2OH-=BaSO
4↓+2H
2O,错误。
7.(2015·上海)某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、
Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有()
A.3种B.4种C.5种D.6种
【答案】C
【解析】含有Fe3+的溶液显黄色,在无色溶液中不能大量存在;H+与CO32–、OH–会发生反
应,不能大量共存;OH–与NH4+、Al3+会发生反应,不能大量共存;Ba2+、Al3+、CO32–会发生反应,不能大量共存。向该溶液中加入铝粉,只放出H2,若溶液为碱性,则含有大量的
OH–。还可能含有大量的Ba2+、CO32–、Cl–、NO3–。离子最多4种;若溶液为酸性,由于H+、
NO
3–起硝酸的作用,加入Al不能产生氢气,所以含有的离子可能是:H+、NH4+、Ba2+、Al3+、
Cl–,最多是5种离子。故选项是C。
8.(2015·江苏)常温下,下列各组离子一定能在指定溶液中大量共存的是()
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B
.=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H
2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
【答案】B
【解析】A、酚酞变红色的溶液,此溶液显碱性,Al3+、OH-生成沉淀或AlO2-,不能大量共
存,故A错误;B、根据信息,此溶液中c(H+)>c(OH-),溶液显酸性,这些离子不反应,能
大量共存,故正确;C、与Al能放出氢气的,同业可能显酸性也可能显碱性,若是碱性,则
Fe2+和OH-不共存,若酸性,NO3-在酸性条件下具有强氧化性,不产生H2,故C错误;D、
水电离的c(H+)=1×10-13mol·L-1的溶液,此物质对水电离有抑制,溶液可能显酸性也可能显
碱性,AlO2-、CO32-和H+不能大量共存,故D错误。
9.(2014·山东)下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B.酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C.弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D.中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
【答案】C
【解析】A、Al3+和S2-能发生双水解反应(2Al3++3S2‾+6H
2O=2Al(OH)
3↓+3H
2S↑)而不能大量
共存,A错误;B、在酸性条件下,ClO‾具有较强的氧化性,能把I‾氧化而不能大量共存,
B错误;C项可以大量共存;D、中性溶液中,Fe3+能发生水解反应(Fe3++3H
2O==Fe(OH)
3↓
+3H+)生成Fe(OH)
3沉淀而不能大量共存,D错误。
10.(2014·江苏)25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO32-
B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3-C.0.1mol/LNH
4HCO
3溶液中:K+、Na+、NO3-、Cl-
D.0.1mol/LFeCl
3溶液中:Fe2+、NH4+、SCN-、SO42-
【答案】C
【解析】pH=1的溶液CO32-不能大量存在(CO32-+2H+=H
2O+CO
2↑),A错误;B选项中溶液
的pH值可能为1或13,pH为13时,Cu2+不能大量共存(Cu2++2OH—=Cu(OH)
2↓),错误;
C选项都能大量共存,正确;D中Fe3+与SCN-不能共存(Fe3++3SCN-=Fe(SCN)
3),错误。
11.(2013广东)水溶液中能大量共存的一组离子是()
A.Na+、Al3+、Cl-、CB.H+、Na+、Fe2+、Mn
C.K+、Ca2+、Cl-、ND.K+、N、OH-、S
【答案】C
【解析】Al3+和CO32-因发生双水解而不能共存,A错误;H+、Fe2+、MnO4-因发生氧化还原
反应不能共存,B错误;NH4+与OH—因生成弱电解质一水合氨而不能共存,D错误。答案:
C
命题意图:离子共存
12.(2013安徽)下列分子或离子在指定的分散系中能大量共存的一组是()
A.银氨溶液:Na+、K+、N、NH3·H
2OB.空气:C
2H
2、CO
2、SO
2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-D.高锰酸钾溶液:H+、Na+、S、葡萄糖分子
【答案】A
【解析】A、可以共存;B、NO易被空气中氧气氧化生成NO2,不能共存;C、氢氧化铁胶
体在酸性条件下不能共存;D、高锰酸根在酸性条件下具有强氧化性,葡萄糖具有还原性,
能发生氧化还原反应不能大量共存。
13.(2013江苏)常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.使甲基橙变红色的溶液:Mg2+、K+、S、N
B.使酚酞变红色的溶液:Na+、Cu2+、HC、N
C.0.1mol·L-1AgNO
3溶液:H+、K+、S、I-
D.0.1mol·L-1NaAlO
2溶液:H+、Na+、Cl-、S
【答案】A
【解析】本题以溶液中离子共存的方式考查学生对指示剂的颜色变化,碱性溶液中的碳酸氢
根离子、碘离子与银离子、偏铝酸根与氢离子等共存问题的理解程度,考查学生综合运用所
学化学知识解决相关化学问题的能力。