胶体的性质及应用
- 格式:ppt
- 大小:2.75 MB
- 文档页数:19


胶体得性质及其应用撰稿:顾振海责编:张立[基本目标要求]1。
掌握胶体得一些重要性质。
ﻫﻫ2.了解胶体得一些重要应用。
ﻫ3.认识物质得性质与物质得聚集状态有关。
[知识讲解]一、胶体得性质及其应用概述1.胶体得性质ﻫ(1)丁达尔效应光束通过胶体,形成光亮得“通路”得现象叫做丁达尔效应。
ﻫﻫ(2)布朗运动胶体粒子在分散剂中做不停得、无秩序得运动,这种现象叫做布朗运动。
ﻫﻫ(3)电泳现象因胶粒带电,在外加电场作用下,胶体粒子在分散剂里向电极(阴极或阳极)做定向移动得现象,叫做电泳。
胶体得电泳具有广泛得实用价值。
(1)研发纳米材料。
2。
胶体得应用ﻫﻫ(2)检验或治疗疾病。
ﻫﻫ(3)土壤胶体、制作食物等。
3.胶体得聚沉ﻫ胶体受热或加入电解质或加入带相反电荷胶粒得胶体使胶体粒子聚集成较大颗粒从分散剂里析出得过程叫胶体得聚沉。
二、胶体得性质1。
丁达尔效应(胶体得光学性质)(1)产生丁达尔效应,就是因为胶体分散质得粒子比溶液中溶质得粒子大,能使光波发生散射(光波偏离原来方向而分散传播),而溶液分散质得粒子太小,光束通过时不会发生散射。
ﻫ(2)利用丁达尔效应可以区别溶液与胶体。
ﻫ(1)产生布朗运动现象,就是因为胶体粒子受分散剂分子2.布朗运动(胶体得动力学性质)ﻫ从各方面撞击、推动,每一瞬间合力得方向、大小不同,所以每一瞬间胶体粒子运动速度与方向都在改变,因而形成不停得、无秩序得运动.ﻫ(2)胶体粒子做布朗运动得这种性质就是胶体溶液具有稳定性得原因之一。
ﻫﻫ3。
电泳现象(胶体得电学性质)ﻫ(1)产生电泳现象,就是因为胶体得粒子就是带电得粒子,所以在电场得作用下,发生了定向运动。
ﻫﻫ(2)电泳现象证明了胶体得粒子带有电荷;同一种胶体粒子带有相同得电荷,彼此相互排斥,这就是胶体稳定得一个主要原因。
ﻫﻫ(3)胶体粒子带有电荷,一般说来,就是由于胶体粒子具有相对较大得表面积,能吸附离子等原因引起得.ﻫ(4)某些胶体粒子所带电荷情况:注意:ﻫ①AgI胶体粒子在I—过量时,AgI吸附I—而带负电荷;Ag+过量时,AgI吸附Ag+而带正电荷。

高一化学胶体的知识点归纳在高一化学学习中,胶体是一个重要的知识点。
胶体是指由两种或多种物质组成的混合体系,其中一种物质以微小颗粒的形式悬浮在另一种物质中。
下面将对胶体的定义、性质以及应用进行归纳总结。
一、胶体的定义胶体是介于溶液与悬浮液之间的一种混合体系。
它的特点是悬浮的微粒大于分子,但又小于机械混合物的粒径。
胶体的形成是由于相互作用力的存在导致溶质不能完全溶解于溶剂中,而形成微小颗粒悬浮在溶剂中,形成胶体。
二、胶体的性质1. 可见性:胶体的微粒大小在10-9到10-6m之间,透过显微镜可以观察到。
2. 不稳定性:胶体由于微粒之间存在相互作用力,导致胶体不稳定,容易发生凝聚和沉淀现象。
3. 混浊性:胶体在光线的照射下呈现混浊状态,散射光使得胶体呈现浑浊的外观。
4. 过滤性:胶体可以通过一次普通滤纸进行过滤,不通过超微滤膜。
三、胶体的分类根据胶体的组成和性质,胶体可以分为溶胶、凝胶和胶体溶液三类。
1. 溶胶:溶胶是指胶体中溶质颗粒多分散且呈无定形结构的胶体,如烟雾、煤粉等。
2. 凝胶:凝胶是指胶体中溶质颗粒呈现有规律的立体结构的胶体,如明胶等。
3. 胶体溶液:胶体溶液是指胶体中溶质颗粒保持在溶液中的胶体,如乳液、胶束等。
四、胶体的应用1. 工业上的应用:胶体在工业生产中有广泛的应用,例如纺织、造纸、涂料、医药等行业中常用的乳液和胶束都是胶体的应用。
2. 日常生活中的应用:胶体在日常生活中也有一些重要的应用,如牙膏、洗洁精等产品中的凝胶胶体,以及乳化液体、奶粉等产品都是胶体的应用。
3. 环境保护中的应用:胶体的特性使其在环境保护方面具有重要作用,如胶束能够帮助清洁污染物,减少环境污染。
总结:高一化学中胶体的知识点主要包括胶体的定义、性质、分类以及应用。
胶体是由两种或多种物质组成的混合体系,具有可见性、不稳定性、混浊性以及过滤性等特点。
根据组成和性质的不同,胶体可以分为溶胶、凝胶和胶体溶液三类。
胶体在工业生产、日常生活以及环境保护中都有广泛的应用。





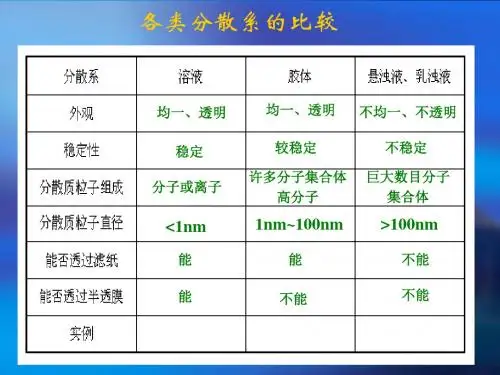
胶体的性质与应用胶体的性质与应用河北省宣化县第一中学栾春武一、胶体的性质不同分散系分散质粒子的大小不同,胶体微粒分散质的直径(1—100nm)在溶液(<1 nm)和浊液(>100nm)之间,利用丁达尔效应可区分溶液和胶体。
胶体之所以能够稳定存在,其主要原因是同种胶体粒子带同种电荷,胶粒相互排斥,胶粒间无法聚集成大颗粒沉淀从分散剂中析出。
次要原因是胶粒小质量轻,不停地作布朗运动,能克服重力引起的沉降作用。
一般来说,金属氢氧化物、金属氧化物的胶体粒子带正电荷,如Fe(OH)3胶体、Al(OH)3胶体、AgX胶体(AgNO3过量)等;非金属氧化物、金属硫化物的胶体粒子带负电荷,如硅酸胶体、土壤胶体、As2S3胶体等。
胶体粒子可以带电荷,但整个胶体一定呈电中性。
胶粒是否带电荷,这取决于胶粒本身的性质,如可溶性淀粉溶于热水制成胶体,具有胶体的性质,但胶体中的分散质为高分子化合物的单个分子,不带有电荷,因而也无电泳现象。
胶体聚沉的方法有:①加电解质溶液;②加与胶粒带相反电荷的另一种胶体;③长时间加热等。
胶体有广泛的应用:可以改进材料的机械性能或光学性能,如有色玻璃;在医学上可以诊疗疾病,如血液透析;农业上用作土壤的保肥;在日常生活中的明矾净水、制豆腐;还可以解释一些自然现象如:江河入海口易形成三角洲等。
胶体的聚沉与蛋白质的盐析:胶体的聚沉是指胶体在适当的条件下,(破坏胶体稳定的因素)聚集成较大颗粒而沉降下来,它是憎液胶体的性质,即胶体的凝聚是不可逆的。
盐析是指高分子溶液(即亲液胶体)中加入浓的无机轻金属盐使高分子从溶液中析出的过程,它是高分子溶液或普通溶液的性质,盐析是因为加入较多量的盐会破坏溶解在水里的高分子周围的水膜,减弱高分子与分散剂间的相互作用,使高分子溶解度减小而析出。
发生盐析的分散质都是易容的,所以盐析是可逆的。
由此可见胶体的聚沉与蛋白质的盐析有着本质的区别。
二、例题分析【例题1】已知有三种溶液:FeCl3的溶液、Na2SiO3溶液、盐酸,现有下列说法:①将FeCl3滴入冷水中,边滴边振荡,便可得FeCl3胶体;②在稀盐酸中滴加硅酸钠可制的胶体,胶体粒子直径大小在1~100nm之间;③用光照射硅酸胶体时,胶体粒子会使光发生散射;④FeCl3溶液和Fe(OH)3胶体都能透过滤纸;⑤胶体、溶液和浊液属于不同的分散系,其中胶体最稳定;⑥常温下,pH=2的FeCl3的溶液和pH=2的盐酸中由水电离出的氢离子浓度之比为1010: 1,其中正确的是A.①④⑥B.②③⑤C.②③④⑥D.①②③④⑤⑥解析:制备Fe(OH)3胶体是将FeCl3的浓溶液(或饱和FeCl3溶液)滴入沸水中,①错误;胶体粒子直径大小介于1~100 nm之间,②正确;丁达尔效应是胶体具有的性质之一,是由于胶体粒子使光发生散射形成的,是鉴别溶液和胶体的一种常用物理方法,③正确;溶液和胶体都能透过滤纸,④正确;溶液是最稳定的分散系,⑤错误;强酸弱碱盐溶液中水电离出的氢离子的浓度等于溶液中氢离子的浓度,酸溶液中水电离出的氢离子浓度等于溶液中的氢氧根离子的浓度,分别为10-2、10-12;⑥正确。

2023年高三化学教案胶体的性质及其应用(精选3篇)教案一:胶体的性质及其应用(概述)教学目标:1.了解胶体的定义和基本特征。
2.掌握胶体的稳定性及其影响因素。
3.了解胶体的应用领域。
教学准备:教师准备PPT、实验演示等教学工具。
教学过程:一、引入(5分钟)教师通过提问和展示实物,引导学生了解胶体的概念,并与溶液和悬浮液进行对比。
二、胶体的定义和基本特征(15分钟)1.教师通过PPT介绍胶体的定义和特点,例如:由两种或更多种物质组成、呈现浑浊不透明的外观、粒子大小在1nm-1000nm之间等。
2.通过实验演示展示常见的胶体现象,如烟雾、乳液等。
三、胶体的稳定性及其影响因素(20分钟)1.教师介绍胶体的稳定性及其影响因素,如界面电荷、溶质浓度、温度等。
2.通过实验演示展示电解质对胶体稳定性的影响,引导学生思考原因。
四、胶体的应用领域(15分钟)1.教师介绍胶体在日常生活中的应用,如牙膏、墨水、乳化剂等。
2.引导学生探索胶体在科技领域中的应用,如纳米材料、生物传感器等。
五、小结与拓展(5分钟)教师对本节课内容进行小结,并引导学生进一步探索胶体的应用领域。
教案二:胶体的性质及其应用(稳定性)教学目标:1.了解胶体的定义和基本特征。
2.掌握胶体的稳定性及其影响因素。
3.能够应用所学知识解释和探究胶体的稳定机制。
教学准备:教师准备PPT、实验装置及材料。
教学过程:一、引入(5分钟)教师通过提问复习上节课所学内容,引导学生回忆胶体的概念和基本特征。
二、胶体的稳定性及其影响因素(20分钟)1.教师通过PPT介绍胶体的稳定性及其影响因素,如界面电荷、溶质浓度、温度等。
2.通过实验演示展示电解质对胶体稳定性的影响,引导学生思考原因。
三、抑制胶体沉析的方法(10分钟)1.教师介绍常用的抑制胶体沉析的方法,如加入电解质、调节pH值、加入表面活性剂等。
2.通过实验演示展示这些方法的效果,并让学生归纳总结。
四、实验探究胶体稳定性(20分钟)1.教师根据实验情况设计实验,让学生通过调节条件来观察胶体的稳定性变化。

胶体的性质及其应用一.疏散系1.疏散系:一种(或几种)物资以粒子情势疏散到另一种物资里所形成的混杂物.疏散质:被疏散成粒子的物资(一般量少)2.疏散系构成疏散剂:粒子疏散在个中的物资(一般量多)物资与水混应时,一般以为是疏散剂.3.疏散系分类: . () . .溶液悬浊液胶体疏散系粒子直径外不雅粒子构成可否透过半透膜可否透过滤纸提问:若何提纯胶体,例:若何除去Fe(OH)3胶体混有少量的氯化铁和氯化氢?二.胶体胶体的本质特点:是疏散质粒子直径在~之间(可透过滤纸,不克不及透过半透膜)(一)胶体的性质1. 丁达尔现象(光学性质)试验:用激光笔垂直照耀淀粉胶体,胶体,溶液.现象:胶体内部消失一条光路而溶液没有.结论:这种因为胶体微粒对光的散射感化形成的一条光明的通道的现象叫丁达尔现象.解释:应用此性质可对溶液和胶体进行区分.例子:尘土,提问:可否说一种液体只要有丁达尔效应,就是胶体?2. 布朗活动(动力学性质)引入:胶粒较小而轻,它在水中的活动情形若何试验:将一滴液体放在水中不雅察现象:胶体集中解释:胶粒在不合偏向受到了水分子撞击的力气大小不合,所以活动偏向在每一刹时都在转变,因而形成无秩序的不断的活动,这种现象叫布朗活动.例子:花粉放于水中.空气中的尘土.粉笔灰放于水中3. 电泳(电学性质)试验:将胶体放在U形管中,一端加导电现象:阴极邻近色彩加深剖析:阴极邻近色彩加深→胶粒带正电荷在电场感化下向阴极移动→胶体直径小→概况积大→吸附才能强→只吸附阳离子,因而带正电荷.结论:电泳:在电场感化下,胶体的微粒在疏散剂里向阴极或阳极作定向移动的现象叫电泳.< 胶粒带电的一般纪律 >A. 带正电的胶粒:金属氧化物.金属氢氧化物FeO(与陶土的分别).Fe(OH)3.Al(OH)3B. 带负电的胶粒:金属硫化物.非金属氧化物.硅酸及泥土陶土.H2SiO3.硫化砷胶粒提问:1.Fe(OH)3胶体带电荷,这一说法对不合错误,为什么?2.是不是所有胶体都产生电泳?即所有的胶粒都带电荷?(二)胶体的聚沉1. 胶体稳固消失的原因:(1)胶粒小,可被溶剂分子冲击不断地活动,不轻易下沉或上浮(2)胶粒带同性电荷,同性排挤,不轻易聚大,因而不下沉或上浮2. 要使胶粒聚沉可采取的办法:(1)加热法:温度升高,胶粒碰撞速度加速,从而使小颗粒成为大颗粒而凝集.例子:制取Fe(OH)3胶体时,强调加热至变红褐色停滞.假如加热过度,则有什么后果?大家是否还记得,所制取得到的胶体(2)加电解质法:中和胶粒所带电荷,使之聚成大颗粒.胶粒带正电,所加电解质中阴离子所带负电荷越高,阴离子浓度越大,凝集后果越显著.血液胶体带负电胶粒带负电,所加电解质中阳离子所带正电荷愈高.阳离子浓度愈大,凝集后果越显著..(3)参加带异性电荷胶粒的胶体:互相中和电性,减小同种电性的互相排挤而使之聚成大颗粒.(三)罕有的胶体1.水解产品:Fe(OH)3胶体.Al(OH)3胶体(清水道理).H2SiO3(Na2SiO3的水解)许多水解形成沉淀的离子的水溶液,假如少量水解则形成胶体如Fe2+.Cu2+等2.高分子材料形成的溶液:蛋白质溶液.淀粉溶液.豆乳.牛奶.血液.聚乙烯溶于某有机溶剂等3.纳米材料疏散与水中,为什么?4.水泥.云.雾.烟.有色玻璃.番笕水.墨水江河之水,天然水中除海水.地下水不是胶体外,多为胶体.在江河入海口处与海水相遇时,产生凝集而形成三角洲.(四)胶体的应用1. 卤水滴豆腐将盐卤()或石膏()溶液参加豆乳中,使豆腐中的蛋白质和水等物资一路凝集形成凝胶.提问:用氯化钠行不?2. 硅胶的制备含水4%的叫硅胶3. 河海交代处易形成沙洲4. 明矾清水.铝离子.铁离子清水5. 用统一钢笔灌不合商标墨水易产生堵塞FeCl溶液用于伤口止血6.310泥土胶体中离子的吸赞同交流进程,保肥感化演习1.不克不及用有关胶体的不雅点解释的现象是()A.在江河入海处易形成三角洲3溶液中滴入同浓度NaI溶液,看不到黄色沉淀C.在NaF溶液中滴入AgNO3溶液看不到沉淀D.统一钢笔同时应用不合商标的墨水易产生堵塞2.下列各类场合,不涉及应用胶体性质的是()A.番笕工业中的“盐析” B.水泥遇水会硬C.泥土中施用含NH4+.K+的肥料不轻易流掉,而含尿素.NO3-的肥料易随水流掉D.污浊河水经静止或过滤后就澄清了3.电泳试验发明,硫化砷胶粒朝阳极移动,下列不克不及使硫化砷胶体聚沉的措施是()A. 参加A l2(SO4)3溶液B. 参加硅酸胶体C.加热D. 参加Fe(OH)3胶体4.下列关于Fe(OH)3胶体的说法中不准确的是()A.Fe(OH)3胶体与硅酸溶胶混杂将产生聚沉现象B.Fe(OH)3胶体粒子在电场影响下将朝阳极移动C.液溶胶中Fe(OH)3胶体粒子不断地做布朗活动D.光线经由过程Fe(OH)3溶胶时会产生丁达尔效应6.用Cu(OH)2胶体作电泳试验时,阴极邻近蓝色加深,往胶体是参加下列物资时,不产生聚沉的是A.海水B.静置后的泥水C.氢氧化铁胶体D.葡萄糖溶液7.下列可有雷同的办法除去混有的杂质的是()A. 淀粉溶液中混有少量NaCl杂质;蔗糖中混有少量NaCl杂质B. Fe(OH)3胶体中混有少量盐酸;淀粉溶液中混有少量KIC. Na2CO3中混有少量NaHCO3;NaHCO3中混有少量Na2CO3D. 铁粉中混有少量硫粉;碘中混有少量NaCl8.下列属于物理变更的是()A.蛋白质的盐析B.布朗活动C.碱液去油污D.白磷和红磷互变9.下列关于胶体的论述不准确的是 ( )A.布朗活动是胶体粒子特有的活动方法,可以据此把胶体和溶液.悬浊液差别开来B.光线透过胶体时,胶体产生丁达尔效应C.用渗析的办法净化胶体时,应用的半透膜只能让较小的分子.离子经由过程D.胶体粒子具有较大的概况积,能吸附阳离子或阴离子,故在电场感化下会产生电泳现象10.某浅黄色胶体作电泳试验时,阴极邻近的色彩变浅.向该胶体参加下列物资,能产生聚沉现象的是()(A)MgSO4 (B)Fe(OH)3胶体(C)CCl4(D)H2SiO3胶体11.粘土胶体溶液中,粘土粒子带负电,为了使粘土粒子凝集,下列物资顶用量起码但最有用的电解质是()(A)Na3PO4(B)A12(SO4)3(C)BaCl2(D)K2SO412.胶体差别于其它疏散系最本质的特点是()A.胶体微粒能产生电泳B.胶体微粒的大小在1nm ——100nm之间C.胶体微粒带有电荷D.胶体有丁达尔现象13.鄙人列横线上填写适合的分别办法淀粉液中含有泥沙淀粉中含少量食盐KNO3晶体中含有少量食盐 NaC 晶体中含有少量KNO3 —————————————乙醚中混有甲苯食盐水中含少量溴14.在Fe(OH)3胶体溶液中,逐滴参加HI稀溶液,会消失一系列变更.(1)先消失红褐色沉淀,原因是___________.(2)随后沉淀消融,溶液呈黄色,写出此反响的离子方程式___________.(3)最后溶液色彩加深,原因是___________,此反响的离子方程式是___________.(4)用稀盐酸代替HI稀溶液,能消失上述哪些雷同的变更现象?___________.【典范例题】[例1] 将某溶液逐滴参加溶胶内,开端时产生沉淀,持续滴加时沉淀又消融,该溶液是()A. 溶液B.溶液C. 溶液D. 硅酸溶胶[例2] 下列事实与胶体性质无关的是()A. 在豆乳里参加盐卤做豆腐B. 河道入海处易形成沙洲C. 一束平行光线照耀蛋白质溶液时,从正面可看到光明的通路D. 三氯化铁溶液中滴入氢氧化钠溶液消失红褐色沉淀【模仿试题】1. 已知泥土胶体带负电荷,是以在水稻田中,施用含氮量雷同的下列化肥时,肥效较差的是()A. 硫铵B. 碳铵C. 硝铵D. 氯化铵2. 已知由溶液和稍过量的KI溶液制得溶胶,当它跟溶胶混应时,便析出和的混杂沉淀.由此可知()A. 该胶粒带正电荷B. 该胶粒电泳时朝阳极移动C. 该胶粒带负电荷D. 胶粒电泳时朝阳极移动3. 试验室制取胶体的办法是 .用证实胶体已经制成;用办法可精制胶体;用办法可证实胶体与已完整分别.4. 现有如下试验A. 将1g参加滚水中B. 将可溶性淀粉参加水中,充分搅拌消融C. 将白磷参加中振荡D. 将溶液滴入溶液中E. 将植物油参加到水中F. 将乙酸参加水中上述所得疏散系中属于溶液的是,属胶体的是 ,属浊液的是 .5. 在陶瓷工业上,常碰到因陶土中混有而影响产品德量,可把这些陶土与水一路搅拌,使微粒直径处于~之间,拔出两根电极,接通直接电,这时阳极集合,阴极集合来由是 .。