2012安徽理综化学试题学生版
- 格式:docx
- 大小:122.89 KB
- 文档页数:5

2012年普通高等学校招生全国统一考试(安徽卷)理综综合第Ⅰ卷(选择题共120分)本卷共20小题,每小题6分,共120分。
在每小题给出的四个选项中,只有一项是生命题目要求的。
以下数据可供起解题参考:相对原子质量(原子量):H 1 C 12 O 16 S 32 Pb 2071.某同学以新鲜洋葱磷片叶内表皮为材料,经不同处理和染色齐染色,用高倍显微镜观察。
下列描述正确的是A.经吡罗红甲基绿染色,可观察到红色的细胞核B.经吡罗红甲基绿染色,可观察到绿色的细胞质C.经健那绿染色,可观察到蓝绿色颗粒状的线粒体D.经苏丹Ⅲ染色,可观察到橘黄色颗粒状的蛋白质2. 蛙的神经远内、外Na+浓度分别是15mmol/L和120mmol/L。
在腊电位由内负外正转变为内正外负过程中有Na+流入细胞,膜电位恢复过程中有Na+排出细胞。
下列判断正确的是A.Na+流入是被动运输,排出是主动运输B.Na+流入是主动运输,排出是被动运输C.Na+流入和排出都是被动运输D.Na+流入和排出都是主动运输3.脊椎动物在胚胎发育中产生了过量的运动神经元,它们竞争肌细胞所分泌的神经生长因子,只有接受了足够量神经生长因子的神经元才能生存,并与靶细胞建立连接其他的则发生凋亡。
下列叙述正确的是A.脊椎动物细胞凋亡仅发生在胚胎发育时期B.一个存活的神经元只与一个靶细胞建立连接C.神经元凋亡是不受环境影响的细胞编程性死亡D.神经元凋亡是由基因控制的,自动的细胞死亡4.假若某植物种群足够大,可以随机交配,没有迁入和迁出,基因不产生突变。
抗病基因R 对感病基因r为完全显性。
现种群中感病植株rr占1/9,抗病植株RR和Rr各占4/9,抗病植株可以正常开花和结实,而感病植株在开花前全部死亡。
则子一代中感病植株占A 、1/9B 、1/16C 、4/81D 、1/85.图示细胞内某些重要物质的合成过程,该过程发生在A .真核细胞内,一个mRNA 分子上结合多个核糖体同时合成多条肽链B .原核细胞内,转录促使mRNA 在核糖体上移动以便合成肽链C .原核细胞内,转录还未结束便启动遗传信息的翻译D .真核细胞内,转录的同时核糖体进入细胞核启动遗传信息的翻译6.留树保鲜是通过延迟采收保持果实品质的一项技术。

2012年安徽省普通高中学业水平测试科学基础(化学部分)本试卷分为第I 卷和第II 卷两部分。
第I 卷共8页,为选择题;第II 卷共4页,为非选择题。
全卷共50题,满分为150分,其中物理、化学和生物各50分。
考试时间120分钟。
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56第I 卷(选择题 共80分)注意事项:1.答题前,请先将自己的姓名、座位号用钢笔或圆珠笔填写在答题卡上,并用2B 铅笔在答题卡规定位置上将自己的座位号、考试科目涂黑。
考试结束时,将试卷和答题卡一并交回。
2.第I 卷每小题选出答案后,用2B 铅笔把答题卡上与该题对应的答案编号涂黑,如需改动,要用橡皮茶干净后,再选涂其他答案。
请注意保持答题卡整洁,不能折叠。
答案不能写在试卷上。
3.第I 卷共40小题,第1~15题为生物试题,第16~30题为化学试题,第31~40题为物理试题。
选择题(包括40小题,每小题2分,共80分。
在每小题给出的四个选项中,只有一项是符合题目要求的,错选、多选不给分。
)16. 神州八号与天宫一号的成功对接与分离,标志着我国航天工业发展进入了新阶段。
下列选项中的描述与化学研究领域无关的是 A.燃料燃烧为神州八号升空提供动力 B.与地面指挥中心联系的无线电通讯 C.宇航服使用的合成纤维等新材料D.太空舱中利用NiFeO 4传化呼出的废气17. 原子序数为94的钚(Pu 23994)是一种具有放射性的核素,下列关于Pu 23994的说法中正确的是A.中子数是94B.核外电子数239C.质子数是145D.质量数是23918. “纳米材料”是指粒子直径在1nm~100nm 的材料。
如将纳米材料分散到液体分散剂中,所得混合物的叙述正确的是A.能产生丁达尔效应B.是无色透明的溶液C.不能透过滤纸D.是悬浊液或乳浊液 19.下列操作或装置正确的是A.转移液体B.收集氨气C.固液分离D.量取液体20. 分类法是研究和学习化学的一种常用方法。

理科综合能力测试试卷 第1页(共46页)理科综合能力测试试卷 第2页(共46页)绝密★启用前2012年普通高等学校招生全国统一考试(安徽卷)理科综合能力测试本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷第1页至第5页,第Ⅱ卷第6页至第14页。
全卷满分300分。
考生注意事项:1. 答题前,务必在试题卷、答题卡规定的地方填写自己的姓名、座位号,并认真核对答题卡上所粘贴的条形码中的姓名、座位号与本人姓名、座位号是否一致。
务必在答题卡背面规定的地方填写姓名和座位号后两位。
2. 答第Ⅰ卷时,每小题选出答案后,用2B 铅笔把答题卡上所对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
3. 答第Ⅱ卷时,必须使用0.5毫米的黑色墨水签字笔在答题卡上....书写,要求字体工整、笔迹清晰。
作图题可先用铅笔在答题卡...的规定的位置绘出,确认后再用0.5毫米的黑色墨水签字笔描清楚。
必须在题号所指示的答题区域作答,超出答题....区域书写的答案无效,在试题卷、草稿纸上答题无效.......................。
4. 考试结束,务必将试题卷和答题卡一并上交。
可能用到的相对原子质量:H —1 C —12 O —16 S —32 Pb —207第Ⅰ卷(选择题 共120分)本卷共20小题,每小题6分,共120分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 某同学以新鲜洋葱磷片叶内表皮为材料,经不同处理和染色齐染色,用高倍显微镜观察。
下列描述正确的是( )A. 经吡罗红甲基绿染色,可观察到红色的细胞核B. 经吡罗红甲基绿染色,可观察到绿色的细胞质C. 经健那绿染色,可观察到蓝绿色颗粒状的线粒体D. 经苏丹Ⅲ染色,可观察到橘黄色颗粒状的蛋白质2. 蛙的神经远内,外+Na 浓度分别是15 mmol/L 和120 mmol/L 。
在膜电位由内负外正转变为内正外负过程中有+Na 流入细胞,膜电位恢复过程中有+Na 排出细胞。

2012年安徽高考理科综合能力测试化学试题第Ⅰ卷(选择题)本卷共20小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
以下数据可供解题是思考:相对原子质量(原子量):H 1 C 12 O 16 S 32 Pb 2077.科学家最近研究出一种安全、环保的储氢方法,其原理可表示为:NaHCO3+H2HCOONa+H2O 下列有关说法正确的是A.储氢、释氢过程均无能量变化B. NaHCO3、HCOONa均含有离子键和共价键C. 储氢过程中NaHCO3被氧化D. 释氢过程中,每消耗0.1molH2O放出2.24L的H28.下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是A.K+、Ca2+、Cl-、NO3-B. K+、Na+、Br-、SiO32-C. H+、Fe2+、SO42-、Cl2D. K+、Ag+、NH3·H2O、NO3-9.一定条件下,通过下列反应可实现燃煤烟气中硫的回收SO2 (g) +2CO (g) 2CO2 (g) +S (l) △H<0若反应在恒容得密闭容器中进行,下列有关说法正确的是A.平衡前,随着反应的进行,容器内压强始终不变B.平衡前,其它条件不变,分离出硫,正反应速率加快C.平衡前,其它条件不变,升高温度可提高SO2的转化率D.其它条件不变,使用不同催化剂,该反应的平衡常数不变11.某兴趣小组设计如下微型实验装置。
实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。
下列有关描述正确的是,闭合K1时,总反应的离子方程式为:A.断开K2H++2Cl-H2↑+Cl2↑B. 断开K2,闭合K1时,石墨电极附近溶液变红C. 断开K1,闭合K2时,铜电极上的电极反应式为:Cl2+2e-=2Cl-D. 断开K1,闭合K2时,石墨电极作正极12.氢氟酸是一种弱酸,可用来刻蚀玻璃。
已知25℃时:①HF(aq)+OH-(aq)=F-(aq)+H2O(l) △H=-67.7kJ·mol-1②H+(aq)+OH-(aq) =H2O(l) △H=-57.3kJ·mol-1在20mL0.1mol·L-1的氢氟酸中加入VmL0.1mol·L-1的NaOH溶液。
绝密★启用前2012年普通高等学校招生全国统一考试(安徽卷)理科综合能力测试(物理)第Ⅰ卷(选择题共120分)本卷共20小题,每小题6分,共120分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
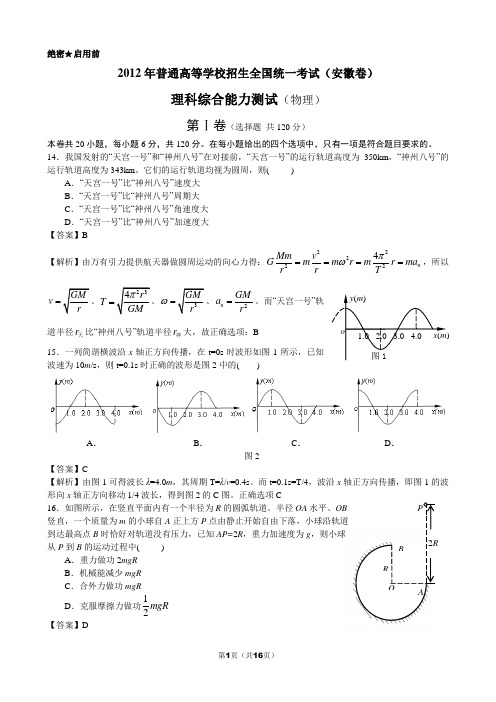
14.我国发射的“天宫一号”和“神州八号”在对接前,“天宫一号”的运行轨道高度为350km,“神州八号”的运行轨道高度为343km。
它们的运行轨道均视为圆周,则( )A.“天宫一号”比“神州八号”速度大B.“天宫一号”比“神州八号”周期大C.“天宫一号”比“神州八号”角速度大D.“天宫一号”比“神州八号”加速度大【答案】B【解析】由万有引力提供航天器做圆周运动的向心力得:222224n Mm vG m m r m r mar r Tπω====,所以v=T=ω=2nGMar=。
而“天宫一号”轨道半径r天比“神州八号”轨道半径r神大,故正确选项:B15.一列简谐横波沿x轴正方向传播,在t=0s时波形如图1所示,已知波速为10m/s,则t=0.1s时正确的波形是图2中的( )A.B.C.D.图2【答案】C【解析】由图1可得波长λ=4.0m,其周期T=λ/v=0.4s。
而t=0.1s=T/4,波沿x轴正方向传播,即图1的波形向x轴正方向移动1/4波长,得到图2的C图。
正确选项C16.如图所示,在竖直平面内有一个半径为R的圆弧轨道。
半径OA水平、OB竖直,一个质量为m的小球自A正上方P点由静止开始自由下落,小球沿轨道到达最高点B时恰好对轨道没有压力,已知AP=2R,重力加速度为g,则小球从P到B的运动过程中( )A.重力做功2mgRB.机械能减少mgRC.合外力做功mgRD.克服摩擦力做功12mgR【答案】D【解析】小球沿轨道到达最高点B 时恰好对轨道没有压力,由牛顿第二定律:2Bv mg m R=;小球从P 到B的运动过程中,由动能定理:212G f B W W mv +=。
重力做功G W mgR =,合外力做功21122B W mv mgR ==,摩擦力做的功为12f W mgR =-,即克服摩擦力做功12mgR ,机械能减少12mgR 。

第13章 热和能 比热容 海 边 沙 漠 一、比热容: 首先让我们来想一下,在我们生活中烧水的时候,水吸收的热量与水的质量、水温升高的多少有什么关系? 结论:水的质量越大,温度升高的度数越多,吸收的热量越多。
一、比热容: 比较不同物质的吸热能力: 结论:质量相同的不同物质,升高相同的温度,吸收的热量不相等。
一、比热容: 比热容:单位质量的某种物质,温度升高1℃所吸收的热量。
比热容用符号: c 表示,单位:焦/每千克摄氏度,符号:J/(kg ·℃)。
一、比热容: 几种物质的比热容:c/[J·(kg·℃) ] -
1 0.13 ×10 铅 0.9
2 ×10 砂石 0.14 ×10 水银 1.8 ×10 蓖麻油 0.39 ×10 铜 2.1 ×10 冰 0.46 ×10 铁、铜
2.1 ×10 煤油 0.84 ×10 干泥土 2.4 ×10 酒精 0.88 ×10 铝 4.2×10 水 3 3 3 3 3 3 3 3 3 3 3 3 二、热量的计算: 1、例题讲解: 二、热量的计算: 2、习题讲解: 散热器:。
2010年安徽高考理科综合一、选择题7.亚氨基羟(Li 2NH )是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li 2NH +H 2 LiNH 2+LiH 。
下列有关说法正确的是( )A.Li 2NH 中N 的化合价是1-B.该反应中H 2既是氧化剂又是还原剂C.Li +和H +的离子半径相等D.此法储氢和钢瓶储氢的原理相同8.下列实验操作或装置符合实验要求的是( )A.量取15.00 mL NaOH 溶液B.定容C.电解制Cl 2和H 2D.高温燃烧石灰石9.在pH=1的溶液中能大量共存的一组离子或分子是( )A.Na +、Mg 2+、ClO —、NO 3—B.Al 3+、 NH 4+、 Br - 、Cl -C.K + 、Cr 2O 72- 、CH 3CHO 、 SO 42-D.Na +、K + 、SiO 32-、Cl -10.低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH 3(g) + NO(g) 2N 2(g) + 3H 2O(g) ∆H <0在恒容的密闭容器中,下列有关说法正确的是( )A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大B.平衡时,其他条件不变,增加NH 3的浓度,废气中氮氧化物的转化率减小C.单位时间内消耗NO 和N 2的物质的量比为1∶2时,反应达到平衡D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大11.某固体酸燃料电池以CaHSO 4固体为电解质传递H +,其基本结构见下图,电池总反应可表示为:2H 2+O 2=2H 2O ,下列有关说法正确的是( )A.电子通过外电路从b 极流向a 极B.b 极上的电极反应式为:O 2+2H 2O +4e -=4OH -C.每转移0.1 mol 电子,消耗1.12 L 的H 2D.H +由a 极通过固体酸电解质传递到b 极12.右图是一种稀硫对Fe-Gr 合金随Cr 含量变化的腐蚀性实验结果,下列有关说法正确的是( )A.稀硫酸对Fe-Cr 合金的腐蚀性比稀硫酸和稀盐酸的弱B.稀硝酸和铁反应的化学方程式是:Fe+6HNO 3(稀)—Fe(NO 3)3+3NO 2↑+3H 2OC.Cr 含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr 合金的腐蚀性最强D.随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱13.将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计) ( )①Na2O1 ②Na2O ③Na2CO3④NaClA.①>②>③>④B.①>②>④>③C.①=②>③>④D.①=②>③=④二、非选择题25.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:元素相关信息X X的基态原子核外3个能级上有电子,且每个能级上的电子数相等Y 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积Z Z和Y同周期,Z的电负性大于YW W的一种核素的质量数为63,中子数为34(1)Y位于元素周期表第_________周期表_________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是___________________________(写化学式)。
2012年高考理综化学试题解析6.(2012·福建高考·T6)下列说法不正确...的是( )A.易燃试剂与强氧化性试剂分开放置并远离火源B.用湿润的红色石蕊试纸检验氨气C.在50mL量筒中配置0.1000mol·L-1碳酸钠溶液D.金属着火时,用细沙覆盖灭火【解析】强氧化剂都具有较强的得电子能力,遇易燃物品、有机物、还原剂等会发生剧烈化学反应引起燃烧爆炸,故A正确;氨气是碱性气体,使湿润的红色石蕊试纸变蓝,故B正确;量筒是用来量取一定体积溶液的仪器,不能用于配制溶液,配制一定物质的量浓度的溶液要在容量瓶中进行,故C错误;金属钠遇到水或二氧化碳都会发生反应生成O2,所以金属钠着火时,要用细沙覆盖灭火,故D正确。
【答案】C7.(2012·福建高考·T7)下列关于有机物的叙述正确的是A.乙醇不能发生取代反应B.C4H10有三种同分异构体C.氨基酸、淀粉均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别【解析】乙醇和乙酸发生酯化反应,酯化反应也属于取代反应,故A错;C4H10只存在两种同分异构体:正丁烷和异丁烷,故B错;氨基酸不属于高分子化合物,故C错;乙烯可以使溴的四氯化碳褪色,而甲烷不能,故D正确。
【答案】D8.(2012·福建高考·T8)短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。
下列判断不正确...的是ArrayA.最简单气态氢化物的热稳定性:R>QB.最高价氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>RD.含T的盐溶液一定显酸性【解析】由这四种元素是短周期元素,且“T所处的周期序数与族序数相等”,可知T是铝元素,则Q是硅、R是氮、W 是硫:。
非金属性N>Si,故最简单气态氢化物的热稳定性R>Q,A正确;非金属性Si<S,故最高价氧化物对应的水化物的酸性Q <W,故B正确;根据同周期和同主族原子半径的递变规律,原子半径T>Q>R,C项正确;偏铝酸钠的水溶液因水解而显碱性,故D错。
2012年安徽省初中学业水平考试化学试题注意事项:1. 本卷共三大题16小题,满分60分。
化学与物理的考试时间共120分钟。
2. 可能用到的相对原子质量:H-1C-12O-16Na-23Al-27Fe-56 Cu-64一、本大题包括10小题,每小题2分,共20分。
每小题的4个选项中只有1个符合题意,请将选出的选项序号填入题后的括号内。
1. 我省环保部门按新修订的《环境空气质量标准》,着力做好细颗粒物(PM2.5)和臭氧(O3)等新增指标的监测。
下列说法正确的是()A. 直接焚烧植物秸秆不会造成大气污染B. 吸入细颗粒物对人体健康没有危害C. 化学在环境监测和保护中起重要作用D. 臭氧(O3)是一种氧化物2. 下列几种常见的食物中,维生素含量最丰富的是()3. C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具。
在C3N4中,C 的化合价为+4,则N的化合价是()A. +5B. +3C. +1D. -34. 二甲醚(C2H6O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景。
下列有关二甲醚的说法错误..的是()A. 由C、H、O三种元素组成B. 一个分子中含有3个氢分子C. 相对分子质量为46D. 属于有机化合物5. 以色列科学家因发现准晶体独享2011年诺贝尔化学奖。
准晶体具有许多优良性能,如准晶体Al65Cu23Fe12耐磨、耐高温,可用作高温电弧喷嘴的镀层。
如图是铁元素的部分信息。
下列说法正确的是()第5题图A. Fe的原子序数为26B. Al、Cu、Fe的单质在空气中很稳定C. Al、Cu、Fe的金属活动性逐渐增强D. 该准晶体中Al、Cu、Fe的质量比为65∶23∶126. 水是宝贵的自然资源。
下列说法正确的是()A. 水在自然界中不断循环,取之不尽、用之不竭B. 水是常见的溶剂,广泛用于工农业生产C. 为了节约用水,可以用工业废水直接浇灌农田D. 自来水中只含水分子,不含其它粒子7. 下列实验操作正确的是()8. 取一滤纸条,等间距滴10滴紫色石蕊试液,然后装入玻璃管中(如图所示),两端管口同时放入分别蘸有浓氨水和浓盐酸的棉球,几秒后观察到图示现象。
2012年普通高等学校招生统一考试(新课标)理科综合能力测试试题一、选择题:本大题共13小题.每小题6分。
在每小题给出的四个选顼中,只有一项是符合题目要求的。
7.下列叙述中正确的是A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+8.下列说法中正确的是A.医用酒精的浓度通常为95%B.单质硅是将太阳能转变为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料9.用N A表示阿伏加德罗常数的值。
下列叙述中不正确的是A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 N AC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 N AD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 N A10.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构) A.5种B.6种C.7种D.8种11.已知温度T时水的离子积常数为K W。
该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A.a = b B.混合溶液的pH = 7 C.混合溶液中,c(H+) =WK mol/L D.混合溶液中,c(H+) + c(B-) = c(OH-) + c(A-)12.分析下表中各项的排布规律,按此规律排布第26项应为A.C7H16B.C7H14O2C.C8H18D.C8H18O13.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z 原子的核外内层电子数相同。
X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质。
2012安徽理综化学试题解析
7.(2012·安徽高考·T7)科学家最近研究出一种环保、安全的储氢方法,其原理可表示为: NaHCO 3+H 2
HCOONa+H 2O 下列有关说法正确的是( ) A .储氢、释氢过程均无能量变化
B .NaHCO 3、HCOONa 均含有离子键和共价键
C .储氢过程中,NaHCO 3被氧化
D .释氢过程中,每消耗0.1molH 2O 放出2.24L 的H 2 8.(2012·安徽高考·T8)下列离子或分子在溶液中能大量共存,通入CO 2后仍能大量共存的一组是( )
A .K +、Na +、Cl -、NO 3-
B .K +、Na +、Br -、SiO 32-
C .H +、Fe 2+、SO 42-、Cl 2
D .K +、Ag +、NH 3·H 2O 、NO 3-
9.(2012·安徽高考·T9)一定条件下,通过下列反应可实现燃煤烟气中硫的回收: SO 2
(g)+2CO(g)
2CO 2(g)+S(l) △H <0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( ) A .平衡前,随着反应的进行,容器内压强始终不变 B .平衡时,其他条件不变,分离出硫,正反应速率加快 C .平衡时,其他条件不变,升高温度可提高SO 2的转化率 D .其他条件不变,使用不同催化剂,该反应平衡常数不变 10.(2012·安徽高考·T10)仅用下表提供的玻璃容器(非玻璃容器任选)就能实现相应实验目的的是( ) 11.(2012·安徽高考·T11)某兴趣小组设计如下微型实验装置。
实验时,现断开K 2,闭合K 1,两极均有气泡产生;一段时间后,断开K 1,闭合K 2,发现电流表指针偏转,下列有关描述正确的是( )
催化剂
储氢
释氢
A .断开K 2,闭合K 1时,总反应的离子方程式为:2H ++2Cl -Cl 2↑+H 2↑
B .断开K 2,闭合K 1时,石墨电极附近溶液变红
C .断开K 1,闭合K 2时,铜电极上的电极反应为:Cl 2+2e -=2Cl -
D .断开K 1,闭合K 2时,石墨电极作正极
12.(2012·安徽高考·T12)氢氟酸是一种弱酸,可用来刻蚀玻璃。
已知25℃时: ①HF(aq)+OH -(aq)=F -(aq)+H 2O(l) △H =-67.7kJ·mol -1 ②H +(aq)+OH -(aq)=H 2O(l) △H =-57.3kJ·mol -1 在20mL0.1mol·L -1氢氟酸中加入VmL0.1mol·L -1NaOH 溶液,下列有关说法正确的是( ) A .氢氟酸的电离方程式及热效应可表示为: HF(aq)H +(aq) +F −(aq) △H =+10.4kJ·mol -1 B .当V =20时,溶液中:c (OH -)=c(HF) +c (H +) C .当V =20时,溶液中:c (F -)<c (Na +)=0.1mol·L -1
D .当V >0时,溶液中一定存在:c (Na +)>c (F -)>c (OH -)>c (H +) 13.(2012·安徽高考·T13)已知室温下,Al(OH)3的K sp 或溶解度远大于Fe(OH)3。
向浓度均 为0.1mol ·L -1的Fe(NO 3)3和Al(NO 3)3混合溶液中,逐滴加入NaOH 溶液。
下列示意图表 示生成Al(OH)3的物质的量与加入NaOH 溶液的体积的关系,合理的是( )
25.(2012·安徽高考·T25)(16分)X 、Y 、Z 、W 是元素周期表前四周期中的常见元素,其相关
⑴W 位于元素周期表第周期第族,其基态原子最外层有个电子。
⑵X 的电负性比Y 的(填“大”或“小”);X 和Y 的气态氢化物中,较稳定的是(写化学式)
含酚酞的饱和食盐水
K 1 K 2
石墨
直流电源
A
铜
⑶写出Z 2Y 2与XY 2反应的化学方程式,并标出电子转移的方向和数目:。
⑷在X 原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称:。
氢元素、X 、Y 的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:。
26.(2012·安徽高考·T26)(14分)PBS 是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:
(
已知: +
)
(1)A→B 的反应类型是;B 的结构简式是。
(2)C 中含有的官能团名称是;D 的名称(系统命名)是。
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和
1个羟基,但不含-O-O-键。
半方酸的结构简式是。
(4)由D 和
B 合成PBS 的化学方程式是。
(5)下列关于A 的说法正确的是。
a .能使酸性KMnO 4溶液或溴的CCl 4溶液褪色
b .能与Na 2CO 3
反应,但不与HBr 反应 c .能与新制
C u (O H )2反应 d .1molA 完全燃烧消耗5molO 2 27.(2012·安徽高考·T27)(15分)亚硫酸盐是一种常见食品添加剂。
为检验某食品中亚硫酸盐含量(通常1kg 样品中含SO 2的质量计),某研究小组设计了如下两种实验流程:
R
C
C
C R 1 R 2
OH
一定条件
R 1R 2
RC ≡CH HOOCCH=CHCOOH
HC ≡CH
HOCH 2CH 2CH 2A
D
(马来酸酐)
H 2O △
H 2 催化剂
(1)气体A的主要成分是,为防止煮沸时发生暴沸,必须先向烧瓶中加入
;通入N2的目的是。
(2)写出甲方案第①步反应的离子方程式:。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果(填“偏高”、“偏低”或“无影响”)
(5)若取样品wg,按乙方案测得消耗0.01000mol·L-1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示)。
28.(2012·安徽高考·T28)(13分)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)PbCO3(s)+SO42-(aq)。
某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:K=。
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在溶液中PbSO4转化率较大,理由是。
(3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。
该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;
假设二:;
假设三:。
(4)为验证假设一是否成立,课题组进行如下研究。
②定量研究:取26.7mg 的干燥样品,加热,测的固体质量随温度的变化关系如下图。
某同学由图中信息得出结论:假设一不成立。
你是否同意该同学的结论,并简述理由: 。
21.0
固体质量/m g
26.7
22.4
0 200 400 温度/℃。