物理化学相平衡(精选)
- 格式:ppt
- 大小:3.37 MB
- 文档页数:2



物理化学相平衡在我们生活的这个世界里,物质以各种各样的形式存在着,它们之间的相互转化和共存遵循着一定的规律,这就是物理化学中的相平衡。
相平衡研究的是在不同条件下,物质的不同相之间的平衡关系。
它不仅是物理化学的重要组成部分,也在许多实际领域,如化工、材料科学、地质科学等,发挥着关键作用。
让我们先来理解一下什么是“相”。
简单来说,相是指系统中物理性质和化学性质完全均匀的部分。
比如说,一杯水就是一个单相系统,因为水的性质在整个杯子中是均匀的。
但如果在水里加入油,就形成了水相和油相两个不同的相。
相平衡的概念可以通过一些常见的现象来理解。
比如,在一个封闭的容器中,水会不断蒸发变成水蒸气,而水蒸气也会不断凝结成水。
当蒸发和凝结的速率相等时,就达到了气液两相的平衡状态。
再比如,在冬天,湖面上的水会结冰,而冰和水在一定温度下能够稳定共存,这也是一种相平衡。
那么,相平衡是如何实现的呢?这就涉及到热力学的知识。
热力学第一定律告诉我们能量是守恒的,而热力学第二定律则指出了自发过程的方向和限度。
在相平衡中,系统的自由能会达到最小值,从而使得相的组成和性质保持稳定。
相律是描述相平衡系统的重要规律。
它由吉布斯提出,表达式为 F= C P + 2 ,其中 F 表示自由度,C 表示组分数,P 表示相数。
自由度是指在不改变相的种类和数目时,可以独立改变的强度性质的数目,比如温度、压力、浓度等。
通过相律,我们可以对相平衡系统进行分析和计算。
比如说,对于一个单组分系统,如水的气液平衡,组分数 C = 1 ,相数 P = 2 (气相和液相),那么自由度 F = 1 2 + 2 = 1 。
这意味着在温度和压力两个变量中,只有一个可以独立变化。
比如,在一定压力下,水的沸点是固定的,改变压力,沸点也会随之改变。
多组分系统的相平衡就更加复杂了。
以盐水溶液为例,盐和水构成了两个组分。
当盐的浓度不同时,可能会出现不同的相态,如溶液相、固相(盐结晶)等。





复旦物理化学1000题相平衡72
摘要:
一、引言
二、相平衡的定义和基本原理
三、相平衡的应用领域
四、相平衡在化学反应中的作用
五、相平衡对环境和经济的影响
六、结论
正文:
一、引言
相平衡是物理化学中的一个重要概念,涉及气相、液相和固相之间的相互转化。
在自然界和人类活动中,相平衡现象普遍存在,理解和掌握相平衡对于解决实际问题具有重要意义。
二、相平衡的定义和基本原理
相平衡是指在一定温度和压力下,多相体系中各相的组成和分布保持不变的状态。
相平衡的基本原理是热力学第二定律,即熵增原理。
在相平衡状态下,各相的熵值达到最大,且各相之间的化学势相等。
三、相平衡的应用领域
相平衡在许多领域有广泛应用,如地质学、材料科学、环境科学和化工等。
在地质学中,相平衡研究有助于揭示岩石相变、成矿作用等地质过程。
在材料科学中,相平衡原理可用于研究材料的制备、性能和稳定性等。
四、相平衡在化学反应中的作用
相平衡在化学反应中起关键作用。
在相平衡状态下,化学反应可以进行到最大限度,反应速率最大。
同时,相平衡也决定了化学反应的方向和限度。
五、相平衡对环境和经济的影响
相平衡现象对环境和经济发展具有重要影响。
例如,地球大气中的温室气体增加导致气候变暖,进而影响农业、水资源和生态系统。
此外,相平衡原理在石油、天然气和矿产资源开发中也有重要作用。
六、结论
相平衡是物理化学中的基本概念,具有广泛的应用价值。
物理化学答案——第五章-相平衡[1]第五章相平衡⼀、基本公式和内容提要基本公式1. 克劳修斯—克拉贝龙⽅程mmH dp dT T V ?=?相相(克拉贝龙⽅程,适⽤于任何纯物质的两相平衡)2ln mH d p dT RT=相(克劳修斯—克拉贝龙⽅程,适⽤与其中⼀相为⽓相,且服从理想⽓体状态⽅程的两相间平衡)2.特鲁顿(Trouton)规则1188vap mvap m bH S J mol k T --?=?≈??(T b 为该液体的正常沸点)3.相律f+Φ=C+n C=S-R-R ′ f+Φ=C+2 (最普遍形式)f* +Φ=C+1 (若温度和压⼒有⼀个固定,f * 称为“条件⾃由度”)*4. Ehrenfest ⽅程2112()p p C C dpdT TV αα-=-(C p ,α为各相的恒压热容,膨胀系数)基本概念1.相:体系中物理性质和化学性质完全均匀的部分,⽤Φ表⽰。
相的数⽬叫相数。
2.独⽴组分数C =S -R -R ′,S 为物种数,R 为独⽴化学反应计量式数⽬,R ′为同⼀相中独⽴的浓度限制条件数。
3.⾃由度:指相平衡体系中相数保持不变时,所具有独⽴可变的强度变量数,⽤字母 f 表⽰。
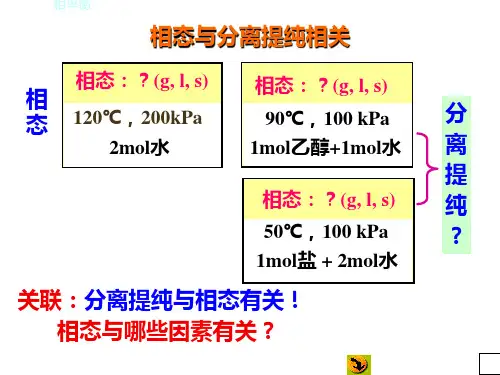
单组分体系相图相图是⽤⼏何图形来描述多相平衡系统宏观状态与 T 、p 、X B (组成)的关系。
单组分体系,因 C =1 ,故相律表达式为 f =3-Φ。
显然 f 最⼩为零,Φ最多应为 3 ,因相数最少为 1 ,故⾃由度数最多为 2 。
在单组分相图中,(如图5-1,⽔的相图)有单相的⾯、两相平衡线和三相平衡的点,⾃由度分别为 f =2、f =1、f =0。
两相平衡线的斜率可由克拉贝龙⽅程求得。
图5-1⼆组分体系相图根据相律表达式f=C-Φ+2=4-Φ,可知f最⼩为零,则Φ最多为 4 ,⽽相数最少为 1 ,故⾃由度最多为 3 。
为能在平⾯上显⽰⼆组分系统的状态,往往固定温度或压⼒,绘制压⼒-组成(p-x、y)图或温度-组成(T-x、y)图,故此时相律表达式为f*=3-Φ,⾃然f*最⼩为 0 ,Φ最多为 3,所以在⼆组分平⾯图上最多出现三相共存。
相平衡一、主要概念组分数,自由度,相图,相点,露点,泡点,共熔点,(连)结线,三相线,步冷(冷却)曲线,低共熔混合物(固相完全不互溶) 二、重要定律与公式本章主要要求掌握相律的使用条件和应用,单组分和双组分系统的各类典型相图特征、绘制方法和应用,利用杠杆规则进行有关计算。
1、相律: F = C - P + n , 其中: C=S-R-R’ (1) 强度因素T ,p 可变时n =2 (2) 对单组分系统:C =1, F =3-P(3) 对双组分系统:C =2,F =4-P ;应用于平面相图时恒温或恒压,F =3-P 。
2、相图(1)相图:相态与T ,p ,x 的关系图,通常将有关的相变点联结而成。
(2)实验方法:实验主要是测定系统的相变点。
常用如下四种方法得到。
对于气液平衡系统,常用方法蒸气压法和沸点法; 液固(凝聚)系统,通常用热分析法和溶解度法。
3、单组分系统的典型相图对于单组分系统C =1,F =C -P +2=3-P 。
当相数P =1时,自由度数F =2最大,即为双变量系统,通常绘制蒸气压-温度(p-T )相图,见下图。
p T lBC AOsgC 'pTlBCA Os gFGD单斜硫pT液体硫B CAO正交硫硫蒸气(a) 正常相图 (b) 水的相图 (c) 硫的相图图6-1 常见的单组分系统相图4、二组分系统的相图类型:恒压的t -x (y )和恒温的p -x (y )相图。
相态:气液相图和液-固(凝聚系统)相图。
(1)气液相图根据液态的互溶性分为完全互溶(细分为形成理想混合物、最大正偏差和最大负偏差)、部分互溶(细分为有一低共溶点和有一转变温度的系统)和完全不溶(溶液完全分层)的相图。
可以作恒温下的p -x (压力-组成)图或恒压下的t -x (温度-组成)图,见图5-2和图5-3。
B Apx B (y B )B Apx B (y B)BApx B (y B )(a) 理想混合物 (b) 最大负偏差的混合物 (c) 最大正偏差的混合物图6-2 二组分系统恒温下的典型气液p -x 相图BAtx B (y B)BAtx B (y B)BAtx B (y B )(a) 理想或偏差不大的混合物 (b) 具有最高恒沸点(大负偏差) (c) 具有最低恒沸点(大正偏差)BAtxBBAtx B DCGFOgg + l g + ll 1 + l 2p = 常数lBAtx B (y B )(d) 有最高会溶点的部分互溶系统 (e)有最高和最低会溶点的部分互溶系统 (f) 沸点与会溶点分离x B (y B)B Atx B (y B )BAtBAtx B (y B )(g) 液相部分互溶的典型系统 (h)液相有转沸点的部分互溶系统 (i) 液相完全不互溶的系统图6-3 二组分系统恒压下的典型气液相图(2)液-固系统相图: 通常忽略压力的影响而只考虑t -x 图。