4-1第三章第三节免疫球蛋白与抗体
- 格式:pptx
- 大小:932.06 KB
- 文档页数:27


第三章免疫球蛋白1890年德国学者Von Behring和日本学者Kitasato用白喉杆菌外毒素免疫动物,在免疫动物血清中发现能中和白喉外毒素的组分,并称之为抗毒素,这是在血清中发现的第一种抗体。
这种含有抗体的血清即免疫血清。
1938年Tiselius和Kabat用电泳技术研究免疫血清,证明抗体活性与血清丙种(γ)球蛋白组分有关。
此后一系列的研究发现免疫血清中的一部分抗体活性还可存在于α球蛋白和β球蛋白组分内,从而证实抗体是由异质性球蛋白组成的。
1964年世界卫生组织举行专门国际会议,将具有抗体活性的球蛋白或化学结构上与抗体相似的球蛋白统一命名为免疫球蛋白(Immunoglobulin,Ig)。
免疫球蛋白包括抗体球蛋白和骨髓瘤、巨球蛋白血症等病人血清中未证实有抗体活性的异常免疫球蛋白。
免疫球蛋白是化学结构上的概念,而抗体是生物学功能上的概念。
所有的抗体均属免疫球蛋白,但免疫球蛋白并非都是抗体。
抗体(Antibody,Ab)是指一类在抗原物质刺激机体免疫系统后形成的、具有与相应抗原物质发生特异性结合反应的免疫球蛋白。
抗体是免疫应答的重要产物,主要存在于血液、组织液和外分泌液中,因此将抗体介导的免疫称为体液免疫。
第一节免疫球蛋白的分子结构一、免疫球蛋白的基本结构免疫球蛋白分子由1000个以上的氨基酸残基组成。
1963年Porter提出了IgG的化学结构模式图(图4-1),后经许多学者研究证实,其它几类Ig亦具有相似的基本结构。
图4-1 IgG的化学结构模式图免疫球蛋白的基本结构是由二硫键连接的四条肽链组成的对称结构。
分子量较小的一对肽链称为轻链(Light chain,L链),每条轻链约由214个氨基酸残基组成,L链共有两型,Kappa(κ)与Lambda(λ)。
同一个免疫球蛋白单体分子上的L链型别完全相同。
分子量较大的一对肽链称为重链(Heavy chain,H链),约由450~570个氨基酸残基组成。



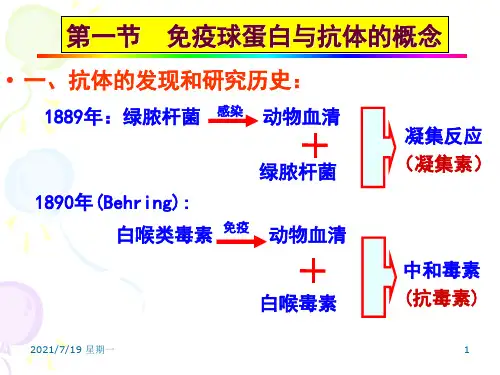





第三章抗体与免疫球蛋白第一节抗体的发现及其特性一、发现:1890年德国学者Behrong和日本学者北里用白喉杆菌外毒素免疫动物,在其血清中发现一种能力和这种外毒素的组分称为抗毒素。
这是在血清中发现的第一种抗体。
二、抗体的理化性质1、抗体是球蛋白(Globulin)通过电泳证明抗体是两种球蛋白后又经电泳分析,超速离心分析和分子量测定等方法,发现大部分抗体是r球蛋白,小部分是β球蛋白。
所以早期对抗体性质的研究证明抗体不是由均质性球蛋白(γ〃β)组成,是异均性的。
2、免疫球蛋白(lmmunoglabulin, Ig)为了准确描述抗体球蛋白的性质,在60年代初提出将具有抗体活性的球蛋白称为免疫球蛋白。
从此r球蛋白则改称为IgG,BIM称为IgM,而B:A称为IgA,其后又发现IgE和IgE。
抗体主要存在于血清中,但也存在于体液和外分泌液中,所以含有抗体的血清称为免疫血清。
B细胞表面上也存在免疫球蛋白,称为膜表面免疫球蛋白Surface membrane Ig,SmIg。
第二节免疫球蛋白的结构一、Ig的基本结构1、是由四条链组成的糖蛋白2、重链(Heavy chain)轻链(light chain)3、可变区和恒定区①可变区(VariableV区)②恒定区(Constant region, C区)二、Ig功能区1、L链:VL,CL2、H链:3、铰链区:①富含脯氨酸,易发生伸展及一定程度的转动,便于与抗原决定簇发生互补,也易于与补体结合。
②对木瓜蛋白酶,胃蛋白酶敏感。
③ IgM,IgE缺乏铰链区。
4、T链和分泌成分① T链(Toining chain)存在于IgM和IgA中,通过二硫键与它们结合,IgM为五聚体,IgA为二聚体(分泌型)②分泌成分或分泌片(seeretory componant, secratory, piece)是分泌型IgA的一种辅助成分。
功能是抵抗外分泌液中蛋白水解酶的降解。
三、Ig水解片段(1)木瓜蛋白酶(Papain)水解片段①在二硫键上方切断,产生三个片段:2个Fab段(抗原结合段)Fragineut:fantigen binding)。