专题19 有机反应类型
- 格式:doc
- 大小:130.00 KB
- 文档页数:5

有机反应类型及反应条件
有机反应类型及反应条件:
一、取代反应
1、烷烃的取代反应:光照
2、芳香烃的取代反应
1)溴苯的制备:三溴化铁
2)硝化反应:浓硫酸加热
3)TNT的制备
3、水解反应
A、卤代烃的水解反应:氢氧化钠的水溶液、加热
B、酯的水解反应:a、酸性水解——羧酸+醇
b、碱性水解——羧酸盐+醇:
4、醇:A、酯化反应:浓硫酸加热
B、与HX共热
5、酚:A、三溴苯酚的制备
B、与碳酸钠反应:
C、酯化反应:如乙酸乙酯的制备
D、显色反应(Fe3+)显紫色
E、酸碱中和
6、羧酸:A、酯化反应
B、与碳酸钠或NaHCO3
C、酸碱中和
二、加成反应(不饱和键断开)
1、不饱和烃的加成反应
A、与氢气:Ni加热
B、与水:高温高压加热
2、醛酮的催化加氢
3、油脂的氢化
三、消去反应(消去小分子,形成不饱和键)
1、卤代烃的消去反应:氢氧化钠的醇溶液共热(如溴乙烷的消去)
2、醇的消去:浓硫酸加热(如乙醇的消去)
四、氧化反应
1、有机物的燃烧
2、醇的催化氧化:与氧气在铜或者银作为催化剂加热下(如乙醇的催化氧化)
3、醛的氧化
A、银镜反应:水浴加热(如苯甲醛银镜反应)
B、与新制氢氧化铜的反应:
C、与强氧化剂的反应:如酸性高锰酸钾反应
五、还原反应:
1、醛酮的催化加氢
2、油脂的氢化
六、聚合反应、
1、加聚反应:如聚乙烯的制备
2、缩聚反应
3、酚醛树脂的制备:水浴加热。

化学有机反应的基本类型一、取代反应 1、卤代(1)饱和烃(纯卤素蒸气、光照)——得到的有机产物是混合物 (2)苯环(纯卤素,Fe 催化,一取代) (3)苯酚(浓溴水,三取代)(4)醇(HX ,浓H 2SO 4,微热,有时也用NaCl/NaBr 、浓H 2SO 4代替HCl/HBr ) 2、水解(1)卤代烃水解(NaOH 溶液,△) (2)酯(油酯)水解(NaOH 溶液,△) (3)糖类(二糖、多糖)(蔗糖、淀粉水解条件为稀H 2SO 4、△;纤维素水解条件为浓H 2SO 4、△) (4)多肽、蛋白质水解3H 2SO 4、55-60℃,一取代)H 2SO 4、△,三取代) 4(1)醇与羧酸的酯化(浓H 2SO 4、△,可逆反应)(2)羟基与无机含氧酸(如:HNO 3)的酯化(浓H 2SO 4、△) 5、其他(1)苯的磺化反应(△)(2)醇与醇成醚(浓H 2SO 4、140℃) (3)氨基酸的缩合反应二、加成反应1、与H 2加成(又叫还原,均为催化剂,△条件)2—C ≡C —3、与(2)—C ≡C —(催化剂,△)4、与—C ≡C —5—C ≡C —(3)三、消去反应1、醇的消去(浓H 2SO 4,△;乙醇消去条件为浓H 2SO 4,170℃)2、卤代烃消去(NaOH 醇溶液,△) 四、聚合反应1、加聚反应——只生成高分子2、缩聚反应——生成高分子和小分子(一般为H 2O )(1)五、有机反应中的氧化还原反应1、氧化反应(1)去氢氧化(Cu 或Ag 催化,△)RCH 2OH —→醛(2) (3)使酸性KmnO 4溶液褪色C ≡C —、苯的同系物、酚、醛2、还原反应—加氢还原O O —C —NH — + H 2O −−−−→一定条件—C —OH + H 2N —O O —C —OH + H 2N −−−−→一定条件—C —NH — +H 2O O O —C=C — 、 —C ≡C — 、 —C —H 、 —C — O O —C — (nCH 2−−−→催化剂 [ —CH 2—O ] n ) O O—C —H —→ —C —OH六、常见除杂法、归纳(一)洗气法(主要仪器:洗气瓶) 1、CH 4(C 2H 4)溴水2、CH 4(HCHO ) 水3、CH 3Cl (HCl ) 水4、C 2H 4(CO 2) NaOH 溶液5、C 2H 2(H 2S )NaOH 溶液(二)分液法(主要仪器:梨形分液漏斗) 1Br (Br 2) NaOH溶液2NO2(HNO 3、H 2SO 4)N aOH溶液3、CH 3COOC 2H 5(C 2H5OH 、CH 3COOH )饱和Na 2CO 3溶液4(OH )NaOH 溶液 5 ()NaOH 溶液 分液 向水溶液层通过量CO 2,再分液,得6CH 3)先加酸性KMnO 4溶液,再加NaOH 溶液,分液(三)蒸馏法(主要仪器:蒸馏烧瓶,温度计,水冷凝管,牛角弯管,锥形瓶) 1、CH 3CHO (HCOOH )加NaOH 溶液后蒸馏 2、C 2H 5OH (CH 3COOH ):加NaOH 溶液,蒸馏 3、CH 3CH 2OH (H 2O ):加生石灰后蒸馏4、CH 3COOH (CH 3CHO ):加NaOH 溶液,蒸馏,再向剩余CH 3COONa 溶液中加浓H 2SO 4,蒸馏,得CH 3COOH 5():直接蒸馏6:直接蒸馏(四)渗析法(主要仪器:半透膜袋、烧杯、淀粉(葡萄糖),浸泡在蒸馏水中。


有机化学反应类型总结是有机化学领域中最为重要的研究内容之一。
通过,化学家们可以合成新的有机化合物,改变化合物的结构和性质,深入研究有机化合物的各种特性。
本文将对常见的类型进行总结和介绍。
一、取代反应取代反应是有机化学中最基本的反应类型之一。
它发生在有机分子中的一个原子或基团被另一个原子或基团所代替的过程中。
常见的取代反应包括烷基取代、芳香族取代和酰基取代等。
在取代反应中,官能团的性质通常会发生变化,从而使得有机分子的性质也发生相应的改变。
二、加成反应加成反应是指两个或多个分子结合形成一个较大的分子的反应类型。
它通常涉及到有机分子中的双键、三键或其他高度不饱和键的断裂和形成。
加成反应的例子包括烯烃的加成、炔烃的加成和羰基化合物的加成等。
通过加成反应,化学家可以合成出各种各样的有机分子,从而为有机合成提供了广阔的空间。
三、消除反应消除反应是指有机化合物中的一个原子或基团被消除出去,形成新的双键或三键的反应类型。
它通常发生在分子中的邻位或对位上,由于消除反应的进行,有机分子的结构和性质会发生改变。
消除反应的例子包括醇的脱水、脱卤代反应和羟基的消除等。
消除反应在有机合成中也起到了重要的作用,能够合成一些具有特殊结构和性质的有机分子。
四、重排反应重排反应是指有机化合物中化学键的重新排列,形成新的键或断裂原有键的反应类型。
重排反应通常发生在有机分子中的官能团或取代基团周围的各个位置上,由于重排反应的进行,有机分子的结构和性质发生了显著的改变。
常见的重排反应包括烷基重排、芳香族重排和脱氢重排等。
通过重排反应,化学家们可以探索有机分子的结构和反应机理,为有机合成提供了新的思路和方法。
五、环化反应环化反应是指有机分子中的合成反应中形成环状结构的反应类型。
通过环化反应,化学家们可以合成出各种各样的环状有机分子,从而研究和探索有机分子的不同结构和性质。
常见的环化反应包括碳碳键的环化反应、羰基的环化反应和杂环的环化反应等。

有机反应类型的总结1、取代反应(1)能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)等。
(2)能发生取代反应的有机物种类如下图所示:2、加成反应1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。
2.加成反应有两个特点:①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
②加成反应后生成物只有一种(不同于取代反应)。
说明:1.羧基和酯基中的碳氧双键不能发生加成反应。
2.醛、酮的羰基只能与H2发生加成反应。
3.共轭二烯有两种不同的加成形式。
3、消去反应(1)能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。
(2)反应机理:相邻消去发生消去反应,必须是与羟基或卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。
如CH3OH,没有邻位碳原子,不能发生消去反应。
4、聚合反应(1)加聚反应:烯烃加聚的基本规律:(2)缩聚反应:(1)二元羧酸和二元醇的缩聚,如合成聚酯纤维:(2)醇酸的酯化缩聚:此类反应若单体为一种,则通式为:若有两种或两种以上的单体,则通式为:(3)氨基与羧基的缩聚(1)氨基酸的缩聚,如合成聚酰胺6:(2)二元羧酸和二元胺的缩聚:5、氧化反应与还原反应1.氧化反应就是有机物分子里“加氧”或“去氢”的反应。
能发生氧化反应的物质和官能团:烯(碳碳双键)、醇、酚、苯的同系物、含醛基的物质等。
烯(碳碳双键)、炔(碳碳叁键)、苯的同系物的氧化反应都主要指的是它们能够使酸性高锰酸钾溶液褪色,被酸性高锰酸钾溶液所氧化。
含醛基的物质(包括醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)的氧化反应,指银镜反应及这些物质与新制氢氧化铜悬浊液的反应。
要注意把握这类反应中官能团的变化及化学方程式的基本形式。
2.还原反应是有机物分子里“加氢”或“去氧”的反应,其中加氢反应又属加成反应。

1. 有机反应的基本类型(1) 取代反应(卤代反应、磺化反应、硝化反应、水解反应、酯化反应、分子间脱水反应)有机物分子中的原子或原子团被其它原子或原子团所代替的反应。
主要有:① 烷烃和卤素单质(气体或蒸气、光照) ② 苯和甲苯的硝化、卤代、磺化。
③ 醇与HX 的反应。
④ 苯酚与浓溴水的反应。
凡两分子生成两分子的有机反应均属于取代反应。
因此,酯化反应、酯类的水解、醇生成醚等反应也是取代反应。
(2) 加成反应(加氢、加卤素单质、加水、加卤化氢等)分子中不饱和的C =C 、C≡C、C =O 等打开,两个原子上各加上原子或者原子团的反应。
主要有:① 含有C =C 、C≡C 的物质与H 2(Ni 、加热)、X 2(溶液中)、H 2O (催化剂、加热)、HX (催化剂、加热)四类加成。
② 含有苯环的物质,含C =O 双键的醛或酮能在Ni 催化,加热时与H 2加成。
(3) 消去反应(分子内脱水、脱卤化氢等)一个大分子脱去小分子形成不饱和键的反应。
主要有醇或卤代烃生成烯的反应。
(4) 氧化反应有机分子中加氧或去氢的反应。
主要有: ① 催化氧化醇氧化成醛、酮或羧酸。
醛被氧化成羧酸。
② 含醛基的物质与银氨溶液或新制氢氧化铜悬浊液的反应。
烃及含氧烃的衍生物的燃烧、含碳碳不饱和键的物质与酸性高锰酸钾溶液、苯酚在空气中由无色晶体变为粉红色也属于氧化反应。
(5) 还原反应有机分子中加氢或去氧的反应。
前文(2)中与H 2的加成反应也属于还原反应。
(6) 加聚反应含不饱和键的分子,打开不饱和键相互连接成链状高分子化合物的反应。
主要有:单烯烃加聚、二烯烃加聚和共聚(单烯烃、二烯烃加聚的组合)。
(7) 缩聚反应单体间缩去小分子形成链状高分子化合物的反应。
主要为分子中含两个脱小分子基团(-OH 、-COOH 、-NH 2、-X 等)的缩聚。
如:n HOHC COOH3OH C C 3O n + n H 2On HOOCCOOH + n HO -CH 2CH 2-OHCCO O OCH 2CH 2On+ 2n H 2O苯酚与福尔马林也能发生缩聚反应(见前文)。

有机反应类型一、有机物的基本反应类型1.取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应叫取代反应。
从取代反应的定义知:①是原子或原子团与另一原子或原子团的交换;②两种物质反应,生成两种物质,有上有下的;③该反应前后的有机物的空间结构没有发生变化;④取代反应总是发生在单键上;⑤ 这是饱和化合物的特征反应。
以下的各种反应都可属于取代反应。
① 卤代反应:烷烃的卤代,苯和苯的同系物的卤代,苯酚的卤代,醇的卤代。
如,CH 4 + Cl 2−→−光+ Br 2−→−Fe—CH 3 + Cl 2−→−光C 2H 5OH + Br 2−→−△② 硝化反应:苯和苯的同系物的硝化,苯酚的硝化。
如,+ HO-NO 2−−−→−H2SO4浓③ 磺化反应:苯的磺化。
④ 酯化反应:醇和羧酸酯化,醇和无机酸的酯化,葡萄糖与乙醇反应生成五乙酸葡萄糖酯。
CH 3COOH + C 2H 5OH → C 2H 5OH + HO-NO 2 →⑤ 水解反应:卤代烃的水解、酯的水解、二糖和多糖的水解、蛋白质的水解。
CH 3CH 2Cl +H 2O+H 2OCH 3COOCH 2CH 3+H 2O →CH 3COOCH 2CH 3+NaOH →(C6H10O5)n+nH2O蛋白质+H2O多种氨基酸⑥分子间脱水反应2.加成反应:有机物分子中不饱和键(双键或三键)两端的原子与其他原子或原子团直接结合成一种新的化合物的反应叫加成反应。
从加成反应的定义知,①加成反应发生在不饱和碳原子上;②该反应总是发生在不饱和键中的键能较小的键;③该反应中加进原子或原子团,只生成一种有机物相当于化合反应,只上不下的;④加成前后的有机物的结构将发生变化,炔烃变烯烃,结构由平面形变立体形;炔烃变烯烃,结构由直线形变平面形;⑤加成反应是不饱和化合物的特征反应,另外,芳香族化合物也有可能发生加成反应。
化学键断裂和生成方式:断裂C=C或C=O中的一个键(C≡C中的一个或两个),在原不饱和碳原子或氧原子上形成新键。

有机化学的反应类型
1. 加成反应:在反应中,两种或两种以上的分子结合成一个分子。
2. 消除反应:在反应中,一个大分子分解成两个小分子。
3. 取代反应:在反应中,一个原子或官能团被另一个原子或官能团取代。
4. 氧化还原反应:在反应中,一个物质失去电子而被氧化,而另一个物质获得电子而被还原。
5. 酸碱反应:在反应中,酸和碱互相中和形成盐和水的反应。
6. 缩合反应:在反应中,两个分子结合形成一个分子的过程。
7. 开环反应:在反应中,环形化合物断裂成直线化合物的过程。
8. 重排反应:在反应中,原始分子中原子或官能团排列位置的变化。
9. 氢解反应:在反应中,有机化合物和水反应,水分子加入到化合物中使其分解成两个分子。
10. 还原反应:在反应中,有机化合物和还原剂(如氢气、亚
硫酸盐等)反应,使化合物中的官能团发生还原反应。
11. 消除加成反应:在反应中,两个分子结合成一个分子,同
时又失去一些原子或官能团。
12. 氧杂化反应:在反应中,有机化合物中的氮、硫等杂原子
和氧反应,形成新的化合物。
13. 氧杂化加成反应:在反应中,两个分子结合成一个分子,
并且有机化合物中的氮、硫等杂原子和氧反应。
14. 核替换反应:在反应中,有机化合物中的核被另一个原子
或核替换。
15. 氧化反应:在反应中,有机化合物和氧反应,官能团中的双键或多键与氧反应,形成新的化合物。

化学有机反应类型总结有机化学是研究有机物质的结构、性质和反应的科学。
有机反应是有机化学的重要组成部分,是指有机物质之间或有机物质与其他物质之间发生的化学变化。
有机反应类型繁多,下面我们将对常见的有机反应类型进行总结。
1. 取代反应取代反应是指有机物中的一个官能团被另一个官能团所取代的反应。
常见的取代反应有卤代烃的取代反应、醇的取代反应、酸的取代反应等。
取代反应的机理一般是通过亲核试剂或电子受体试剂的作用,使原有官能团离去,再由新的试剂与空位上的碳原子形成新的官能团。
2. 加成反应加成反应是指两个或多个分子中的双键或三键被破裂,形成新的单键或双键的反应。
常见的加成反应有烯烃的加成反应、芳香族化合物的加成反应等。
加成反应的机理是通过亲电试剂或自由基试剂的作用,使原有的双键或三键断裂,再由新的试剂与空位上的碳原子形成新的单键或双键。
3. 消除反应消除反应是指有机物中的两个官能团之间的原子或原子团被消除,形成双键或三键的反应。
常见的消除反应有醇的消除反应、卤代烃的消除反应等。
消除反应的机理是通过碱性试剂或热作用,使原有官能团中的原子或原子团离去,再由空位上的碳原子形成新的双键或三键。
4. 氧化还原反应氧化还原反应是指有机物中的氧化剂和还原剂之间的电子转移反应。
常见的氧化还原反应有醇的氧化反应、醛的还原反应等。
氧化还原反应的机理是通过氧化剂或还原剂的作用,使电子从一个分子转移到另一个分子,形成氧化物或还原物。
5. 缩合反应缩合反应是指两个或多个分子中的官能团之间形成新的化学键的反应。
常见的缩合反应有醛的缩合反应、胺的缩合反应等。
缩合反应的机理是通过亲核试剂或电子受体试剂的作用,使原有官能团之间形成新的化学键。
有机反应类型繁多,每种反应都有其独特的机理和应用场景。
在实际应用中,我们需要根据不同的反应类型和反应条件,选择合适的试剂和反应条件,以达到预期的反应目的。

有机反应类型有哪些有机反应即涉及有机化合物的化学反应,是有机合成的基础。
几种基本反应类型为:取代反应、加成反应、消除反应、周环反应、重排反应和氧化还原反应。
有机反应的类型1.取代反应:取代反应是指化合物或有机物分子中任何一个原子或原子团被试剂中同类型的其它原子或原子团所替代的反应,用通式表示为:R-L(反应基质)+A-B(进攻试剂)→R-A(取代产物)+L-B(离去基团)属于化学反应的一类。
2.加成反应:加成反应是不饱和化合物类的一种特征反应。
加成反应是反应物分子中以重键结合的或共轭不饱和体系末端的两个原子,在反应中分别与由试剂提供的基团或原子以σ键相结合,得到一种饱和的或比较饱和的加成产物。
这个加成产物可以是稳定的;也可以是不稳定的中间体,随即发生进一步变化而形成稳定产物。
3.消除反应:消除反应又称脱去反应或是消去反应,是指一种有机化合物分子和其他物质反应,失去部分原子或官能基(称为离去基)的有机反应。
消除反应发生后,生成反应的分子会产生多键,为不饱和有机化合物。
消除反应可使反应物分子失去两个基团(见基)或原子,从而提高其不饱和度。
4.周环反应:这类反应表明化学键的断裂和生成是同时发生的,它们都对过渡态作出贡献。
这种一步完成的多中心反应称为周环反应。
5.氧化还原反应:氧化-还原反应的实质是电子的得失或共用电子对的偏移。
反应中,发生氧化反应的物质,称为还原剂,生成氧化产物;发生还原反应的物质,称为氧化剂,生成还原产物。
氧化还原反应的方程式1.单质与氧气的反应①镁在空气中燃烧:2Mg+O2点燃2MgO②铁在氧气中燃烧:3Fe+2O2点燃Fe3O4③铜在空气中受热:2Cu+O2加热2CuO④铝在空气中燃烧:4Al+3O2点燃2Al2O3⑤氢气中空气中燃烧:2H2+O2点燃2H2O2.化合物与氧气的反应①一氧化碳在氧气中燃烧:2CO+O2点燃2CO2②甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O③酒精在空气中燃烧:C2H5OH+3O2点燃2CO2+3H2O。

有机化学反应类型1、取代反应指有机物分子中的某些原子或原子团被其他原子或原子团取代的反应。
常见的取代反应:⑴烃(主要是烷烃和芳香烃)的卤代反应;⑵芳香烃的硝化反应;⑶醇与氢卤酸的反应、醇的羟基氢原子被置换的反应;⑷酯类(包括油脂)的水解反应;⑸酸酐、糖类、蛋白质的水解反应。
2、加成反应指试剂与不饱和化合物分子结合使不饱和化合物的不饱和程度降低或生成饱和化合物的反应。
常见的加成反应:⑴烯烃、炔烃、芳香族化合物、醛、酮等物质都能与氢气发生加成反应(也叫加氢反应、氢化或还原反应);⑵烯烃、炔烃、芳香族化合物与卤素的加成反应;⑶烯烃、炔烃与水、卤化氢等的加成反应。
3、聚合反应指由相对分子质量小的小分子互相结合成相对分子质量大的高分子的反应。
参加聚合反应的小分子叫作单体,聚合后生成的大分子叫作聚合物。
常见的聚合反应:加聚反应:指由不饱和的相对分子质量小的小分子结合成相对分子质量大的高分子的反应。
较常见的加聚反应: ①单烯烃的加聚反应 在方程式中,—CH 2—CH 2—叫作链节, 中n 叫作聚合度,CH 2=CH 2叫作单体, 叫作加聚物(或高聚物)②二烯烃的加聚反应 4、氧化和还原反应(1)氧化反应:有机物分子中加氧或去氢的反应均为氧化反应。
常见的氧化反应: ①有机物使酸性高锰酸钾溶液褪色的反应。
如:R —CH=CH —R ′、R —C ≡C —R ′、 (具有α—H)、—OH 、R —CHO 能使酸性高锰酸钾溶液褪色。
②醇的催化氧化(脱氢)反应醛的氧化反应 ③醛的银镜反应、费林反应(凡是分子中含有醛基或相当于醛基的结构,都可以发生此类反应) (2)还原反应:有机物分子中去氧或加氢的反应均为还原反应。
n CH 2=CH 2 n CH 2—CH 2催化剂 n CH 2—CH 2 n CH 2—CH 2 n CH 2=C —CH=CH 2CH 3 CH 2—C=CH —CH 2 CH 3 n 催化剂 —R 2RCH 2OH + O 22RCHO + 2H 2O △ Cu 或Ag 2R —CH —R ′+ O 22R —C —R ′+ 2H 2OOH O △ Cu 或Ag 2RCHO + O 22RCOOH 催化。

无机化学反应基本类型有化合反应,分解反应,复分解反应,置换反应四大类;有机化学反应类型有:取代反应(水解、酯化、缩合)、加成反应、消去反应、氧化反应、还原反应、聚合反应(加聚、缩聚)等6大类别.反应还可划分为氧化还原反应与非氧化还原反应.氧化还原反应中有化合价变化,非氧化还原反应中没有.有机中的氧化反应——(大多数有机物的燃烧),加氧或者去氢的反应;有机中的还原反应——去氢或者加氧的反应.取代反应和置换反应的比较:取代反应:(1)可与化合物发生反应,产物中不一定有单质.(2)反应能否进行受催化剂、温度、光照等外界条件影响较大.(3)逐步取代置换反应:(1)反应物、产物中一定有单质.(2)在水溶液中进行的置换反应应遵循金属或非金属活动性的顺序.(3)反应一般单向进行.取代反应:分子里某些原子或原子团被其它原子或原子团所替代的反应加成反应:有机分子里不饱和的碳原子与其它原子或原子团直接结合生成新的化合物的反应.消去反应:有机物从分子里脱去小分子而成为不饱和分子.酯化反应:酸和醇反应生成酯和水的反应水解反应:有机物和水作用生成两个或几个产物的反应氧化反应:有机物燃烧或得氧失氢的反应还原反应:失氧得氢的反应.(加氢反应为还原反应)加聚反应:由不饱和的单体聚合生成高分子化合物的反应.缩聚反应:由单体相互反应成高分子化合物同时还生成小分子.裂化反应:在一定条件下,把相对分子质量大,沸点高的长链烃断裂为相对分子质量小,沸点低的短链烃的反应.无机:化学反应可以分类为四种基本反应类型:化合反应、分解反应、置换反应和复分解反应. 化合反应:由两种或两种以上的物质生成另一种物质的反应,叫做化合反应.A+B=C分解反应:由一种物质生成两种或两种以上的其它物质的化学反应,叫做分解反应.A=B+C 置换反应:一种单质与另一种化合物起反应生成另一种单质和化合物的反应叫置换反应.A+BC=AC +B复分解反应:两种化合物相互交换离子生成另外两种化合物的反应叫复分解反应.AB+CD=AD +CB。

有机化学中反应的主要类型有机反应的基本类型:取代反应、加成反应、消去反应、聚合反应(分加聚与缩聚)、氧化反应与还原反应、酯化反应、水解反应、中和反应及其它反应1、取代反应:概念:有机物分子里某些原子或原子团被其它原子或原子团所代替的反应。
能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)。
2、加成反应:能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)。
加成反应有两个特点:①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
②加成反应后生成物只有一种(不同于取代反应,还会有卤化氢生成)。
3、消去反应:概念:有机物在适当的条件下,从一个分子中脱去一个小分子(如水、HX等),生成不饱和(双键或三键)化合物的反应。
如:实验室制乙烯。
能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。
3.反应机理:相邻消去3、聚合反应:聚合反应是指小分子互相作用生成高分子的反应。
聚合反应包括加聚和缩聚反应。
加聚反应:由不饱和的单体加成聚合成高分子化合物的反应。
反应是通过单体的自聚或共聚完成的。
能发生加聚反应的官能团是:碳碳双键.加聚反应的实质是:加成反应。
加聚反应的反应机理是:碳碳双键断裂后,小分子彼此拉起手来,形成高分子化合物。
缩聚反应:有机物单体间通过失去水分子或其它小分子形成高分子化合物的反应叫缩聚反应。
该类反应的单体一般具有两个或两个以上的官能团。
如酚醛树脂、氨基酸形成蛋白质等。
5、氧化反应与还原反应:氧化反应就是有机物分子里“加氧”或“去氢”的反应。
能发生氧化反应的物质和官能团:烯(碳碳双键)、炔(碳碳三键)、醇、酚、苯的同系物、含醛基的物质等。
还原反应是有机物分子里“加氢”或“去氧”的反应,其中加氢反应又属加成反应。
还原反应具体有:与氢气的加成、硝基苯的还原。

高中化学有机反应类型总结
高中化学有机反应类型包括以下几种:
1. 取代反应:有机化合物分子中某一原子或基团被其他原子或
基团 (直接连接碳原子的原子或基团) 所取代的反应。
2. 加成反应:有机分子中双键或三键打开,两个分子分别连接
到一个新的基团上的反应。
3. 消去反应:有机化合物中从一个分子中脱去一个或几个小分子,生成不饱和化合物的反应。
4. 氧化反应:有机分子中得到氧原子或失去氢原子的反应。
5. 还原反应:有机分子中失去氧原子或得到氢原子的反应。
在这些反应中,取代反应是最基本的反应类型之一,可以利用取代反应来制备各种有机化合物,例如醇、醛、酮、芳香烃等。
加成反应则是一种重要的合成有机化合物的方法,例如通过加成反应制备醇、醚、酮等。
消去反应则可以用来制备不饱和化合物,例如烯烃、炔烃等。
氧化反应和还原反应则可以用于制备不同的有机化合物,例如芳香烃和膠类化合物等。
总之,高中化学有机反应类型非常丰富,掌握这些反应对于进行有机合成和分析有机物的结构具有重要意义。

高中化学:有机化学反应类型总结1. 能与Na反应的有机物①醇类:醇类物质的羟基能与Na反应产生氢气。
例如:②酚类:酚类物质的羟基能与Na反应产生氢气。
例如:③苦味酸:④糖类:糖类物质的羟基能与Na反应产生氢气。
例如:。
⑤羧酸:羧酸类物质的羧羟基能与Na反应产生氢气。
例如:。
⑥蛋白质、氨基酸:蛋白质和氨基酸等物质含有的羧羟基能与Na 反应产生氢气。
例如:。
⑦磺酸:磺酸类物质的磺酸基能与Na反应产生氢气。
例如:2. 能与反应的有机物①酚类:酚类物质的羟基能与NaOH发生反应生产酚钠。
例如:②苦味酸:③羧酸:羧酸类物质的羧基能与发生中和反应产生羧酸钠。
例如:。
④蛋白质、氨基酸:蛋白质和氨基酸等物质含有的羧基能与NaOH发生中和反应。
例如:。
⑤磺酸:磺酸类物质的磺酸基能与发生中和反应。
例如:⑥卤代烃的水解:卤代烃与NaOH溶液能发生水解反应。
例如:。
⑦卤代烃的消去:卤代烃与的醇溶液在加热条件下能发生消去反应。
例如:。
⑧酯和油脂的水解:酯和油脂的酯基在碱性条件下能够发生水解反应。
例如:⑨无水羧酸钠与NaOH固体在加热条件下能够反应产生烷烃。
例如:。
3. 能与反应的有机物①羧酸:羧酸类物质的羧基能与发生反应。
例如:。
②蛋白质、氨基酸:蛋白质和氨基酸等物质含有的羧基能与发生反应。
例如:。
③磺酸:磺酸类物质的磺酸基能与发生反应。
例如:4. 能与反应的有机物①酚类:酚类物质的羟基能与发生反应。
例如:②苦味酸:③羧酸:羧酸类物质的羧基能与发生反应。
例如:。
④蛋白质、氨基酸:蛋白质和氨基酸等物质含有的羧基能与发生反应。
例如:。
⑤磺酸:磺酸类物质的磺酸基能与发生反应。
例如:综上所述,含羧基的物质与(与反应,可以1:1生成,也可以2:1生成和)都反应;含酚羟基的物质只能与Na、NaOH、(与反应,只能以1:1生成)反应。
含醇羟基的物质只能与Na反应。

一、有机反应归类有机反应官能团及类别反应条件重点反应方程式举例取代反应卤代反应烷烃(通式)光照苯(通式)及同系物光照催化剂苯酚(-OH)醇(-OH)加热硝化反应苯及同系物浓硫酸、加热酯化反应酸(-COOH)醇(-OH):浓硫酸、加热水解卤代烃(-X)NaOH、水加热|+ HClCH3COOH+ CH3CH2OH CH3COOCH2CH3+H2O浓硫酸△CH4+Cl2CH3Cl+HCl光CH2Cl2+Cl2CHCl3+HCl(CHCl3又叫氯仿)光C2H5—Br + H2OC2H5—OH + HBr△CH3|+Cl2光照CH2Cl反应酯稀硫酸,加热碱、加热糖类稀酸C12H22O11+H2O 2 C6H12O6分子间脱水醇浓硫酸,140℃加成反应与H2(还原反应)烯烃、炔烃:苯及同系物:醛:加热、Ni作催化剂与X2、HX与H2O烯烃:炔烃:加热消去反应卤代烃NaOH、醇加热CH3COOC2H5+H2O CH3COOH + C2H5OH无机酸△CH3COOC2H5+H2O CH3COOH + C2H5OH无机酸△CH3COOC2H5+H2O CH3COOH + C2H5OH无机酸△CH3—C—H +H2 CH3C H2OHO催化剂△CH2=CH2+Br2 CH2Br—CH2BrCH2=CH2+ H2CH3CH3催化剂△CH2=CH2+Br2 CH2Br—CH2BrCH2=CH2+ H2O CH3CH2OH高温高压催化剂催化剂△CH3COOC2H5+NaOH CH3COONa + C2H5OH△醇 浓硫酸,加热170℃氧化反应有机物大多都能燃烧,碳碳双键、碳碳三键、苯的同系物、醛基都能被酸性高锰酸钾溶液氧化,乙醇能使重铬酸钾溶液变色。
醇催化氧化醛催化氧化被其他氧化剂氧化聚合 反应加聚反应缩聚反应n HOOC-COOH +n HOCH 2-CH 2OH HO[ OC-COOCH 2CH 2O]n H +(2n-1)H 2O中和 反应苯酚羧酸CH 3COOHCH 3COO -+H +具有酸的通性CH 3CHO +2Ag(NH 3)2OHCH 3COONH 4+2Ag+3NH 3+H 2O△CH 3CH 2OHH 2C=CH 2↑+H 2O浓硫酸 170℃一定条件CH 2-CH 2n CH 2=CH 2n2CH 3—C —H+O 2 2CH 3COOH O催化剂 △CH 3CHO+2Cu(OH)2CH 3COOH+C△CH 3CHO+2Cu(OH)2+NaOHCH 3COONa+Cu 2O+3H 2O△中和反应CH3COOH +NaOH = CH3COONa+H2O氨基酸NH2-CH2-COOH + NaOH NH2-CH2-COONa + H2O置换反应醇有机实验(反应)制取乙烯1、石蜡油分解制取乙烯2、制取乙炔淀粉水解(C6H10O5)n + nH2O nC6H12O6苯酚弱酸性蛋白质盐析(可逆)、变性(不可逆)、颜色反应(遇浓硝酸变黄)、水解反应(最终氨基酸)二、烃基及其衍生物的相互转化CaC2 + 2H2O HC CH↑+Ca(OH)2CH3CH2OH H2C=CH2↑+H2O浓硫酸170℃烃的衍生物的重要类别和主要化学性质:类别通式代表物分子结构特点主要化学性质卤代烃R—X溴乙烷C2H5BrC—X键有极性,易断裂1.取代反应:与NaOH溶液发生取代反应,生成醇;2.消去反应:与强碱的醇溶液共热,生成烯烃。
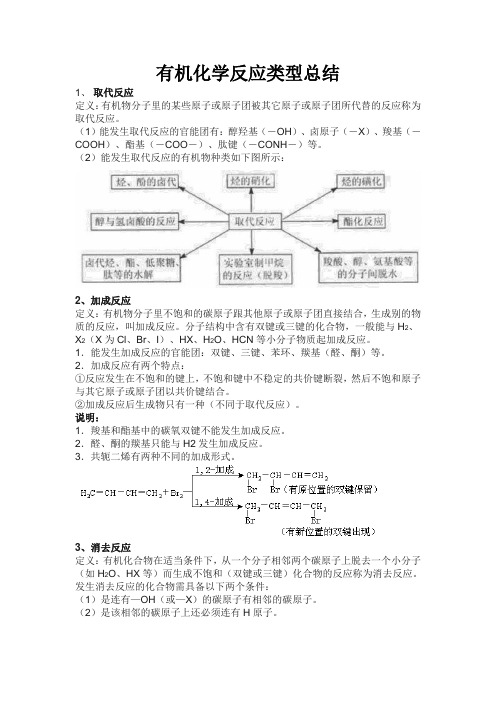
有机化学反应类型总结1、取代反应定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。
(1)能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)等。
(2)能发生取代反应的有机物种类如下图所示:2、加成反应定义:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合,生成别的物质的反应,叫加成反应。
分子结构中含有双键或三键的化合物,一般能与H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子物质起加成反应。
1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。
2.加成反应有两个特点:①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
②加成反应后生成物只有一种(不同于取代反应)。
说明:1.羧基和酯基中的碳氧双键不能发生加成反应。
2.醛、酮的羰基只能与H2发生加成反应。
3.共轭二烯有两种不同的加成形式。
3、消去反应定义:有机化合物在适当条件下,从一个分子相邻两个碳原子上脱去一个小分子(如H2O、HX等)而生成不饱和(双键或三键)化合物的反应称为消去反应。
发生消去反应的化合物需具备以下两个条件:(1)是连有—OH(或—X)的碳原子有相邻的碳原子。
(2)是该相邻的碳原子上还必须连有H原子。
(1)能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。
(2)反应机理:相邻消去发生消去反应,必须是与羟基或卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。
如CH3OH,没有邻位碳原子,不能发生消去反应。
4、聚合反应定义:有许多单个分子互相结合生成高分子化合物的反应叫聚合反应。
聚合反应有两个基本类型:加聚反应和缩聚反应(1)加聚反应:由许多单个分子互相加成,又不缩掉其它小分子的聚合反应称为加成聚合反应。
烯烃、二烯烃及含C=C的物质均能发生加聚反应。

有机反应类型总结一、取代反应1、卤代反应:烷烃在光照下与卤素(气体)发生的取代反应苯在Fe粉做催化剂的条件下和液态卤素单质发生取代反应苯的同系物在光照下侧链与卤素气体发生的取代反应(苯的同系物的取代:催化在环,光照在烷基)苯的同系物在Fe粉做催化剂的条件下和液态卤素单质发生取代反应2、硝化反应:苯和苯的同系物在加热及浓硫酸作用下与浓硝酸发生取代反应(硝基-NO2)3、磺化反应:苯在加热时与浓硫酸发生取代反应(磺酸基-SO3H)4、酯化反应:醇、纤维素(含羟基)与含有羧基的有机羧酸、含有羟基的无机含氧酸(如HNO3)在加热和浓硫酸的作用下发生取代反应生成酯和水5、水解反应:含有RCOO—R、(酯);—X等官能团的有机物在一定条件下与水反应6、醇与氢卤酸的反应:新制氢卤酸;制取卤代烃7、酚与浓溴水反应8、乙醇与浓硫酸在140℃时的脱水反应(制醚)二、加成反应1、与氢气加成:碳碳双键、碳碳三键、苯环、醛、酮羰基在催化剂的作用下能够和氢气发生加成反应2、与卤素单质加成:碳碳双键、碳碳三键与卤素单质的水溶液或有机溶液(如溴的四氯化碳溶液)发生加成反应3、与卤化氢加成:碳碳双键、碳碳三键在催化剂的作用下与卤代烃发生加成反应4、与水加成:碳碳双键、碳碳三键在加热、加压以及催化剂的作用下与水发生加成反应(水化反应)三、消去反应1、卤代烃在氢氧化钠的醇溶液中加热发生消去反应2、醇在浓硫酸和加热至170℃时发生消去反应四、氧化反应:有机物加氧或脱氢的反应1、有机物燃烧2、催化氧化:醇(连烃基的碳原子上有氢)在催化剂作用下可以发生脱氢氧化,醛基在催化剂的作用下发生得氧氧化。
3、与其他氧化剂反应:如酸性高锰酸钾苯酚可以被空气中的氧气氧化(酚由无色变粉红色)碳碳双键、碳碳三键、苯的同系物、醛基能够被酸性高锰酸钾溶液氧化;醛基能被溴水氧化醛基能够被银氨溶液或新制的氢氧化铜悬浊液氧化五、还原反应:有机物加氢去氧的反应含有碳碳双键、碳碳三键、苯环、醛基等官能团的有机物与氢气的加成六、加聚反应含有碳碳双键、碳碳三键的不饱和化合物在催化剂的作用下生成高分子化合物的反应七、缩聚反应:一种或两种以上的单体之间结合成高分子化合物,同时生成小分子(水或卤化氢)的反应。
专题十九有机反应类型
2.条件不同产物不同的例子 (1)温度不同,产物不同 CH 3CH 2OH CH 2 2 + H 2O
2CH 3CH 2OH C 2H 5OC 2H 5 + H 2O
(2)溶剂不同,产物不同 CH 3CH 2Br +H 2O C 2H 5OH + HBr
CH 3CH 2Br + NaOH CH 2 CH 2 + NaBr +H 2O
(3)浓度不同,产物不同
(C 6H 10O 5)n +n H 2O nC 6H 12O 6
(C 6H 10O 5)n 6nC +5nH 2O
170℃
浓硫酸
140℃
浓硫酸
△
NaOH
△
乙醇
稀H 2SO 4
浓H 2SO 4
(4)条件不同,产物不同
+ Br 2
+ HBr
+ Br 2
+ HBr
例1:有机化学中取代反应范畴很广。
下列五个反应中,属于取代反应的是________。
A .CH 3COONa + NaOH Na 2CO 3 + CH 4 ↑
B .CH 3 CH 3CH 2CH CHCH 3 + H 2O
C .2 CH 3CH 2OH CH 3CH 2OCH 2CH 3 + H 2O
D .(CH 3)2CHCH CH 2 + HI (CH 33
E .CH 3COOH + CH 3OH CH 3COOCH 3 + H 2O
例2:由2-氯丙烷(CH 3CHClCH 3)制取1,2-丙二醇(CH 3CHOHCH 2OH )时,依次发生的反应是: ( ) A .加成→消去→取代 B .消去→加成→取代 C .取代→消去→加成 D .取代→加成→消去
例3:某有机物的结构简式为
,
它在一定条件下可能发生的反应有:
①加成 ②水解 ③酯化④氧化 ⑤中和 ⑥消去 ( ) A .②③④ B .①③⑤⑥ C .①③④⑤ D .②③④⑤⑥
例4.现通过以下步骤由制取
3光
2Br 3 Fe
3 62%浓硫
95℃
CaO
△
140℃
浓硫酸
浓硫酸
△ C
O OH
CH 2 CHO OH
—Cl —Cl
Cl
Cl
Cl C
Cl
Cl
④⑤⑥
(已知C C C不稳定)
(1)从左到右依次每步反应所属的反应类型(a为取代,b为加成,c为消去,d为加聚,只填字母)。
①②③
④⑤⑥
(2)写出①、③两反应所需的试剂和条件:
①③
(3)写出的化学方程式
Cl Cl
Cl
B C
答案:例1,A 、C 、E 、F ; 例2,B ; 例3,C ; 例4,(1)①a ②b ③c ④b ⑤c ⑥b (2)Cl 2和Fe (或FeCl 3);NaOH 醇溶液,加热;
(3)
+ 2NaOH + NaCl + 2H
2O
+ 2Cl 2 Cl —Cl 浓硫酸
△
Cl
Cl。