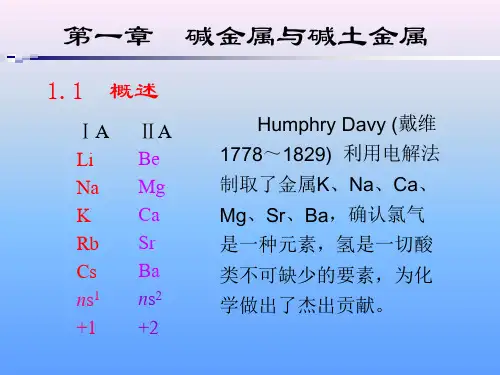
BX3是以形成大π 键来满足
对电子的要求 由于有空轨道,可接受外来 电子,均为Lewis酸
π46
BF3+NH3 == F3B:NH3
BF3+ HF == H+[BF4]- 酸性强:BF3<BCl3<BBr3<BI3 C5H5N(l)+BX3(g) C5H6N: BX3
△rH(kJ· -1) mol
BF3(g) = BCl3(g) = BBr3(g) =
-143
-189 -217
3.3 硼酸及其盐
3.3.1. 硼酸
B:SP2杂化;存在分子间氢键;
层与层之间的分子作用力结合。
H3BO3是Lewis酸,是一元酸。
其酸性很弱,Ka=5.8×10-10加入多羟
基化合物可增加酸性。
2
H2SO4
H3BO3+3CH3OH== B(OCH3)3+3H2O
Na2B4O7+CoO=2NaBO2· Co(BO2)2
除氧化物 定性分析 陶瓷、玻璃上釉 制造人造宝石
Cr2O3为绿色
Fe2O3为黄色.
Na2B4O7+7H2O == 4H3BO3+2NaOH
H3BO3+OH- == B(OH)4- PH=9.24
缓冲溶液 洗衣粉填料
3.4
GaCl2
Ga、In、Tl 简介
最简单的硼烷是B2H6
2BH3(g)=B2H6(g) △H=-148kJ· -1 mol
点击 观看 动画
三中心 两电子 氢桥键
B2H6
2L
均裂
2BH3L
异裂
[BH2L2]++[BH4]-