第二类医疗器械经营备案表
- 格式:docx
- 大小:205.53 KB
- 文档页数:71



表格及指引:附件:1、第二类医疗器械经营备案材料要求2、第二类医疗器械经营备案表3、第二类医疗器械经营备案变更表4、第二类医疗器械经营备案凭证补发表5、备案材料真实性自我保证声明6、医疗器械经营企业质量管理人简历表附件1第二类医疗器械经营备案材料要求1.第二类医疗器械经营备案表;2.企业营业执照复印件;3.企业法定代表人、负责人、质量负责人的身份、学历、职称证明复印件,质量管理人简历表;4.企业组织机构与部门设置说明;5.企业经营地址、库房地址的地理位置图、平面图(注明实际使用面积)、房屋产权证明文件或者租赁协议(附房屋产权证明文件(必须是房产证或规划许可文件))复印件;6.企业经营设施和设备目录;7.企业经营质量管理制度、工作程序等文件目录;8.经办人授权证明;9、备案材料真实性自我保证声明;10. 申请材料电子版:(1)经营备案内容Excel电子文档(2)备案申报材料电子文档(所有材料加盖公章后扫描成PDF格式)11.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
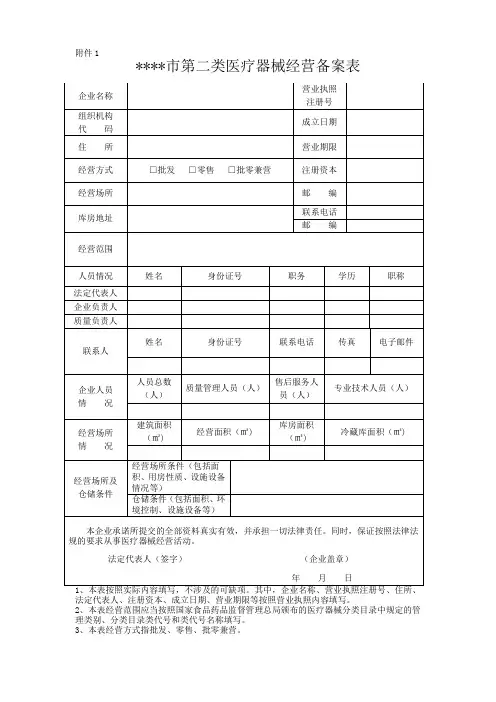
12. 申报材料目录附件2第二类医疗器械经营备案表业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表经营范围应当按照国家食品药品监督管理部门发布的医疗器械分类目录中规定的管理类别、分类编码及名称填写。
3.本表经营方式指批发、零售、批零兼营。
填表说明一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
附件3第二类医疗器械经营备案变更表填表说明:1.本表按照实际内容填写,不涉及的可缺项。

附件4江苏省第二类医疗器械经营备案表填表说明:一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人或投资人、注册资本、成立日期、营业期限等按照营业执照内容填写。
若为合伙企业,法定代表人或投资人栏填写“-”;企业负责人指法人资格企业的法定代表人或其授权的最高管理者;个人独资企业的投资人或授权的经营者;合伙企业指执行事务合伙人。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、仓库地址应按“市名+区名+路名+门牌号+楼层+室号”顺序登载。
企业有多个仓库的,应按上述方式逐一列出全部仓库地址(仅市名可省略)。
四、经营范围应分别按“非IVD批发、IVD批发和零售(零售连锁)”次序依次登录经营范围。
经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的分类目录类代号和类代号名称填写。
非IVD批发、IVD批发依企业申报的备案范围填写,不得只填写“二类医疗器械”。
五、零售是指将医疗器械直接销售给消费者的经营行为。
通常产品说明书应有产品可供消费者个人自行使用的特别说明。
符合上述条件第二类管理医疗器械主要分布在以下分类子目录中:6820家用普通诊察器械、6821家用医用电子仪器设备、6823家用超声仪器及有关设备、6824家用激光仪器设备、6826家用物理治疗及康复设备、6827家用中医器械、6840家用体外诊断试剂和检验分析仪器、6841家用化验和基础设备器具、6846个人用非植入助听器、6854家用输液制气等设备、6856家用病房护理设备及器具、6858家用冷疗冷敷设备和器具、6863个人用口腔科材料、6864家用医用卫生材料及敷料、6866家用高分子材料与制品、6870家用软件,等等。
超出此范围的,应提交医疗器械可零售说明。
六、本表应使用A4纸双面打印,不得手写。
0。
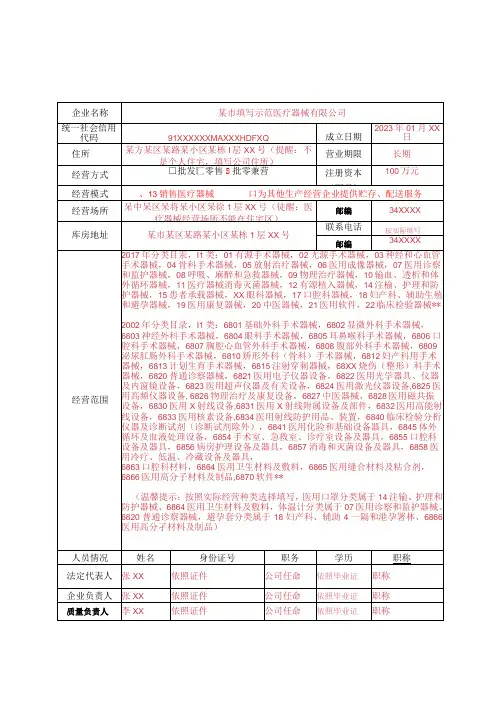
填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、统一社会信用代码、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2 .本表经营范围应当按照国家食品药品监督管理部门发布的医疗器械分类目录中规定的管理类别、分类编码及名称填写。
3 .本表经营方式指批发、零售、批零兼营。
医疗器械经营企业提供贮存、配送服务基本情况表(填写样本)本企业承诺所提交的全部资料真实有效,并承担一切法律责任。
同时.,保证按照法律法规的要求从事医疗器械经营活动。
法定代表人(签字):(企业盖章)__________________________________ ⅛___ S ____ E1-4-(同时从事第三类医疗器械经营)附:第二类医疗器械经营备案申请材料1.第二类医疗器械经营备案表》;2.第二类医疗器械经营备案表(同时从事第三类医疗器械经营);[依据《关于医疗器械经营备案有关事宜的公告》(国家食品药品监督管理总局公告2017年第129号),已取得《医疗器械经营许可证》的企业申请办理第二类医疗器械经营备案,应填写第二类医疗器械经营备案表(同时从事第三类医疗器械经营)];3.营业执照复印件;4.务定代策人、企加负责人、质量负责人的身份证明、学历或者职称证明复印件(关键人员达到拟申请经营范围的人员资质要求);5.组织机构与部门设置说明;6,经营范围、经营方式说明(符合医疗器械分类目录中规定的管理类另人类代号名称);7经营场所、J⅛房地址的地理位置图、平面图(标识温控区域、功能区域、人流物流方向、实际使用面积等);⑴自有或租赁库房:房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;⑵库房委托其他医疗器械第三方物流储运的提交:①拟委托的医疗器械第三方物流经营企业营业执照和《第二类医疗器械经营备案凭证》复印件(加盖印章,受托方提供医疗器械贮存、配送服务范围应包含委托方经营范围);②双方签定的拟委托贮存配送服务协议复印件(委托协议应有效,并含有明确双方质量责任的内容);③委托方的计算机系统端口与第三方物流仓储管理对≡说明;&经营设施、设备目录(委托第三方物流的可豁免仓库用的设施设备);9.经营质量管理制度、工作程序等文件目录(至少包括《医疗器械经营质量管理规范》要求的内容);10.计算机信息管理系统基本情况介绍和功能说明(如有);11.凡申请企业申报材料时,具体办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》;12.申报材料真实性自我保证声明,并对材料作出如有虚假承担法律责任的承诺。

第二类医疗器械经营备案表及备案材料要求第二类医疗器械经营备案表是指根据《医疗器械监督管理条例》规定,经营第二类医疗器械的企业需要填写的一份备案表格。
以下是备案表及备案材料的要求。
第一部分:备案表备案表中主要包括以下信息:1. 企业基本情况:填写企业的名称、地址、法定代表人、联系人、联系方式等基本信息。
2. 经营人员情况:列明企业的负责人、经营人员的姓名、学历、职称等情况。
3. 经营的医疗器械情况:填写经营的第二类医疗器械的名称、规格型号、生产厂家、生产日期、有效期等信息。
4. 配送渠道:说明医疗器械的配送渠道,如批发、零售、网络销售等。
5. 库房及储存条件:描述企业的库房储存条件是否符合相关要求。
6. 经营场所:填写经营场所的面积、位置、消防安全等情况。
7. 质量管理体系:说明企业是否具有健全的质量管理体系。
8. 售后服务:描述企业的售后服务体系。
9. 其他信息:填写其他需要提供的信息。
第二部分:备案材料要求除了填写备案表外,企业还需要提供以下相关材料:1. 法定代表人的身份证明:包括法人营业执照副本、法人身份证件复印件等。
2. 负责人及经营人员的身份证明:提供相应人员身份证明材料,如身份证复印件。
3. 医疗器械生产单位的许可证明:提供医疗器械生产单位的许可证明文件。
4. 医疗器械注册证书或备案凭证:提供经营的医疗器械的注册证书或备案凭证。
5. 质量管理体系认证证书:如果企业已经通过了质量管理体系认证,需要提供相关证书和报告。
6. 产品质量检验报告:针对经营的医疗器械,提供产品质量检验报告。
7. 企业营业执照副本:提供企业的营业执照副本。
8. 租赁合同或房产证明:提供经营场所的租赁合同或房产证明文件。
9. 其他相关资料:根据具体情况,提供其他相关的证明文件或资料。
以上就是第二类医疗器械经营备案表及备案材料的要求。
企业在备案时应仔细按要求填写表格,并准备好相关的材料,以确保备案的顺利进行。
同时,企业还需密切关注相关法规和政策的变化,及时更新备案信息,确保经营合规。
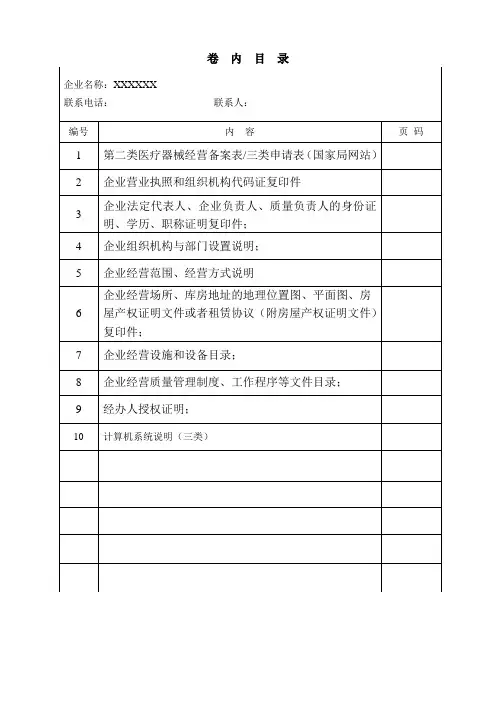
卷内目录第二类医疗器械经营备案表企业名称(公章):备案人:联系电话:申请日期:国家食品药品监督管理总局监制第二类医疗器械经营备案表(国家局网站填写)填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表经营范围应当按照国家食品药品监督管理部门发布的医疗器械分类目录中规定的管理类别、分类编码及名称填写。
3.本表经营方式指批发、零售、批零兼营。
XXXXXXX公司组织机构图质量负责人质量管理部产品销售部售后服务部采购收货验收检查销售售后服务XXXXXX公司部门设置说明(表一)部门设置说明(表二)医疗器械经营企业从业人员基本情况表填报单位(盖章)填报日期:2015年7月1日保定XXXXX公司经营范围、经营方式说明按照国家食品药品监督管理总局颁布的医疗器械分类目录,我公司的经营范围确定为:Ⅱ类医疗器械:6801基础外科手术器械,6802显微外科手术器械,6803神经外科手术器械,6804眼科手术器械,6805耳鼻喉科手术器械,6806口腔科手术器械,6807胸腔心血管外科手术器械,6808腹部外科手术器械,6809泌尿肛肠外科手术器械,6810矫形外科(骨科)手术器械,6812妇产科用手术器械,6815注射穿刺器械,6816烧伤(整形)科手术器械,6820普通诊察器械,6821医用电子仪器设备,6823医用超声仪器及有关设备,6824医用激光仪器设备,6825医用高频仪器设备,6826物理治疗及康复设备,6827中医器械,6828医用磁共振设备,6830医用X射线设备,6831医用X射线附属设备及部件,6832医用高能射线设备,6833医用核素设备,6834医用射线防护用品、装置,6840临床检验分析仪器及诊断试剂(含诊断试剂),6841医用化验和基础设备器具,6845体外循环及血液处理设备,6854手术室、急救室、诊疗室设备及器具,6855口腔科设备及器具,6856病房护理设备及器具,6857消毒和灭菌设备及器具,6858医用冷疗、低温、冷藏设备及器具,6863口腔科材料,6864医用卫生材料及敷料,6865医用缝合材料及粘合剂,6866医用高分子材料及制品。
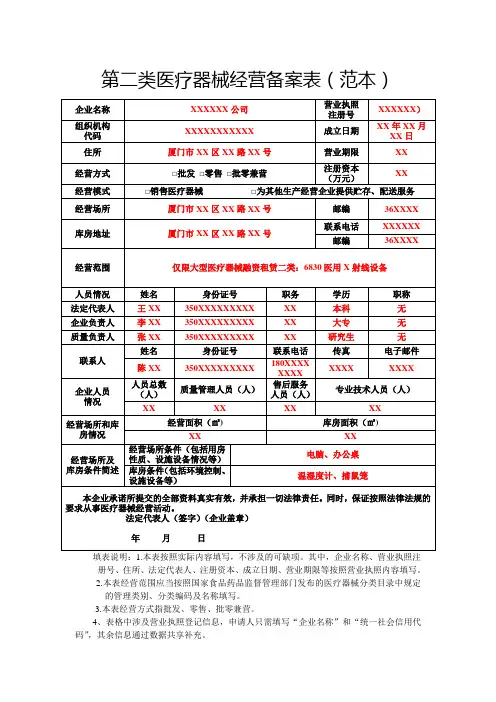
第二类医疗器械经营备案表(范本)
填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表经营范围应当按照国家食品药品监督管理部门发布的医疗器械分类目录中规定
的管理类别、分类编码及名称填写。
3.本表经营方式指批发、零售、批零兼营。
4、表格中涉及营业执照登记信息,申请人只需填写“企业名称”和“统一社会信用代码”,其余信息通过数据共享补充。
填表说明
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
组织机构代码按组织机构代码证填写,三证合一后的企业组织机构代码填写统一社会信用代码的第九位至第十七位。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
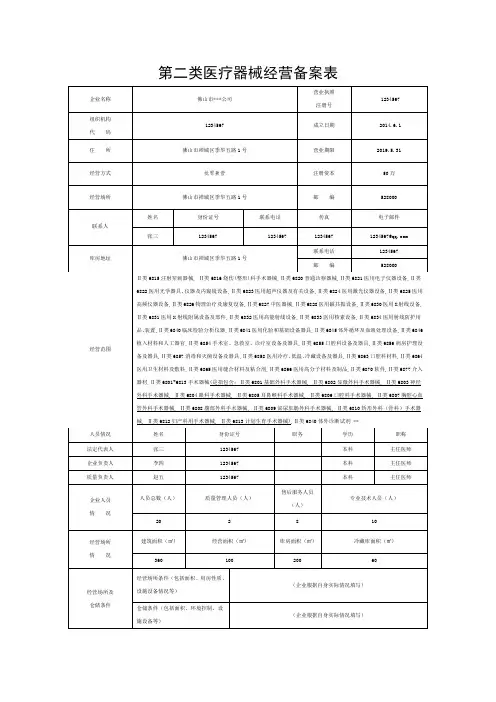
第二类医疗器械经营备案表企业名称佛山市***公司营业执照注册号1234567 组织机构代码1234567 成立日期 2014.6.1住所佛山市禅城区季华五路1号营业期限2019.5.31经营方式批零兼营注册资本50万经营场所佛山市禅城区季华五路1号邮编528000联系人姓名身份证号联系电话传真电子邮件张三1234567 1234567 1234567 1234567@ 库房地址佛山市禅城区季华五路1号联系电话1234567邮编528000经营范围Ⅱ类6815注射穿刺器械, Ⅱ类6816烧伤(整形)科手术器械,Ⅱ类6820普通诊察器械,Ⅱ类6821医用电子仪器设备,Ⅱ类6822医用光学器具、仪器及内窥镜设备,Ⅱ类6823医用超声仪器及有关设备,Ⅱ类6824医用激光仪器设备,Ⅱ类6825医用高频仪器设备,Ⅱ类6826物理治疗及康复设备,Ⅱ类6827中医器械,Ⅱ类6828医用磁共振设备,Ⅱ类6830医用X射线设备,Ⅱ类6831医用X射线附属设备及部件,Ⅱ类6832医用高能射线设备,Ⅱ类6833医用核素设备,Ⅱ类6834医用射线防护用品、装置,Ⅱ类6840临床检验分析仪器,Ⅱ类6841医用化验和基础设备器具,Ⅱ类6845体外循环及血液处理设备,Ⅱ类6846植入材料和人工器官,Ⅱ类6854手术室、急救室、诊疗室设备及器具,Ⅱ类6855口腔科设备及器具,Ⅱ类6856病房护理设备及器具,Ⅱ类6857消毒和灭菌设备及器具,Ⅱ类6858医用冷疗、低温、冷藏设备及器具,Ⅱ类6863口腔科材料,Ⅱ类6864医用卫生材料及敷料,Ⅱ类6865医用缝合材料及粘合剂,Ⅱ类6866医用高分子材料及制品,Ⅱ类6870软件,Ⅱ类6877介入器材,Ⅱ类6801~6813手术器械(是指包含:Ⅱ类6801基础外科手术器械, Ⅱ类6802显微外科手术器械, Ⅱ类6803神经外科手术器械, Ⅱ类6804眼科手术器械, Ⅱ类6805耳鼻喉科手术器械, Ⅱ类6806口腔科手术器械, Ⅱ类6807胸腔心血管外科手术器械, Ⅱ类6808腹部外科手术器械, Ⅱ类6809泌尿肛肠外科手术器械, Ⅱ类6810矫形外科(骨科)手术器械, Ⅱ类6812妇产科用手术器械, Ⅱ类6813计划生育手术器械),Ⅱ类6840体外诊断试剂 **人员情况姓名身份证号职务学历职称法定代表人张三1234567 本科主任医师企业负责人李四1234567 本科主任医师质量负责人赵五1234567 本科主任医师企业人员情况人员总数(人)质量管理人员(人)售后服务人员(人)专业技术人员(人)20 2 8 10经营场所情况建筑面积(㎡) 经营面积(㎡) 库房面积(㎡) 冷藏库面积(㎡) 360 100 200 60经营场所及仓储条件经营场所条件(包括面积、用房性质、设施设备情况等)(企业根据自身实际情况填写)仓储条件(包括面积、环境控制、设施设备等)(企业根据自身实际情况填写)本企业承诺所提交的全部备案材料真实有效,并承担因失实引发的一切法律责任。
第二类医疗器械经营备案表
填表说明
一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
第二类医疗器械经营备案材料要求
1.第二类医疗器械经营备案表;
2.企业营业执照复印件;
3.企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件;
4.企业组织机构与部门设置说明;
5.企业经营地址、库房地址的地理位置图、平面图(注明实际使用面积)、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;
6.企业经营设施和设备目录;
7.企业经营质量管理制度、工作程序等文件目录;
8.经办人授权证明;
9.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第二类医疗器械经营备案凭证
备案号:粤禅食药监械经营备20141001号
备案部门(公章)
备案日期:年月日。
表格及指引:附件:1、第二类医疗器械经营备案材料要求2、第二类医疗器械经营备案表3、第二类医疗器械经营备案变更表4、第二类医疗器械经营备案凭证补发表5、备案材料真实性自我保证声明6、医疗器械经营企业质量管理人简历表.附件1第二类医疗器械经营备案材料要求1.第二类医疗器械经营备案表;2.企业营业执照复印件;3.企业法定代表人、负责人、质量负责人的身份、学历、职称证明复印件,质量管理人简历表;4.企业组织机构与部门设置说明;5.企业经营地址、库房地址的地理位置图、平面图(注明实际使用面积)、房屋产权证明文件或者租赁协议(附房屋产权证明文件(必须是房产证或规划许可文件))复印件;6.企业经营设施和设备目录;7.企业经营质量管理制度、工作程序等文件目录;8.经办人授权证明;9、备案材料真实性自我保证声明;10. 申请材料电子版:(1)经营备案内容Excel电子文档.(2)备案申报材料电子文档(所有材料加盖公章后扫描成PDF格式)11.其他证明材料。
备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
12. 申报材料目录附件2第二类医疗器械经营备案表.填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表经营范围应当按照国家食品药品监督管理部门发布的医疗器械分类目录中规定的管理类别、分类编码及名称填写。
3.本表经营方式指批发、零售、批零兼营。
.填表说明一、本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
二、本表经营范围应当按照国家食品药品监督管理总局颁布的医疗器械分类目录中规定的管理类别、分类目录类代号和类代号名称填写。
三、本表经营方式指批发、零售、批零兼营。
四、本表应使用A4纸双面打印,不得手写。
第二类医疗器械经营备案表Coca-cola standardization office【ZZ5AB-ZZSYT-ZZ2C-ZZ682T-ZZT18】枣庄浩翔医疗器械有限公司《医疗器械经营许可证》申报材料目录1、《医疗器械经营经营许可申请表》一份;2、企业《营业执照》正、副本和企业《组织机构代码证》正、副本复印件各一份;3、法定代表人、企业负责人、质量负责人的身份证明、学历或者职称证明复印件:①法定代表人、企业负责人李义身份证、学历证书复印件各一份;②质量负责人张桂真身份证、学历证书复印件各一份;③关键人员任命文件复印件一份;4、企业组织机构与部门设置说明;5、经营范围、经营方式说明;6、企业经营场所、库房地址的地理位置图和标注实际使用面积的平面图、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;7、企业经营设施、设备目录;8、《医疗器械经营质量管理制度》、《体外诊断试剂质量管理制度》等文件目录各一份;9、经办人授权证明;10、其他证明材料:拟经营医疗器械产品注册证复印件共两份。
备案号:第二类医疗器械经营备案材料企业名称:枣庄浩翔医疗器械有限公司经营场所:山东省枣庄市薛城区永福南路永福新苑7号楼过道南北至南数1、2、3间法定代表人:李义联系人:李义072015年 4月27日第二类医疗器械经营备案表填表说明:1.本表按照实际内容填写,不涉及的可缺项。
其中,企业名称、营业执照注册号、住所、法定代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表经营范围应当按照国家食品药品监督管理部门发布的医疗器械分类目录中规定的管理类别、分类编码及名称填写。
3.本表经营方式指批发、零售、批零兼营。
企业营业执照副本质量负责人(张桂真)身份证复印件质量负责人(张桂真)学历证复印件质量负责人(***)身份证复印件质量负责人(***)学历证复印件【2015】1号关于对关键人员任命的决定公司各部门:为更好的开展工作,加强质量管理和售后服务,明确各员工的职责,根据公司的基本情况,经研究决定,对有关人员进行任命,从签发之日起生效,决定具体如下:1、企业负责人:李义2、质量管理科科长:张桂真枣庄浩翔医疗器械有限公司公司法人签字:2015年4月27日枣庄浩翔医疗器械有限公司企业组织机构与部门设置说明一、企业组织机构图2015年 4月27日二、部门设置说明(一)经理的职能经理对本企业所经营医疗器械产品的质量和质量管理体系的建立和运行全面负责。
1.组织贯彻上级政策、法规和指令及公司的质量方针。
2.主持制定本企业质量方针、目标、规划和计划,建立健全质量责任制,并首先在领导层落实。
3.设置并领导质量管理机构和售后服务机构,保证其独立、客观地行使用职权,支持其合理意见和要求。
4.重视客户意见和投诉处理,支持重大质量事故的处理和重大质量问题的解决和质量改进。
(二)质量管理科的职能1.负责企业全面质量管理工作。
2.负责起草、编制产品质量管理制度和经营环节质量程序文件并指导、检查、督促实施。
3.负责经营产品的质量审核;质量验收、养护和质量查询工作,接受质量技术问题的咨询。
4.建立质量标准档案,严格按法定标准进行检验。
5.加强检验场地、设施、设备、仪器建设和管理,建立健全检验操作规程,规范操作,数据准确。
6.负责计量管理工作,对本企业量值传递的准确性负责。
7.负责规范本企业的质量管理的基础资料,定期整理收集质量信息,建立完整的质量信息网络系统。
8.负责本企业产品的进货检验及验收并作好检验及验收记录。
9.组织检测人员业务学习,加强产品知识的培训考核,保证其持证上岗规范操作。
10.负责技术性文件的归口管理;11.负责内部审核的管理;12.负责本部门记录的填写、传递和归档管理;13.参与质量策划和管理评审。
14.产品来货验收,详细检查来货产品的各类标识,外观质量和包装质量,发现质量问题及时与质量管理科取得联系,把好产品质量入库关。
15.加强在库产品的保管养护,严格执行产品分类、分区存放、堆码规范。
按照产品性能组织在库养护,针对气候温度等情况采取适当的养护措施,严格执行在库产品的季节检查,确保在库产品质量安全有效。
16.加强效期产品的管理,设置效期产品一览表,严格执行三先出原则,近期产品催调报告和过期产品报损等。
17.加强产品出库验发工作,依据出库凭证与实货逐项严格核结,检查包装完好状况,防止出库差错。
18.出库时按批号发货,并准确记录进、出批号、数量,便于质量跟踪。
19.产品验收、养护、复核记录按规范逐项填写、内容完整、准确、清晰,并按规定保存备查。
20.加强产品的储运工作,产品在运输过程中确保不受损坏。
质量验证员1.负责按法定产品标准和合同规定的质量条款逐批进行验收。
2.严格按规定的抽样数量、验收方法、判断标准进行验收,重点验收标识、外观质量和包装质量。
对销货退回、贵重、特殊、效期、无菌等产品加强验收。
3.规范填写验收记录,字迹清楚,内容真实,项目齐全,批号数量准确,并签章负责,按规定保存备查。
仓库保管员1.按照产品的性能和贮存条件分类分区储存、对因储存不当发生质量问题负责。
2.按安全、方便、节约的原则,整齐、牢固堆垛、五距规范、合理利用仓储面积,区域划分合理、标识明显。
(三)销售科1.具体负责产品采购、销售及储运过程的质量管理工作。
2.对供货单位和销售对象进行资格认定,杜绝与非法经营单位发生往来。
3.负责对供货单位进行年度评审.4.会同质量管理科对供货单位的质量保证能力进行考察,签订合同明确必要的质量条款,负责填报首次进货产品的审批表。
(四)售后服务科1.具体负责产品的技术培训和售后服务工作。
2.加强检测设施的配置,经常检查检测设施设备的使用状况,确保其正常运行。
3.对客户反映质量问题的投诉、查询、退换、货进行追踪调查,弄清原因和责任,做到件件有交待,桩桩有答复,并研究整改措施。
4.广泛收集客户对产品质量、工作质量、服务质量的评价意见,做好,建立用户访问档案,纳入质量信息网络中。
法定代表人签字:2015年4月27日枣庄浩翔医疗器械有限公司经营范围和经营方式说明一、经营范围说明:公司拟经营Ⅱ类医疗器械:6854:医用升温毯(海明体表加温毯)、6864:医用眼部保护敷贴※※二、经营方式说明:公司拟经营方式为批零兼营,将医疗器械销售给具有资质的医疗器械经营企业或医疗机构使用单位或直接销售给消费者。
法定代表人签字:2015年4月27日企业经营场所、库房地址的地理位置图企业经营场所(标注实际使用面积)库房平面图(标注实际使用面积)租赁协议复印件房屋产权证明文件复印件1房屋产权证明文件复印件2房屋产权证明文件复印件3枣庄浩翔医疗器械有限公司经营设施、设备目录枣庄浩翔医疗器械有限公司医疗器械经营质量管理制度目录医疗器械经营质量管理制度发布实施规定说明1、经营企业质量责任制度 (29)2、各级人员质量职责 (30)3、首营企业和首营品种质量审核制度 (31)4、采购合同管理制度 (33)5、购进产品质量验收验证制度 (33)6、储存(包括安全、消防)管理制度 (34)7、门市部管理制度 (35)8、效期产品管理制度 (39)9、不合格产品管理制度 (39)10、销售产品出库复核和批号跟踪制度 (37)11、医疗器械产品售后服务制度 (37)12、质量投诉处理制度 (38)13、不良事件报告制度 (38)15、文件、记录、档案管理制度 (39)16、人员管理(培训、体检等)制度 (40)法定代表人签字:2015年4月27日一、医疗器械经营企业质量责任制度1、严格遵守《医疗器械监督管理条例》法规以及有关医疗器械管理规定,按国家药品监督管理部门制定的《医疗器械经营企业监督管理办法》规范企业经营行为,在《经营许可证》核定的经营方式和范围内从事医疗器械营销活动。
2、企业负责人、医疗器械质量人员应熟悉掌握有关医疗器械的法规和行政规章,并贯彻执行。
3、从事医疗器械经营的人员必须具有高中以上(含高中)文化水平,并接受相应的专业知识和医疗器械法规培训,具有良好的商业道德,在法律上无不良品行记录,其质量人员应经市级药品监督管理部门考试合格后持证上岗。
4、坚持“按需进货、择优采购”的原则选择药品的供货商,对供货单位的生产(经营)合法性、资质、诚信、质量历史、质量体系状况等进行分析考察,向供货方索取盖有原印章的《医疗器械生产(经营)许可证》、《营业执照》。
同时应对供货方销售员进行合法资格验证、索取法人授权委托书、供货人身份证明、联系地址等,以确保购进的医疗器械质量符合规定要求。
5、采购医疗器械应与供货方签订“质量保证协议”或购货合同。
6、首营企业应对其资格和质量保证能力进行审核;首营医疗器械产品应对其质量性以及合法进行性审核。
7、质量人员负责质量不合格医疗器械的审核,对不合格医疗器械的处理过程实施监督。
8、质量人员负责起草医疗器械质量管理制度,并指导、督促制度的执行。
9、电话要货、口头电传等应形成文字记录,凡涉及合同及有关履行合同变更和解除合同的往来信件、电话记录、传真以及所有业务活动的记录均应归档,保存五年备查。
二、各级人员质量责任制度企业负责人的质量责任1、组织贯彻医疗器械监督管理的有关法规和规章;2、严格按照批准的经营范围和经营方式从事医械经营活动;3、教育职工树立“质量第一”的思想;4、审批有关质量文件,保证质量管理人员行使职权;5、对制度执行情况进行检查考核。
质量管理人员的质量责任1、负责收集宣传贯彻医械监督管理的有关法规和规范性文件;2、负责收集所经营医疗器械产品的质量标准;3、负责起草各项质量管理制度;4、负责对首营企业和首营品种进行质量审核;5、指导产品验收、售后服务工作;6、检查制度执行情况。
质量验收人员的质量责任1、严格执行产品质量验收制度;2、根据有关标准和合同质量条款对医械产品质量进行验收;3、建立真实、完整的验收记录,并妥善保存。
养护保管人员的质量责任1、严格执行产品储存养护制度;2、实行色标管理,分区存放,并有明显标志;3、加强产品效期管理;4、对不合格产品进行控制性管理;5、做好防尘、防潮、防霉、防污染及防虫、防鼠工作。
销售和售后服务人员的质量责任1、正确介绍产品性能,提供咨询服务;2、产品销售前应进行复核和质量检查;3、对顾客反映的问题及时处理解决;4、售后质量查询、投诉应详细记录及时处理。
三、首营企业和首营品种质量审核制度1、首次经营企业是指购进医疗器械时,与本企业首次发生供需关系的医疗器械生产或经营企业。
2、首次经营品种是指本企业向某一医疗器械生产企业首次购进的医疗器械。
3、购进医疗器械应以质量为前提,对与本企业首次发生供需关系的供货企业应进行包括资格和质量保证能力的审核。