沉淀溶解平衡
- 格式:doc
- 大小:600.50 KB
- 文档页数:15




沉淀溶解平衡及应用考点一沉淀溶解平衡及应用1.沉淀溶解平衡(1)沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
(2)溶解平衡的建立固体溶质溶解沉淀溶液中的溶质①v溶解>v沉淀,固体溶解②v溶解=v沉淀,溶解平衡③v溶解<v沉淀,析出晶体(3)溶解平衡的特点(4)影响沉淀溶解平衡的因素①内因难溶电解质本身的性质,这是决定因素。
②外因以AgCl(s)Ag+(aq)+Cl-(aq) ΔH>0为例外界条件移动方向平衡后c(Ag+)平衡后c(Cl-)K sp升高温度正向增大增大增大加水稀释正向不变不变不变加入少量AgNO3逆向增大减小不变通入HCl 逆向减小增大不变通入H2S 正向减小增大不变(5)电解质在水中的溶解度20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:2.沉淀溶解平衡的应用(1)沉淀的生成①调节pH法如:除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH+4。
②沉淀剂法如:用H2S沉淀Cu2+,离子方程式为H2S+Cu2+===CuS↓+2H+。
(2)沉淀的溶解①酸溶解法如:CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
②盐溶液溶解法如:Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH+4===Mg2++2NH3·H2O。
③氧化还原溶解法如:不溶于盐酸的硫化物Ag2S溶于稀HNO3。
④配位溶解法如:AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
(3)沉淀的转化①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。
②应用:锅炉除垢、矿物转化等。
深度思考1.下列方程式:①AgCl(s)Ag+(aq)+Cl-(aq)、②AgCl===Ag++Cl-、③CH3COOH CH3COO-+H+各表示什么意义?答案①AgCl的沉淀溶解平衡;②AgCl是强电解质,溶于水的AgCl完全电离;③CH3COOH的电离平衡。


沉淀溶解平衡一.沉淀溶解平衡沉淀溶解过程—速率v1AgCl(s)Ag+(aq) + Cl—(aq)沉淀生成过程—速率v2v1 >v2——沉淀溶解——溶液不饱和v1 = v2——溶解的沉淀= 生成的沉淀——溶液饱和——处于平衡状态v1 ﹤v2 ——沉淀生成——溶液过饱和1.概念1)溶解度:在一定温度下,某物质在100g溶剂里达到饱和状态所溶解的克数,叫做这种物质在这种溶剂里的溶解度。
2)不饱和溶液:在一定温度下,溶液的浓度小于在该温度下的饱和溶液的浓度。
3)过饱和溶液:在一定温度和压强下,溶剂中所溶解的溶质超过最大量的溶液,叫做这种溶质的过饱和溶液。
有些物质的溶解度随温度的升高而增大。
在较高温度下配制成它的饱和溶液,并细心滤去过剩的未溶固体,然后使溶液慢慢降到室温,但尚未析出晶体,这时得到的溶液就是过饱和溶液。
硫酸钠、醋酸钠、硼砂、硫代硫酸钠、蔗糖等物质都容易形成过饱和溶液。
过饱和溶液存在的原因是,有些溶质在饱和溶液中不容易形成结晶中心(即晶核)。
每种晶体都有一定的排列顺序(即晶格),使原来无秩序运动的溶质质点按照这种晶体的晶格次序排列起来。
有些物质要经过相当长的时间才能自行产生结晶中心,因此这些物质的过饱和溶液还是比较稳定的。
从本质上看,过饱和溶液是处于不平衡状态或称介稳定状态。
在过饱和溶液中投入一小颗溶质的晶体(或投入晶形相同的其他物质),能使过量的溶质在短时间内结晶出来,得到饱和溶液。
用力振荡或充分搅动过饱和溶液,或者摩擦容器的器壁,也能使过量的溶质迅速结晶出来。
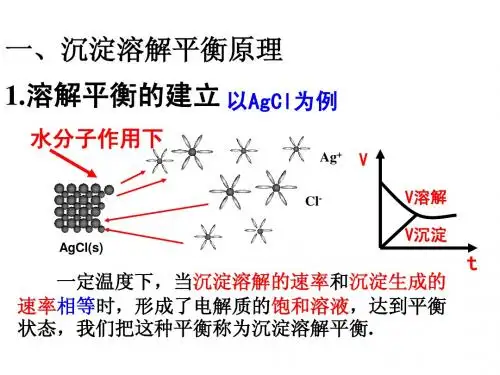
4)沉淀溶解平衡:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成溶质的饱和溶液,达到平衡状态,人们将这种平衡称为沉淀溶解平衡。
2.特点:将一块形状不规则的NaCl固体放入NaCl饱和溶液中,一昼夜后观察发现,固体变为规则的立方体,而质量却未发生变化逆:是一个可逆的过程等:v1 = v2动:v1 = v2≠0——动态平衡定:溶液中溶质的分子或离子的浓度不再变化。


沉淀溶解平衡知识点沉淀溶解平衡是化学平衡的一种,涉及到溶解度的概念和沉淀生成与转化等知识点。
下面将对沉淀溶解平衡知识点进行详细的介绍。
一、沉淀溶解平衡的定义沉淀溶解平衡是指在一定温度下,当溶液中的离子浓度达到平衡状态时,沉淀溶解反应停止,形成的固体和溶液中各离子的浓度保持不变的状态。
此时,溶液中的阴阳离子浓度满足溶度积常数,并且溶液中的沉淀和溶解反应速率相等。
二、沉淀溶解平衡的特点1、动态平衡:沉淀溶解平衡是一个动态平衡,即沉淀和溶解反应不断进行,但速率相等,因此溶液中的离子浓度保持不变。
2、溶解度与温度有关:物质的溶解度随温度变化而变化。
一般来说,温度越高,溶解度越大。
3、溶度积常数:在一定温度下,沉淀溶解平衡时,溶液中的阴阳离子浓度满足溶度积常数。
这个常数只与温度有关,与溶液的浓度无关。
4、沉淀的生成与转化:当溶液中某离子的浓度超过其溶度积常数时,会形成沉淀。
然而,形成的沉淀可以转化为更难溶的物质,或者转化为可溶性的化合物。
三、沉淀溶解平衡的应用1、判断沉淀的生成与转化:通过比较溶液中的离子浓度和溶度积常数,可以判断是否会形成沉淀以及沉淀的生成与转化。
2、计算溶解度:已知某物质的溶度积常数和溶液中的离子浓度,可以计算该物质的溶解度。
3、处理工业废水:在处理含有重金属离子的工业废水时,可以利用沉淀溶解平衡的原理,将重金属离子转化为难溶性的化合物,从而降低对环境的危害。
4、药物制备:在药物制备过程中,可以利用沉淀溶解平衡的原理,将药物中的有效成分转化为难溶性的化合物,以提高药物的疗效和稳定性。
总之,沉淀溶解平衡是化学平衡的一种重要类型,涉及到溶解度的概念和沉淀生成与转化等知识点。
理解并掌握沉淀溶解平衡的概念和特点对于解决相关问题具有重要意义。
“沉淀溶解平衡”的单元整体教学设计一、教学内容与目标本单元将带领学生探究沉淀溶解平衡的原理及其在日常生活中的应用。
通过实验和实践,学生将了解沉淀溶解平衡的基本概念,掌握沉淀溶解平衡的规律,了解影响沉淀溶解平衡的因素,并能够解释这些因素对沉淀溶解平衡的影响。


沉淀溶解平衡【考纲展示】理解难溶电解质的沉淀溶解平衡及沉淀转化的本质。
【知识回顾】 一、沉淀溶解平衡1.沉淀溶解平衡以AgCl 为例:在一定温度下,当沉淀溶解和生成的速率相等时,便得到饱和溶液,即建立下列动态平衡:AgCl(s)Ag +(aq)+Cl -(aq)2.溶解平衡的特征1) :动态平衡2) :溶解和沉淀速率相等3) :达到平衡,溶液中离子浓度保持不变4) :当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3. 影响沉淀溶解平衡的因素1)内因:难溶电解质本身的性质2)外因:①浓度:加水稀释,沉淀溶解平衡向 方向移动。
K sp .②温度:多数难溶性电解质溶解于水是 热的,所以升高温度,沉淀溶解平衡向方向移动。
③同离子效应:向沉淀溶解平衡体系中,加入相同的离子,使平衡向沉淀方向移动。
④其他:向体系中加入可与体系中某些离子反应生成更难溶或气体的离子,使平衡向溶解方向移动。
以AgCl(s)Ag +(aq)+Cl -(aq) H>0为例2.判断:AgCl 在同浓度的CaCl 2和NaCl 溶液中的溶解度相同( )3.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水 ②0.1 mol·L -1盐酸 ③0.1 mol·L -1氯化镁溶液 ④0.1 mol·L -1硝酸银溶液中,Ag +浓度: 二、溶度积1.溶度积(K sp )表达式 溶解 沉淀sp溶度积(K sp)反映了电解质在水中的溶解能力,对于阴阳离子个数比相同的电解质,K sp的数值越大,难溶电解质在水中的溶解能力越强;但对于阴阳离子个数比不同的电解质,不能直接比较K sp数值的大小。
3.溶度积应用沉淀的生成或溶解的判断方法:Q c K sp,溶液过饱和,有沉淀析出;Q c=K sp,溶液饱和,沉淀的生成与溶解处于平衡状态;Q c K sp,溶液未饱和,无沉淀析出。
例.我们做过一道题:在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,不能说明K sp(BaSO4)>K sp(BaCO3)实际K sp(BaSO4)=1×10-10 mol2·L-2 K sp(BaCO3)= 5×10-9 mol2·L-2请说明BaCO3是如何形成的:三、沉淀的转化1.沉淀转化的实质是2.应用,通常,一种沉淀可以转化为,两种难溶物的溶解能力差别,这种转化的趋势就越大。
沉淀溶解平衡一、选择题(本题包括6小题,每题4分,共24分)1.有关CaCO3的溶解平衡的说法中,不正确的是( )A.CaCO3沉淀析出和沉淀溶解不断进行,但速率相等B.CaCO3难溶于水,其饱和溶液几乎不导电,属于弱电解质溶液C.升高温度,CaCO3沉淀的溶解度增大D.向CaCO3沉淀中加入纯碱固体,CaCO3的溶解度降低【解析】选B。
达到平衡v沉淀溶解=v沉淀析出,A正确; CaCO3难溶于水,但溶解的部分完全电离出离子,属于强电解质溶液,B错误;一般温度越高,溶解度越大,C正确;纯碱电离出C抑制CaCO3沉淀溶解,CaCO3的溶解度降低,D正确。
2.25 ℃时,5种银盐的溶度积常数(K sp)如表所示,下列选项正确的是( )AgCl Ag2SO4Ag2S AgBr AgI1.8×10-101.4×10-56.3×10-505.0×10-138.3×10-17A.AgCl、AgBr和AgI的溶解度依次增大B.将Ag2SO4溶于水后,向其中加入少量Na2S溶液,不可能得到黑色沉淀C.室温下,AgCl在水中的溶解性小于在食盐水中的溶解性D.将浅黄色溴化银浸泡在饱和NaCl溶液中,会有少量白色固体生成【解析】选D。
由表中数据可知,AgCl、AgBr、AgI的K sp依次减小,因此溶解度依次减小,A项错误;K sp(Ag2SO4)>K sp(Ag2S),因此向Ag2SO4溶液中加入少量Na2S溶液,Ag2SO4会转化为Ag2S,产生黑色沉淀,B项错误;食盐水相对于水,c(Cl-)增大,则AgCl在食盐水中的溶解平衡逆向移动,溶解性减小,C项错误;在氯化钠的饱和溶液中,氯离子的浓度较大,溴化银固体浸泡在其中,在溴化银溶解过程中会使氯离子与银离子的离子积大于其溶度积,所以会有少量白色固体生成,D项正确。
【加固训练】下列说法中,正确的是 ( )A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止B.K sp越小,难溶电解质在水中的溶解能力一定越弱C.K sp的大小与离子浓度无关,只与难溶电解质的性质和温度有关D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同【解析】选C。
难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀溶解平衡是动态平衡,沉淀和溶解速率相同,A错误;K sp可用来判断相同类型的化合物在水中溶解度的大小,但是如果化合物的类型不同,就不能进行直接判断,K sp越小的难溶电解质在水中的溶解能力不一定越弱,B错误;沉淀溶解平衡存在溶度积常数,K sp 的大小与离子浓度无关,只与难溶电解质的性质和温度有关,C正确;相同温度下,AgCl在水中的溶解能力大于在NaCl溶液中的溶解能力,因为氯化钠溶液中氯离子对氯化银溶解起到抑制作用,D错误。
3.已知25 ℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol·L-1。
若在5 mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8 mL 0.01 mol·L-1 AgNO3溶液,下列叙述正确的是( )A.混合溶液中c(K+)>c(N)>c(Ag+)>c(Cl-)>c(I-)B.混合溶液中c(K+)>c(N)>c(Cl-)>c(Ag+)>c(I-)C.加入AgNO3溶液时首先生成AgCl沉淀D.混合溶液中约为1.02×10-3【解析】选B。
KCl、KI混合溶液中加入AgNO3溶液,先生成AgI,再生成AgCl,AgNO3+KI AgI↓+KNO3,n(KCl)=n(KI)=0.01 mol·L-1×5mL=5.0×10-5mol,生成AgI消耗n(AgNO3)=5.0×10-5 mol,与KCl发生反应,剩余的AgNO3为0.01 mol·L-1×8mL×10-3-5.0×10-5mol=3.0×10-5 mol,与KCl发生反应则KCl 过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀,由上所述可知,A、C错误,B正确;混合溶液中c(Cl-)>c(I-),>1,D错误。
【加固训练】可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。
医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:某温度下,K sp(BaCO3)=5.1×10-9;K sp(BaSO4)=1.1×10-10。
下列推断正确的是( )A.不用碳酸钡作为内服造影剂,是因为K sp(BaCO3)>K sp(BaSO4)B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替C.若误饮c(Ba2+)=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒D.可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃【解析】选D。
胃液中为盐酸环境,难溶的碳酸盐在胃液中会溶解,故A、B错误;硫酸钡作内服造影剂,说明硫酸钡电离出的钡离子浓度是安全的,此时c(Ba2+)= =1.05×10-5mol·L-1>1.0×10-5mol·L-1,故误饮c(Ba2+)=1.0×10-5mol·L-1的溶液时,不会引起钡离子中毒,故C错误;用0.36 mol·L-1的Na2SO4溶液洗胃时,胃液中:c(Ba2+)== mol·L-1=3.1×10-10mol·L-1<1.05×10-5mol·L-1,故D正确。
4.(2020·渭南模拟)已知lg2=0.301 0,K sp[Mn(OH)2]=2.0×10-13 mol3·L-3。
实验室制氯气的废液中含[Mn2+]=0.1 mol·L-1,向该溶液中滴加稀氢氧化钠溶液至Mn2+完全沉淀的最小pH等于( )A.8.15B.9.3C.10.15D.11.6【解析】选C。
Mn2+沉淀较为完全时的浓度为1×10-5 mol·L-1,已知K sp=[Mn2+][OH-]2,[OH-]== mol·L-1=×10-4mol·L-1,[H+]== mol·L-1=×10-10 mol·L-1,所以pH=-lg=10+lg2≈10.15。
5.溶洞的形成与碳酸钙的溶解平衡有关。
如图是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的沉淀溶解平衡曲线。
下列有关说法正确的是( )A.CaCO3(s)Ca2+(aq)+C(aq) ΔH<0B.a、b、c、d四点对应的溶度积K sp相等C.25 ℃时,CaCO3的K sp=2.8×10-9D.温度不变,挥发水分,可使溶液由a点变到c点【解析】选C。
由题干图象可知,100 ℃时碳酸钙的溶度积大于25 ℃时的溶度积,故其溶解过程吸热,即ΔH>0,A项错误;K sp仅与温度有关,但a、d点温度不确定,B项错误;25 ℃时,用c点数据计算,K sp=c(Ca2+)·c(C)=2.0×10-5×1.4×10-4=2.8×10-9,C项正确;挥发水分,c(Ca2+)、c(C)均增大,而a点到c 点,c(Ca2+)不变,D项错误。
6.氢氧化钙是一种微溶于水的碱。
如图是Ca(OH)2在温度分别为T1、T2时的两种沉淀溶解平衡曲线(浓度单位为mol·L-1,与曲线Ⅰ对应的K sp=4×10-6,≈1.6)。
下列说法中正确的是( )A.温度:T1<T2B.在温度为T1时,P点分散系中分散质粒子直径<1 nmC.Q点的溶液中c(OH-)约为0.012 5 mol·L-1D.加水稀释时溶液碱性减弱,Z点溶液可转化为Q点溶液【解析】选C。
因Ca(OH)2溶解度随着温度的升高而减小,故曲线Ⅰ对应的温度较高,A错误;P点分散系相对T1是过饱和的,属于不稳定的浊液,B错误;由Ca(OH)2(s)Ca2+(aq)+2OH-(aq)及K sp可求出c(OH-)=0.012 5 mol·L-1,C正确;加水稀释时,Ca2+、OH-浓度均减小,D错误。
二、非选择题(本题包括2小题,共26分)7.(12分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是。
A.KMnO4B.H2O2C.Cl2D.HNO3然后再加入适当物质调整至溶液pH=3.6,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列物质中的。
A.NaOHB.NH3·H2OC.CuOD.Cu(OH)2(2)甲同学怀疑调整至溶液pH=3.6是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积K sp=8.0×10-38,Cu(OH)2的溶度积K sp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为,Fe3+完全沉淀时溶液的pH为,通过计算确定上述方案(填“可行”或“不可行”)。
(已知lg2=0.3)【解析】(1)A、C、D三项虽然能氧化Fe2+,但引入了新的杂质离子,故只有B项符合要求。
加入 CuO、Cu(OH)2能中和溶液中的H+,达到调节溶液pH的效果,而没有引入新的杂质离子。
(2)由K sp[Cu(OH)2]=c(Cu2+)×c2(OH-)=3.0×10-20,求得c(OH-)=10-10 mol·L-1,pH=4,而Fe3+沉淀完全时,则满足K sp[Fe(OH)3]=8.0×10-38,此时c(Fe3+)=1×10-5 mol·L-1,此时c(OH-)=2×10-11 mol·L-1,pH=3.3,也就是说,当Cu2+还未沉淀时,Fe3+早已沉淀完全,可行。